CD39小分子抑制剂ARL67156增强NK细胞对胃癌细胞的杀伤作用
龚 英,艾丽飞热·艾麦提,何宗忠
1南方医科大学南方医院检验医学科,广东 广州 510515;2南部战区总医院输血医学科,广东 广州510010
胃癌是一种常见的恶性消化道肿瘤,我国每年约有40万人死于该疾病[1,2],胃癌治疗后的平均总生存时间(mOS)为7.5~12月[3,4]。常见的胃癌治疗手段有:传统方式(包括:手术、放疗、化疗)和新疗法(包括:靶向治疗、免疫治疗等)[5]。然而,传统治疗方式有诸多不足,比如:对肿瘤组织的特异靶向性差,不能够有效区分正常组织和癌组织,常引发正常组织产生损伤,当胃癌发生转移后,很多传统方法难以用于一线治疗[5]。近年来,肿瘤免疫治疗方法,因其靶向性好、特异性高、副作用小等优点,逐渐在临床胃癌治疗中广泛应用起来[5]。胃癌肿瘤细胞表面表达多种肿瘤相关抗原,如:靶向肿瘤抗原Her2。临床已应用多种特异性靶向肿瘤相关的抗体治疗胃癌,靶向Her2单克隆抗体已作为胃癌的一线治疗药物[6]。但是肿瘤逃逸的机制,如:表达肿瘤抗原减少、主要组织相容性复合体(MHC)-I类分子缺失、抑制性肿瘤微环境、阻碍免疫细胞进入到肿瘤组织内等机制,常常引发胃癌肿瘤细胞对免疫疗法的耐药[7,8]。研发高效、特异、副作用低的肿瘤免疫新疗法,是实现胃癌精准治疗的迫切任务。
自然杀伤性细胞(NK细胞)是人体外周血的淋巴细胞,其特征性的表面分子是CD56和CD16,不表达CD3,具有很强的抗肿瘤和抗病毒的能力[9]。因其能够识别MHC-I类分子缺失的肿瘤细胞,不依赖于MHC分子的限制性,并且其杀伤肿瘤效率高等特点,NK细胞常被用于肿瘤免疫治疗[9]。NK细胞的功能受到其表面的活化性信号分子和抑制性信号分子的控制,当NK细胞的抑制性信号减少的时候,活化性信号占主导地位时,NK细胞表现出很强的杀伤靶细胞的活力[10]。近年来,在白血病治疗中,过继NK细胞治疗方法取得了令人满意的结果,但是在实体瘤中,存在抑制性的肿瘤微环境,限制了NK细胞的功能[11]。如何提高NK细胞在实体肿瘤中的抗肿瘤活性,受到了越来越多的关注[12]。
CD39 是胞外2’3’磷酸核苷酸水解酶(2’3’Phosphonucleotide hydrolase),具有Ca2+、Mg2+离子依赖的胞外核苷酸水解酶活性,能够将细胞外ATP(eATP)和eADP水解生成eAMP,进而生成腺苷,腺苷通路通过抑制PI3K/PKA/AKT/FOXO1通路,减少Ca2+内流,抑制免疫细胞释放IFN-γ、穿孔素、颗粒霉素B等[13,14]。在B16F10和LWT1两种转移性肺癌小鼠模型中,CD39在肿瘤浸润淋巴细胞亚群的NK 细胞、CD8+T、CD4+T、Treg细胞等表面高表达[15];在CD39全基因敲除小鼠模型中,与对照组相比,转移瘤的数量减少、病理组织切片显示NK细胞在肿瘤组织内部的浸润程度显著增高[15];采用POM-1靶向CD39分子的抑制剂,能够有效增强PD-1/CTLA-4免疫疗法的效果,这些结果证明了CD39能够限制免疫细胞的功能,进而促进肺癌的转移[15]。近年来,腺苷通路在胃癌免疫调控中的研究收到了广泛的关注[16,17],也有研究报道证明了小分子靶向与siRNA沉默CD39能够在体外增强T细胞、NK细胞杀伤卵巢肿瘤的现象[18,19],但其增强NK细胞抗肿瘤的机制尚未证阐述清楚,并且尚未在体内的安全性和有效性需要进一步探索[20]。因此,本研究旨在探讨ARL67156靶向CD39的小分子抑制剂增强NK细胞抗肿瘤效应的分子机制,并通过体内实验论证ARL67156增强NK细胞杀伤胃癌细胞的有效性,拓展用小分子药物增强NK细胞杀伤胃癌的应用,为推进NK细胞的免疫疗法提供理论依据。
1 材料和方法
1.1 实验动物
本实验用的SPF级BALB/c Nude裸鼠(动物质量合格编号:No.44822700022444,生产许可证号:SCXK(粤)2020-0051),购自珠海百试通生物科技有限公司。所有动物均在最佳饲养条件,包括每笼3~4只小鼠的饲养密度,使用国家标准啮齿类动物SPF级饲料及垫料,并给予高压灭菌水。饲养环境温度维持在23~25 ℃,湿度为55%~63%,光照周期为12 h光照/12 h黑暗,并定期更换垫料。所有小鼠均可自由饮食。
本实验的设计与实施均受到南方医科大学动物管理伦理委员会的监督(实验动物伦理审批号:SMUL2022080)。动物实验将12只小鼠随机分为3组:PBS组、NK细胞组、NK细胞+ARL67156组,4只/组。在饲养1周后,皮下注射1×106MKN-45细胞,至肿瘤生长至约100 mm3(注射肿瘤7 d)后,进行下一步实验。
通过尾静脉回输方式,每只小鼠接受了1×107NK cells 200 接受的PBS液体,同时腹腔注射100 μL含有20 000 IU的IL-2,以维持NK细胞在体内的活性。IL-2每隔1 d注射1次,肿瘤每隔1 d测量1次。在NK细胞+ARL67156 组中,每隔1 d 腹腔注射0.2 mg/kg ARL67156。
肿瘤大小使用游标卡尺进行测量,计算公式为:肿瘤体积=(ab2)/2,其中a为肿瘤长轴,b为肿瘤短轴。当裸鼠体内的MKN-45胃癌细胞肿瘤体积达到1000 mm3时,根据实验伦理要求,设定此为实验终点。随后对小鼠进行麻醉处理,并使用颈椎脱臼法进行处死,取出肿瘤组织进行进一步分析。
1.2 材料
胃癌细胞系(MGC-803和MKN-45细胞,购自于Procell),RPMI 1640、PBS缓冲液、胎牛血清、青链霉素、胰酶-EDTA(Procell)。Miltenyi MACS NK细胞磁珠抗体阴性分选试剂盒(Miltenyi)。DMSO(Sigma-Aldrich)。淋巴细胞Ficoll 分离液(天津灏洋生物)。RIPA裂解液和蛋白酶抑制剂(上海碧云天生物技术有限公司)。Western blot 蛋白印迹兔源一抗抗体:抗NKG2D、磷酸化pvav1(Abcam),抗DAP10抗体(Santa Cruz),vav1、磷酸化pSyk、Syk 和β-Actin(Cell Signaling Technology),ECL 发光液(Thermo Scientific)。流式抗体:CD39-PE-CY7,CD56-PE,CD3-FITC,CD73-Percp,CD16-FITC,KIR3DL3-APC,KIR2DL2-APC-CY7,NKG2D-APC,CD57-FITC,CD107a-APC,IFN-γ-APC-CY7,布雷菲德霉素A(BFA)(BD Bioscience);细胞内固定和细胞内细胞因子染色试剂盒,活细胞染料Cell Tracker™CM-DiI,Live/Dead Fixable V500-Aqua 死细胞染色试剂盒(Thermo Scientific Fisher);IFN-γ双抗体夹心法ELISA 试剂盒(Elabscience);人白介素2(IL-2)(R&D System)。CD39小分子抑制剂ARL67156(Med Chem Express LLC),溶于灭菌水中,流式细胞仪(BD LSR Fortessa X-20)和FlowJo分析软件(BD Biosciences)。
1.3 方法
1.3.1 细胞培养 胃癌细胞系用RPMI 1640完全培养基(10%胎牛血清FCS,100 U/mL青霉素,100 μg/mL链霉素)培养,细胞传代用胰酶消化传代。外周血NK细胞磁珠分离纯化后,用RPMI 1640完全培养基(10%胎牛血清FCS,100 U/mL青霉素,100 μg/mL链霉素,2 mmol/L L-谷氨酰胺,50 μmol/L 2-巯基乙醇),500 U/mL白介素2(IL-2)进行培养。所有细胞放置于37 ℃,5%CO2饱和湿度的恒温细胞培养室中培养。
1.3.2 原代NK细胞纯化和分离 本实验已获得南方医科大学南方医院伦理委员会许可(伦理审查号:NFEC-2022-295),并依照1964年《赫尔辛基宣言》制定的伦理准则进行实验。抽取健康志愿者(18~35岁)静脉血20 mL,肝素抗凝,采用淋巴细胞液Ficoll进行密度梯度离心,分离得到单个核细胞(PBMC),采用Miltenyi MACS NK细胞磁珠抗体阴性分选试剂盒,分离纯化得到原代NK细胞;外周血NK细胞磁珠分离纯化后,用RPMI1640完全培养基,细胞浓度为1×106/mL。
1.3.3 CD39抑制剂与NK细胞共培养 CD39小分子抑制剂ARL67156,用DMSO溶解,使用浓度100µmol/L。与NK细胞(细胞浓度为1×106/mL)共培养24 h后,用于NK细胞的杀伤能力、信号通路、细胞因子释放实验。
1.3.4 Western blot蛋白印迹实验 1×106/mL NK细胞用100µmol/LARL67156处理和未处理的24 h后,用预冷的PBS缓冲液洗涤细胞3次,加入RIPA蛋白裂解液于冰上裂解30 min,10 000g离心20 min,取上清,BCA蛋白浓度测定试剂盒定量后,取各组蛋白进行SDS-PAGE(10%)电泳分离转膜至PVDF膜上,分别加一抗,用含5%脱脂奶粉封闭后,4 ℃孵育缓慢摇动过夜,经TBST洗涤3次,5 min/次;室温用二抗(HRP标记,稀释比例为1∶2000)孵育1~2 h,TBST清洗后,使用ECL发光试剂盒曝光,拍照,采用Image J进行蛋白条带灰度定量。
1.3.5 ELISA法检测干扰素(IFN-γ)的表达 1×104NK细胞(效靶比为1∶1)与胃癌肿瘤细胞在U型的96孔板中,共培养48 h后,双抗体夹心法ELISA试剂盒检测共培养后上清液中含有的IFN-γ浓度,A490nm值用酶标仪读取,通过标准品绘制曲线后,计算出样品中的IFN-γ浓度。
1.3.6 NK细胞与肿瘤细胞共培养后CD107a脱颗粒和胞内细胞因子的流式细胞术检测 为了测量NK细胞内细胞因子的产生,1×105NK细胞与胃癌肿瘤细胞共培养4 h,同时加入0.5µL anti-CD107a-APC,培养基中加有10µg/mL BFA。然后收获细胞,用PBS缓冲液洗涤,用荧光染料偶联的抗CD3和抗CD56表面单克隆抗体在4 ℃下染色30 min。用PBS洗涤2遍后,使用细胞内固定和破膜缓冲液进行细胞内染色,然后用荧光染料偶联的抗IFN-F进行染色,使用流式细胞仪采集数据和FlowJo软件V 10.6分析流式结果数据。
1.3.7 NK细胞杀伤实验流式细胞术检测 NK细胞对胃癌肿瘤细胞的杀伤实验采用4 h流式细胞术检测。使用Cell Tracker。CM-DiI染料对胃癌肿瘤细胞进行标记,并孵育过夜。NK细胞与标记的肿瘤细胞以不同的效应靶比共培养(0.25∶1,0.5∶1,1∶1和2∶1)。共孵育4 h后,使用Live/Dead Fixable V500-Aqua死细胞染色试剂盒测定肿瘤细胞活力,并使用流式细胞仪收集数据,FlowJo软件进行分析测定。特异性细胞杀伤测定采用以下公式:(死亡肿瘤细胞%-自发肿瘤细胞死亡%)/(100%-自发肿瘤细胞死亡%)肿瘤细胞%。
1.3.8 动物实验 SPF级BALB/c Nude裸鼠,1周适应性喂养后,根据治疗方式的不同,随机分为3组,4只/组:PBS组、NK细胞组和ARL67156+NK细胞组。小鼠皮下注射1×106个MKN-45 胃癌细胞,皮下成瘤的注射的体积为0.2 mL。皮下注射7 d后,皮下成瘤体积约为100 mm3。人的原代扩增的NK细胞(1×107个)尾静脉回输,同时20 000 IU IL-2 每隔1 d腹腔注射;每隔1 d,按照0.2 mg/kg的剂量腹腔注射ARL67156。
1.3.9 统计学分析 所有统计学处理是采用GraphPad Prism9软件进行分析的,数据用均数±标准差表示,两组间比较采用t检验。单因素方差分析用于多组间比较。以P<0.05为差异具有统计学意义。所有实验都独立重复3次。
2 结果
2.1 NK细胞表达CD39的频率
从外周血分离出外周血单个核细胞(PBMC)后,然后用磁珠抗体试剂盒纯化出NK细胞后,纯度在95%以上(n=6,图1A)。用荧光抗体标记NK细胞上的CD39,得出外周血(25.97±5.69)%NK 细胞表达CD39分子(图1B)。
2.2 CD39小分子抑制剂ARL67156激活活化信号受体并降低抑制性信号受体
对NK细胞信号通路检测,与DMSO对照组相比,ARL67156处理后的NK细胞表达更多的磷酸化vav1(P=0.012)、磷酸化Syk(P=0.080)、NKG2D(P=0.038)、DAP10(P=0.025)等活化分子,差异具有统计学意义(图2A、B)。同时,ARL67156分子能够促进NK细胞表达NKG2D、CD57、CD16 活化受体,降低TIGIT、KIR2DL1 和KIR2DL1 抑制性的受体表达。然而,DMSO对照组和ARL67156处理后的NK细胞两组间腺苷通路的受体CD39和CD73表达差异无统计学意义(P>0.05,图2)。
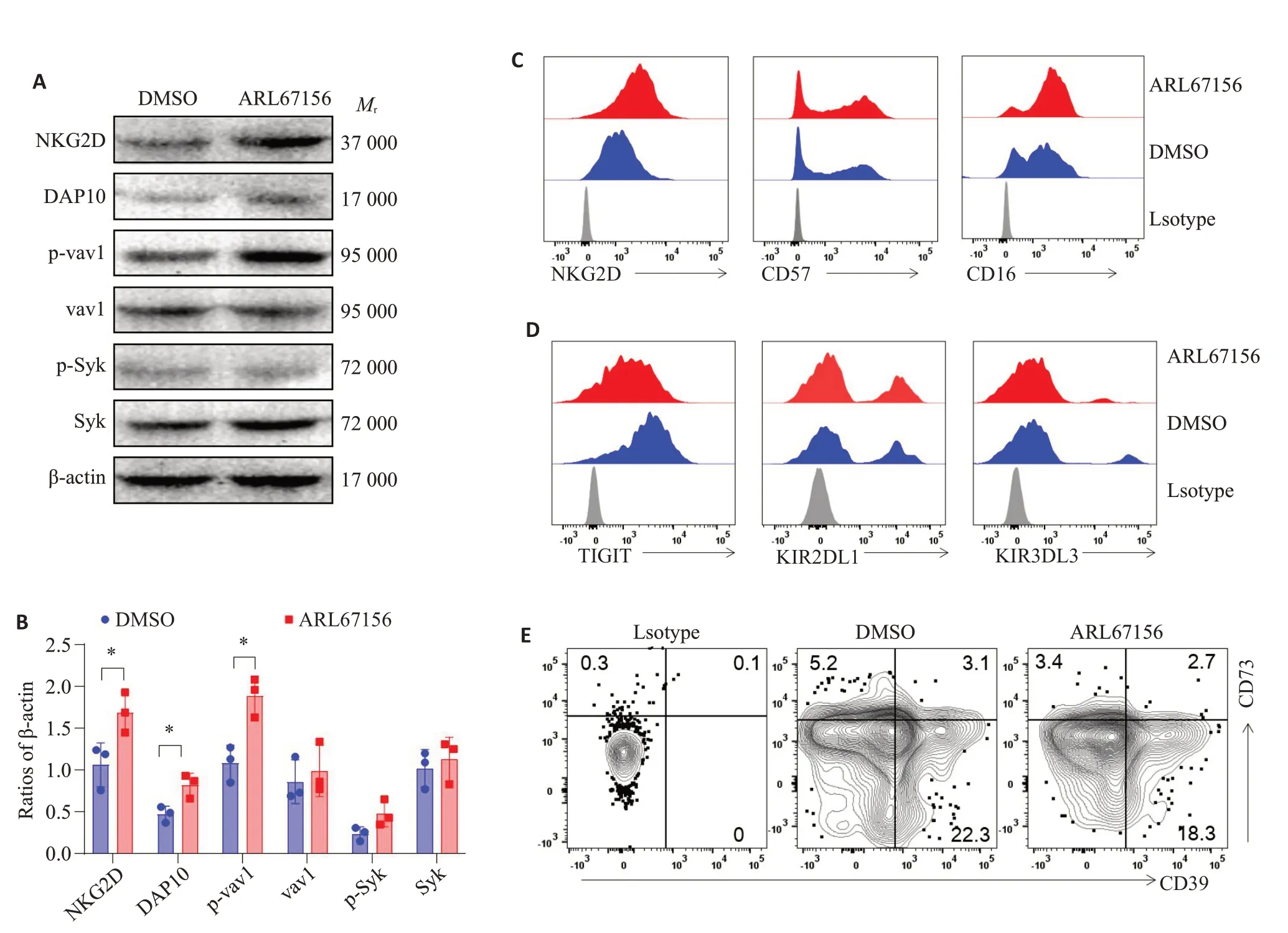
图2 CD39小分子抑制剂ARL67156上调NK细胞活化受体下调抑制性受体Fig.2 Modulation of NK cell receptors by small-molecule CD39 inhibitor ARL67156.A:ARL67156 activates NK cells through the vav1-Syk signaling pathway.Following stimulation with 100 μmol/L ARL67156,the expression of activation proteins NKG2D and DAP10 was upregulated in NK cells.B:Quantitative analysis of the protein bands in Western blotting normalized with β-actin(n=3).C:Flow cytometry showing upregulated expressions of the activation receptors NKG2D,CD57,and CD16 in ARL67156-treated NK cells.D:The suppressive receptors TIGIT,KIR2DL1,and KIR3DL3 are down-regulated in ARL67156-treated NK cells.E:Adenosine receptors CD39 and CD73 show no significant difference in NK cells treated with 100 μmol/L ARL67156 stimulation for 24 h.Data represents a single representative flow cytometry plot from 3 independent assays.*P<0.05.
2.3 CD39小分子抑制剂ARL67156能够促进NK细胞释放IFN-γ并增强CD107a脱颗粒
与对照组相比,CD39抑制剂ARL67156能够增强NK细胞内的IFN-γ(MGC803组,P=0.033;MKN-45组,P=0.012)和CD107a(MGC803 组,P=0.015;MKN-45组,P<0.01)的表达,差异具有统计学意义(P<0.05,图3A~C)。ELISA检测NK细胞与胃癌细胞靶细胞共培养上清中的IFN-γ,与未处理的NK细胞相比,NK细胞分泌出更多的IFN-γ(MGC803组,P<0.01;MKN-45组,P<0.01),差异具有统计学意义(P<0.05,图3D、E)。
2.4 CD39小分子抑制剂增强NK细胞杀伤胃癌细胞
杀伤实验结果显示,与对照组相比,CD39抑制剂ARL67156处理后的NK细胞与胃癌细胞共培养后,约有15%更多的胃癌细胞死亡(MGC803、MKN-45),差异具有统计学意义(P<0.05,图4A、B)。
2.5 CD39小分子抑制剂在体内增强NK细胞抗肿瘤能力
在皮下成瘤7 d 后,相对于对照组,ARL67156 CD39小分子抑制协同NK细胞回输组在第9天可以观察到,肿瘤体积显著变小,随着时间的增加,在各组间的差异越显著,差异具有统计学意义(P<0.001,图5)。

图5 CD39抑制剂ARL67156增强NK细胞体内杀伤胃癌细胞的能力Fig.5 ARL67156 enhances tumoricidal activity of NK cells against gastric tumor cells in nude mice.Balb/c nude mice bearing subcutaneous MKN-45 gastric carcinoma cell xenograft received intravenous administration of 1×107 NK cells on day 7 and intraperitoneal IL-2 at 20000 IU every other day,with or without 0.2 mg/kg ARL67156 administration.A:Schematic representation of the in vivo mouse experiment.B:Tumor masses measured on day 19 after tumor cell injection.C: Tumor growth curve.D: Tumor weight measured from 3 experimental groups.****P<0.0001,**P<0.01.
3 讨论
CD39是腺苷通路的重要分子,能够将ATP水解为ADP进而被CD73分子作用下变成腺苷,在肿瘤微环境中,大量的腺苷分子对NK细胞和T细胞具有很强的抑制作用,腺苷与免疫细胞表面的腺苷受体结合后,靶向PI3K/PKA/FOXO1通路,减少Ca2+内流、限制IFN-γ、颗粒霉素B等释放,损害免疫细胞的抗肿瘤功能,控制肿瘤发生耐药、逃逸、转移等[13]。CD39分子抑制剂能够减轻肿瘤微环境中的细胞外ATP(eATP)降解,提高eATP的浓度,从而通过ATP受体P2X7分子,激活巨噬细胞,增强巨噬细胞吞噬淋巴瘤细胞的能力[21]。但是CD39分子抑制剂,是否能够增强NK细胞杀伤胃癌细胞的能力尚未有研究报道[22]。本研究证明了CD39小分子抑制剂ARL67156,能够特异性阻断CD39分子,通过活化vav1和Syk信号通路,上调NKG2D、CD57和CD16等活化分子、降低TIGIT、KIR等抑制信号分子的表达、进而全面提升NK细胞释放IFN-γ、CD107a脱颗粒的能力,增强NK细胞杀伤胃癌细胞的能力。
Zhu等[18]在不明原因复发性自然流产(URSA)患者的临床样本和细胞模型探讨URSA中CD39和CD73对蜕膜自然杀伤细胞(dNK)和胎儿外滋养细胞(EVT)的调控作用,以及CD39/CD73通过TGF-B-mTOR-HIF-1a通路调控的可能机制。采用ARL67156与NK细胞共培养后,能够抑制CD39使dNK细胞进入活化状态,毒性增加,凋亡减少,细胞因子分泌改变,上调NKG2D、NKp44和NKp30活化受体的表达。这些结果与本研究的结论一致,ARL67156能够激活NK细胞。Qian等[23]发现,CD38和CD39在NK细胞上共表达,并且高表达CD39分子同时表达PD-1等抑制性受体,用ARL67156处理后的NK细胞能够促进HIV患者的CD4+T细胞和CD8+T细胞的增殖和活力,这可能是因为ARL67156能够增强NK细胞释放细胞因子进而增强T细胞的活性。Brauneck等[24]发现急性髓系白血病(AML)患者NK细胞的CD39分子,与TIGIT、PD-1同时高表达;该研究通过阻断抗体的方式封闭NK细胞上的TIGIT和CD39,与单独采用TIGIT的组别相对比,TIGIT和CD39双阻断的NK细胞能够杀伤更多的AML肿瘤细胞。这些结果充分显示了,ARL67156或者通过抗体阻断CD39能够显著增强NK细胞释放细胞因子的能力,进而增强NK细胞的抗肿瘤能力,为靶向抑制CD39在临床肿瘤治疗提供理论依据。
靶向CD39分子的治疗在肿瘤免疫中有多种方式,如:抗体阻断法、siRNA/shRNA基因敲低法、基因敲除法、小分子抑制剂法等[13,14]。靶向CD39的抗体已经进入了Phase I/II 期临床试验,但是有研究表明单独用阻断CD39的抗体的抗肿瘤效果不佳,需要与PD-1抑制剂联合用药后,能够有比较好的抗肿瘤效果,能够激活体内的CD8+T和NK细胞抗肿瘤[19,25]。siRNA能够有效降低CD39 分子在肿瘤和免疫细胞上的表达,降低CD39分子后,卵巢癌细胞对T细胞和NK细胞的杀伤能力抑制作用明显减弱,尽管该研究在卵巢癌细胞体外杀伤模型中,比较了用100 μmol/L的ARL67156小分子抑制剂处理NK细胞和siRNA敲低CD39后NK细胞杀伤力,CD39 siRNA能更加有效的增强NK细胞的杀伤力,但是siRNA体内给药存在困难,难以在临床胃癌治疗中应用[26,27]。基因敲除CD39的NK细胞能够释放更多的IFN-γ释,但尚未应用于临床肿瘤治疗中,并且基因敲除的步骤仍然比较复杂,不能够大规模的批量化生产基因敲除的NK细胞[22,27]。然而,特异性靶向CD39蛋白的小分子抑制剂,已进入了临床肿瘤免疫治疗的试验,化合物稳定性较好,能够广泛在临床疾病治疗中应用,在多种实体肿瘤中,联合PD-1免疫疗法,能够取得令人满意的抗肿瘤结果[21,22,28]。因此,本课题中的ARL67156小分子抑制剂联合NK细胞,能够成为胃癌的临床治疗一种潜在的有效的备选治疗方法。
NK细胞是一群天然免疫细胞,具有很强的抗肿瘤抗病毒的特性。该细胞因没有T细胞受体(TCR),而且当NK细胞与主要组织相容复合物(MHC)-I类分子结合后,NK细胞的功能被抑制,所以不会攻击自身的正常组织细胞,因此NK细胞被广泛地用于肿瘤免疫治疗中[11]。然而,在肿瘤微环境中,有很多负调节性的因素(如:缺氧、低PH、高浓度的腺苷,等),极大地限制NK细胞杀伤肿瘤的能力[29,30]。本研究采用CD39 抑制剂ARL67156预处理NK细胞,阻断CD39分解NK细胞周围的ATP,从而让NK细胞有更多的ATP分子用于抗肿瘤活动,实验结果证明,ARL67156抑制剂能够诱导NK细胞上调活化分子(NKG2D、DAP10)、下调TIGIT、KIR等抑制性受体、释放更多的IFN-γ、增强CD107a脱颗粒能力,由此提升NK细胞杀伤胃癌细胞的能力。本研究的创新之处在于,阐释了ARL67156分子通过vav1-Syk的信号通路激活NK细胞,上调NKG2D、DAP10活化分子,进而促进NK细胞脱颗粒并释放IFN-γ,并从体内和体外实验证明了ARL67156小分子抑制剂增强NK细胞杀伤胃癌细胞的能力,为此,ARL67156联合NK细胞疗法能够为临床胃癌的治疗潜在有效的备选方案。这些结果,丰富了NK细胞杀伤实体肿瘤的理论,能够为临床采用CD39小分子抑制剂联合NK细胞治疗的策略提供依据,推动中国的精准肿瘤治疗的发展。

