人参多糖调控Wnt3/β-catenin/Runx2信号通路改善去卵巢大鼠骨质疏松的作用
李高峰 王艺昧 李光淳 张扬 王博 杜彦辉 桑平*
1.吉林省人民医院创伤骨病二科,吉林 长春 130021 2.吉林大学第一临床医院病理科,吉林 长春 130021
骨质疏松症是一种全身性骨代谢疾病,在绝经后女性及老年人群中发病率较高[1]。研究发现[2],骨质疏松症发病率在我国50岁以上人群中为19.2%,且女性发病风险远高于男性,尤其是65岁以上女性人群中发病率高达51.6%。绝经后女性骨质疏松症常用的治疗方法是补充雌激素,但会使子宫内膜癌、乳腺癌等激素依赖性肿瘤及心血管疾病的发病风险增加[3]。降钙素、双膦酸盐等药物也用于绝经后女性骨质疏松症的防治,但长期使用会出现胃肠道不适、乏力、头晕及恶心、呕吐等明显的毒副作用,且远期疗效难以让人满意[4]。近年来,中药由于具有多靶点、多通路及多途径的作用特点,加之毒副作用较低,在防治绝经后女性骨质疏松症领域逐渐引起了众多研究者的关注[5-6]。
人参为五加科人参属植物,是我国名贵的中药材,应用历史悠久。人参的主要活性物质包括皂苷、挥发油、多糖及黄酮等,具有抑制肿瘤生长、抗衰老、改善糖脂代谢紊乱、增加免疫力、保护心脑血管、兴奋神经中枢及抗疲劳等生物学功能[7]。人参防治骨质疏松作用也多见报道[8]。马伟凤等[9]研究发现,人参皂苷Rg3能够改善骨质疏松老年大鼠骨微结构、提高骨密度,其可能是通过调节自噬发挥骨保护作用。Kang等[10]研究证实,去卵巢小鼠经人参与甘蓝联合治疗后,骨质疏松症得到明显改善。人参多糖作为人参中的主要水溶性功效物质,其提升免疫能力、加快新陈代谢速度、降低氧化应激水平及抑制炎症反应等活性已被证实,但其是否具有改善绝经后女性骨质疏松症作用目前未见报道[11-12]。因此,本研究选择去卵巢骨质疏松大鼠模型,探究人参多糖是否具有改善去卵巢大鼠骨质疏松作用及潜在机制,以期为人参多糖应用于绝经后女性骨质疏松症的防治及人参多糖的综合开发利用奠定基础。
1 材料与方法
1.1 材料
1.1.1动物:雌性SPF级SD大鼠50只,体质量(200±20) g,购自吉林大学实验动物中心[SCXK(吉)2021-0001]。大鼠饲养于吉林大学药学院[SYXK(吉)2022-0017],自由饮水进食,环境湿度45%~50%,环境温度21℃~25℃,每5 min换气通风1次,每12 h光暗交替。本研究经吉林省人民医院伦理委员会审批,各项操作均符合3R原则。
1.1.2主要试剂:人参多糖(批号BNK062),含量≥80%,西安百年康生物科技有限公司;阿仑膦酸钠维生素D3(国药准字H20110079),规格70 mg/片,石药集团欧意药业有限公司;苏木素伊红(HE)染色试剂盒(批号:M027),上海歌凡生物科技有限公司;耐酒石酸酸性磷酸酶-5b(TRAP-5b)、骨碱性磷酸酶(BALP)、骨钙素(OC)及骨保护素(OPG)检测试剂盒(批号:H415-1、H234、H152-1-2及H286),南京建成生物工程研究所;Wnt3、β-连环蛋白(β-catenin)、Runt相关转录因子2(Runx2)及β-肌动蛋白(β-actin)多克隆抗体(批号:ab32249、ab32249、ab23981及ab8227),美国Abcam公司;IgG二抗(批号:C86-SSA004),上海创赛科技有限公司。
1.1.3主要仪器:BT25S型分析天平,德国Sartorius公司;TGL-16M型高速冷冻台式离心机,上海卢湘仪离心机仪器公司;STM7-BSW型显微镜,日本Olympus公司;Xpert/parameter型小动物高分辨率全自动X光机,美国KUBTEC公司;3510-AT型生物力学仪,美国BOSE公司;Mk3型酶标仪,美国Thermo公司;BC-2800型小动物全自动生化分析仪,深圳迈瑞生物医疗公司;JY-ZY5型电泳仪及JY-SCZ2型转膜仪,北京君意东方电泳仪器公司;HW08921型成像仪,上海勤翔科学设备公司。
1.2 方法
1.2.1造模及分组:将已适应环境1周的SD大鼠按体质量随机分为假手术组、模型组、人参多糖低、高剂量组(100、200 mg/kg)及阿仑膦酸钠维生素D3组(6.25 mg/kg),每组10只,人参多糖的剂量参考文献[13],阿仑膦酸钠维生素D3的剂量参考文献[14]。模型组、人参多糖低、高剂量组及阿仑膦酸钠维生素D3组大鼠均切除双侧卵巢,假手术组大鼠仅切除卵巢周围脂肪组织。术后注射青霉素预防感染,同时恢复性饲养1周后,开始灌胃给予人参多糖或阿仑膦酸钠维生素D3,每天1次,连续12周。假手术组及模型组用相同体积的蒸馏水灌胃,每周记录各组大鼠体质量。
1.2.2样本收集:实验结束后,腹腔注射1%的戊巴比妥钠(40 mg/kg)麻醉大鼠,腹主动脉采血。在冰上放置30 min后,低温离心(2 000 r/min,20 min),吸取上清液,分装后置于-80℃冰箱中保存。用手术剪刀分离胫骨及股骨,左侧胫骨用4%甲醛溶液固定,右侧胫骨及双侧股骨均在-80℃冰箱中保存备用。
1.2.3指标检测:(1)骨组织病理形态观察。各组大鼠左侧胫骨在4%甲醛溶液中固定2周,先后经脱钙、包埋、切片等操作,行HE染色,在显微镜下观察人参多糖对骨组织病理形态的影响。(2)骨密度检测。取各组大鼠左侧股骨,通过小动物高分辨率全自动X光机对各组大鼠股骨骨密度进行检测。(3)骨生物力学指标检测。使用游标卡尺测量各组大鼠右侧股骨长度,在生物力学仪中将股骨标本固定,压头以2 mm/min速度下降,直至股骨断裂为止,记录刚度、最大应力及最大载荷等数据。(4)血清骨代谢指标及生化指标检测。取-80℃冰箱中冻存的血清,按照试剂盒说明书的操作步骤,血清TRAP-5b、BALP、OC及OPG等骨代谢指标的检测采用酶联免疫吸附法;通过小动物全自动生化分析仪检测血清P3+、Ca2+等生化指标。(5)骨组织Wnt3、β-catenin及Runx2表达检测。取各组大鼠右侧胫骨100 mg,加入1 mL RIPA裂解液,提取总蛋白,并通过BCA法测总蛋白含量。取20 μg蛋白样品行SDS-PAGE电泳,电泳结束后转至PVDF膜,用5%脱脂奶粉封闭。TBST洗膜后,加入稀释2 000倍的Wnt3、β-catenin、Runx2及β-actin多克隆抗体,在4℃环境下放置过夜。TBST洗膜后,再加入稀释5 000倍的IgG二抗,在室温环境下放置2 h。采用化学发光法显色,并通过Image J软件分析凝胶条带灰度值,计算目的蛋白相对表达量。
1.3 统计学分析
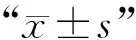
2 结果
2.1 人参多糖对骨质疏松大鼠体质量的影响
造模前,各组大鼠体质量差异无统计学意义(P>0.05);造模后,假手术组大鼠体质量缓慢稳步增长,模型组大鼠体质量增长迅速,与假手术组比较,从第4周开始模型组大鼠体质量明显升高(P<0.05,P<0.01)。人参多糖低、高剂量组及阿仑膦酸钠维生素D3组大鼠体质量增长速度慢于模型组,与模型组比较,人参多糖低、高剂量组大鼠体质量从第8周开始、阿仑膦酸钠维生素D3组从第4周开始均明显降低(P<0.05,P<0.01),见表1。
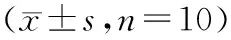
表1 人参多糖对骨质疏松大鼠体质量的影响Table 1 Effect of ginseng polysaccharide on the body mass in osteoporosis rats n=10)
2.2 人参多糖对骨质疏松大鼠骨组织病理形态的影响
假手术组大鼠骨组织形态正常;模型组大鼠骨小梁间隙变宽,骨小梁疏松变薄;人参多糖低、高剂量组及阿仑膦酸钠维生素D3组大鼠骨小梁连接和数量增加明显,其中人参多糖高剂量组及阿仑膦酸钠维生素D3组大鼠骨小梁接近正常,见图1。
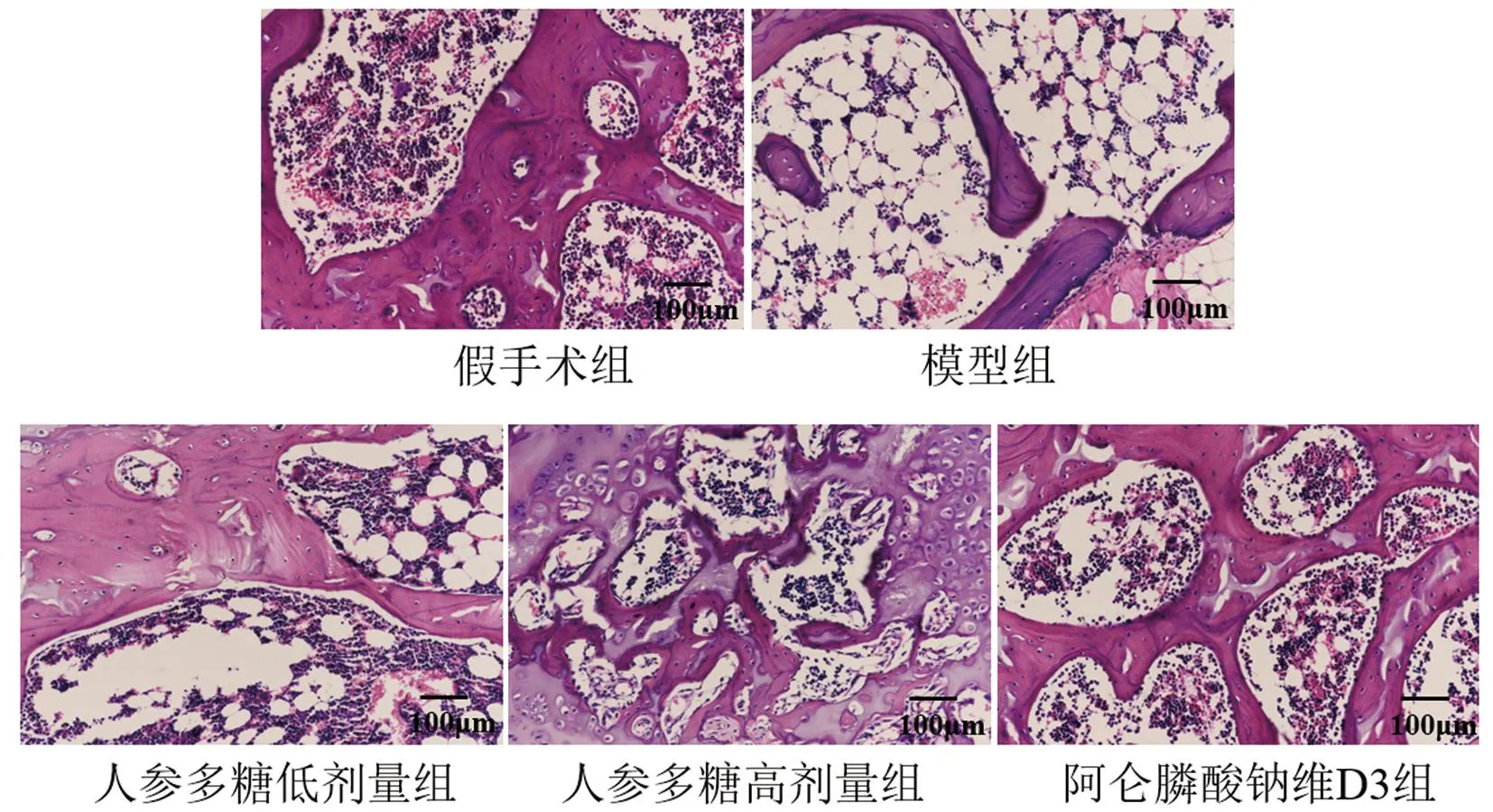
图1 各组大鼠骨组织病理形态(HE,×200)Fig.1 Histopathologic morphology of the bone in each group (HE, ×200)
2.3 人参多糖对骨质疏松大鼠骨密度的影响
与假手术组比较,模型组大鼠骨密度降低了20.39%(P<0.01);与模型组比较,人参多糖低、高剂量组及阿仑膦酸钠维生素D3组大鼠骨密度分别增加了8.81%、11.28%及18.57%(P<0.01),见表2。
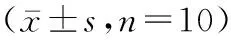
表2 人参多糖对骨质疏松大鼠骨密度的影响Table 2 Effect of ginseng polysaccharide on bone mineral density in osteoporosis rats n=10)
2.4 人参多糖对骨质疏松大鼠骨生物力学指标的影响
人参多糖对骨质疏松大鼠骨生物力学指标刚度、最大应力及最大载荷等的影响见表3。模型组大鼠刚度、最大应力及最大载荷与假手术组比较均明显下降(P<0.01);与模型组比较,人参多糖低、高剂量组及阿仑膦酸钠维生素D3组大鼠刚度、最大应力及最大载荷均明显增加(P<0.05,P<0.01)。
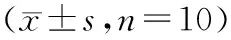
表3 人参多糖对骨质疏松大鼠骨生物力学指标的影响Table 3 Effect of ginseng polysaccharide on bone biomechanical indexes in osteoporosis rats n=10)
2.5 人参多糖对骨质疏松大鼠血清骨代谢指标的影响
人参多糖对骨质疏松大鼠血清骨代谢指标TRAP-5b、BALP、OC及OPG等的影响见表4。与假手术组比较,模型组大鼠血清TRAP-5b含量明显升高(P<0.01),而BALP、OC及OPG含量明显降低(P<0.01);与模型组比较,人参多糖低、高剂量组及阿仑膦酸钠维生素D3组大鼠血清TRAP-5b含量明显降低(P<0.05,P<0.01),而BALP、OC及OPG含量明显升高(P<0.01)。
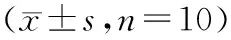
表4 人参多糖对骨质疏松大鼠血清骨代谢指标的影响Table 4 Effect of ginseng polysaccharide on the serum bone metabolism indexes in osteoporosis rats n=10)
2.6 人参多糖对骨质疏松大鼠血清生化指标的影响
人参多糖对骨质疏松大鼠血清生化指标P3+、Ca2+等含量的影响见表5。模型组大鼠血清P3+、Ca2+含量与假手术组比较均明显下降(P<0.01);与模型组比较,人参多糖低、高剂量组及阿仑膦酸钠维生素D3组大鼠血清P3+、Ca2+含量均明显增加(P<0.05,P<0.01)。
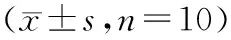
表5 人参多糖对骨质疏松大鼠血清生化指标的影响Table 5 Effect of ginseng polysaccharide on the serum biochemical indexes in osteoporosis rats n=10)
2.7 人参多糖对骨质疏松大鼠骨组织Wnt3、β-catenin及Runx2表达的影响
采用Western blot法检测人参多糖对骨质疏松大鼠骨组织Wnt3、β-catenin及Runx2表达的影响,见图2及表6。与假手术组比较,模型组大鼠骨组织Wnt3、β-catenin及Runx2表达均明显下降(P<0.01);与模型组比较,人参多糖低、高剂量组及阿仑膦酸钠维生素D3组大鼠骨组织Wnt3、β-catenin及Runx2表达均明显增加(P<0.05,P<0.01),提示人参多糖具有激活去卵巢骨质疏松大鼠Wnt3/β-catenin/Runx2信号通路的作用。
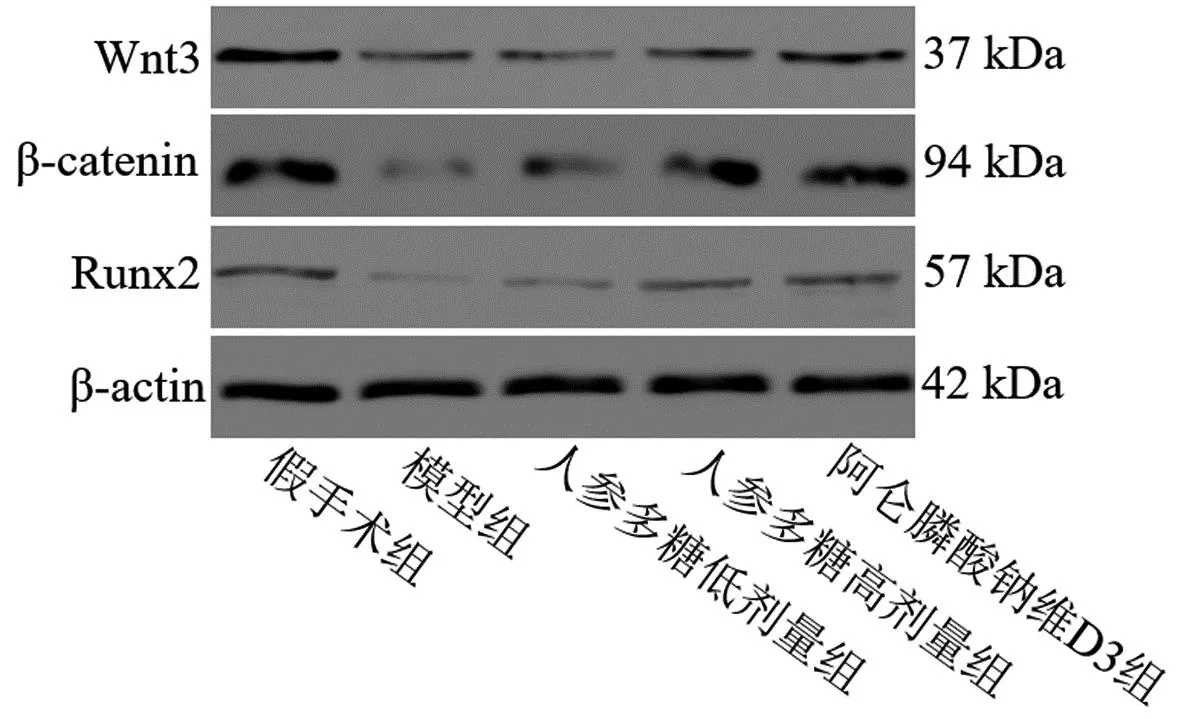
图2 各组大鼠骨组织Wnt3、β-catenin及Runx2表达Fig.2 Expressions of Wnt3, β-catenin, and Runx2 in the bone tissue of rats in each group

表6 人参多糖对骨质疏松大鼠骨组织Wnt3、β-catenin及Runx2表达的影响Table 6 Effect of ginseng polysaccharide on the expressions of Wnt3, β-catenin, and Runx2 of the bone tissue in osteoporosis rats
3 讨论
雌激素水平下降,机体的骨形成弱于骨吸收,进而使骨稳态失衡是导致绝经后女性骨质疏松症发病的首要原因[15]。去卵巢大鼠常用于模拟绝经后女性骨质疏松症,该方法具有操作简便易行、重复性好、周期较短及成功率高等优点,是美国食品药品监督管理局和世界卫生组织推荐的经典模型[16]。本研究结果发现,去卵巢模型组大鼠骨小梁间隙变宽、骨小梁疏松变薄,骨密度及刚度、最大应力、最大载荷等骨生物力学指标下降,较好地模拟了绝经后女性骨质疏松症的病理特征,提示模型复制成功。既往研究发现,去卵巢后机体雌激素水平骤减,反馈性导致肾上腺皮质功能亢进,引起激素分泌紊乱,使糖脂代谢能力下降,进而造成体质量增加[17];本研究中的去卵巢模型组大鼠体质量明显增加,进一步表明成功建立了大鼠骨质疏松症模型。骨密度是诊断骨质疏松症的重要指标,其含量下降预示骨折及患骨质疏松症风险增加;刚度、最大应力、最大载荷等骨生物力学指标可以反映骨骼抵抗弯曲变形能力及抵抗外力的最大力量,相关指标降低说明骨折出现的风险增加[18]。去卵巢大鼠经低、高剂量的人参多糖连续干预12周后发现,人参多糖低、高剂量组大鼠体质量下降,骨小梁连接和数量增加,骨密度及刚度、最大应力、最大载荷等增加,表明人参多糖具有改善去卵巢大鼠骨质疏松的作用。
TRAP是评价骨吸收速率的生物标志物,主要由破骨细胞分泌;BALP、OC为反映骨形成的重要指标,主要由成骨细胞分泌;OPG的主要作用是增加骨强度、骨密度及抑制骨吸收[19]。既往研究发现,升高BALP、OC含量,促进OPG表达,抑制TRAP活性,是多种药物治疗骨质疏松症的重要策略[20]。血清P3+、Ca2+等是骨转换的常见指标,当血清P3+、Ca2+含量降低时预测可能存在骨丢失,其可作为间接反映骨质疏松严重程度的指标,而增加血清P3+、Ca2+含量是缓解骨质疏松症的有效途径[21]。人参中的皂苷成分可以通过增加BALP、OC、OPG含量及减少TRAP含量等改善骨质疏松症状[8-9,22];人参根饮液对模型大鼠骨质疏松的改善作用与调节P3+及Ca2+含量有关[23]。本研究结果发现,人参多糖各剂量组大鼠血清TRAP-5b含量减少,而BALP、OC、OPG及P3+、Ca2+含量升高,表明人参多糖可以调节骨代谢及增加骨矿盐含量,进一步提示其具有改善去卵巢大鼠骨质疏松的作用。
Wnt/β-catenin信号通路在骨质疏松症的发生中具有关键性作用,其与骨重建和骨形成均密切相关,因此调控该信号通路对于改善骨质疏松症的发生和进展有着积极意义[24-26]。Wnt活化后可促进β-catenin与淋巴增强因子/T细胞转录因子结合而形成复合体,从而进一步上调下游靶基因Runx2的表达及转录[27]。Runx2可使各种矿化相关蛋白基因的转录及表达增加,促进成骨向分化[28]。研究发现,破骨细胞中的β-catenin被条件敲除时,可导致骨吸收程度显著增加;刺激β-catenin过量表达,则能够使骨量升高,提示Wnt/β-catenin信号通路可抑制骨吸收,进而促进成骨细胞的矿化和分化[29]。周哲人等[30]研究发现,木犀草素和柚皮苷均可以上调大鼠骨髓间充质干细胞中β-catenin和Runx2 mRNA的表达,诱导骨髓间充质干细胞的成骨分化。白坚木醇也能够促进MC3T3-E1细胞中β-catenin和Runx2 mRNA及蛋白的表达,其促进成骨细胞形成的机制与Wnt/β-catenin/Runx2信号通路有关[31]。本研究结果同样发现,人参多糖低、高剂量组大鼠骨组织Wnt3、β-catenin及Runx2表达均明显增加,表明其可能通过激活Wnt3/β-catenin/Runx2信号通路发挥改善去卵巢大鼠骨质疏松作用。
综上所述,人参多糖可以减轻去卵巢大鼠骨组织病理形态,增加骨密度及骨生物力学指标,调节骨代谢,升高骨矿盐含量,具有改善骨质疏松作用。进一步的机制研究发现,人参多糖改善去卵巢大鼠骨质疏松作用可能与激活Wnt3/β-catenin/Runx2信号通路有关。本研究的相关结果将为骨质疏松症的防治提供新的手段和方法,也将有利于人参多糖的综合开发应用。

