SGLT2i对2型糖尿病患者骨代谢影响的研究进展
柴家超 杨卫芳 扈艳雯 张玉超 赵蕙琛*
1.青岛市妇女儿童医院小儿骨科,山东 青岛 266034 2.青岛市市立医院内分泌科,山东 青岛 266071 3.菏泽市立医院营养科,山东 菏泽 274031
2型糖尿病(type 2 diabetes,T2DM)是一种常见的代谢性疾病,对骨代谢也有不良影响,是骨折的独立危险因素[1]。骨折是一种严重的健康事件,可导致患者生活质量降低,经济困难,甚至死亡[2]。鉴于T2DM在中国影响超过1.4亿人[3],更好地认识T2DM与骨代谢之间的联系至关重要[4]。
钠-葡萄糖共转运体2抑制剂(sodium-glucose co-transporter 2 inhibitors,SGLT2i)(包括卡格列净、达格列净、恩格列净)可抑制肾脏近曲小管的葡萄糖吸收,通过增加尿糖排泄、减重等多重作用发挥降糖作用。因其在心脏、肾脏方面的获益,在临床上应用广泛。然而卡格列净在心血管评估研究中出现骨折发生率升高问题,此类药物对骨骼的影响引起了人们的高度关注[5]。本文将探讨SGLT2i影响T2DM患者骨代谢的可能机制。
1 2型糖尿病骨代谢障碍的病理机制
骨骼是具有代谢功能的活组织。骨骼一生中不断重塑,以确保骨骼的结构和完整性,在骨转化过程中,通过协调成骨细胞、骨细胞以及破骨细胞的活动,以维持骨形成、骨吸收的动态平衡[6],在骨吸收时钙、磷酸盐释放到血液中,在骨形成时沉积到骨中,以维持骨的强度[7]。T2DM对骨代谢影响的潜在机制涉及炎性细胞因子、肌肉来源的激素、肠促胰岛素、硫化氢和皮质醇等,本文主要从脂肪及肌肉方面探讨其机制(图1)。
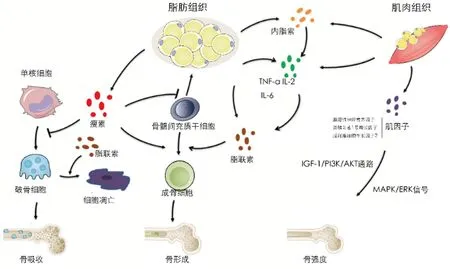
图1 脂肪及肌肉组织炎症状态对骨代谢的作用Fig.1 Effects of inflammatory of the fat and muscle tissue on bone metabolism
1.1 T2DM患者的体内脂肪过度积累与骨代谢障碍有关
脂肪对骨代谢的影响是双向的,当脂肪处于生理水平时,脂肪增加利于骨密度(bone mineral density,BMD),一是有更多的软组织来保护骨组织,二是体重的机械负荷刺激了骨形成。然而当脂肪处于有害水平时,会降低BMD[8-9]。脂肪分布与骨代谢相关,中心性肥胖可导致骨质疏松,内脏脂肪与BMD呈负相关,皮下脂肪对骨结构和强度产生相反的影响[10-13],这种联系可能是由脂肪细胞因子介导的[6]。
脂肪组织是重要的内分泌器官,可分泌多种细胞因子,包括瘦素、脂联素、抵抗素以及炎症因子。T2DM状态下促炎细胞因子和脂肪因子水平失衡诱导机体处于慢性低度炎症状态,干扰骨髓间充质干细胞分化为成骨细胞及骨中的胶原交联,影响成骨细胞、破骨细胞的数量及骨转化[14]。胰岛素信号传导是成骨细胞的重要部分,胰岛素抵抗会导致成骨细胞的胰岛素信号传导异常并降低其存活率[13]。脂联素可提高胰岛素敏感性,并与内脏脂肪、胰岛素抵抗指数呈负相关。瘦素是阳性预测因子,内脏脂肪/皮下脂肪、脂肪因子、细胞因子和脂联素是BMD的阴性预测因子[6]。脂肪对骨骼代谢的影响是复杂的,取决于多种因素,如体重的机械负荷、肥胖类型、脂肪组织的位置、以及分泌的细胞因子。因此,适当的脂肪组织是骨质疏松的保护因素,随着代谢并发症的发展,包括全身炎症状态,脂肪组织对骨骼健康的有益作用逐渐丧失。
1.2 T2DM患者的肌肉萎缩与骨代谢障碍有关
肌量及肌力是决定骨强度的重要因素。骨的形态发生依赖于肌肉的收缩,肌肉收缩产生机械负荷,对于骨骼的发育、创伤修复、重塑起重要作用[15];肌肉与骨骼的关联不仅是力学调控,肌肉分泌的“肌源性因子”对骨骼的生长、发育、功能具有重要调控作用[6]。如胰岛素1号增长因子(IGF-1),通过与IGF-1受体结合、激活胰岛素受体底物(insulin receptor substrate,IRS)-1、活化下游磷脂酰肌醇-3-激酶(phosphatidylinositol-3-kinase,PI3K)/丝氨酸/苏氨酸激酶(serine/threoninekinase,Akt)及丝裂原活化蛋白激酶(mitogen-activated protein kinases,MAPK)/胞外信号调节激酶(extracellular signal-regulated kinase,ERK)信号通路调控骨骼生长[16];肌生长抑制素对骨骼肌质量具有负性调控作用,并通过减少骨形成和增加骨吸收对骨量产生负性调控作用。胰岛素在骨骼肌合成代谢中起到重要作用,T2DM状态下,骨骼肌脂肪浸润、胰岛素抵抗、糖基化终产物增加及炎症因子异常释放可引发骨骼肌组织信号转导异常,使蛋白质合成及降解失衡,引起肌量和肌力的进行性丧失。肌萎缩、肌肉功能减退可致皮质骨吸收增加,对抗剪切力、扭力等的能力减弱;骨小梁数目减少,BMD降低[17]。骨骼会通过改变骨强度及骨量来适应肌肉收缩力量的改变,并将力学刺激转换为生化信号影响骨代谢[8],IGF-1/PI3K/AKT通路减弱是导致T2DM骨骼肌异常的重要因素[15]。因此,糖尿病脂肪、肌肉的慢性炎症状态可能对糖尿病骨代谢产生不良影响。
2 SGLT2i对钙磷代谢的影响
已证实抑制SGLT2会破坏钙、磷酸盐和维生素D的稳态。SGLT2i抑制近端小管中钠和葡萄糖共转运蛋白,通过磷酸钠共转运蛋白增强肾近端小管中的磷酸盐转运。钠丢失会导致磷酸盐吸收和尿钙排泄增加,刺激血清成纤维细胞生长因子23(FGF23)升高,导致磷尿并抑制1,25-二羟维生素D的产生,以维持磷酸盐平衡。1,25-二羟基维生素D浓度的降低会减少胃肠道对钙的吸收,可能会损害骨骼矿化。血钙浓度降低导致继发性甲状旁腺功能亢进,甲状旁腺素(PTH)水平的升高和1,25-二羟基维生素D水平的降低,促进骨吸收、影响骨转化及骨矿化[19-21]。
在糖尿病肾病患者人群中,与安慰剂相比,达格列净治疗期间,血清磷酸盐水平、PTH、FGF23均显著增加[22-23]。然而在T2DM人群中无法证实这些发现[24],可能原因是招募的患者处在糖尿病肾病的不同阶段。总之,SGLT2i可能会增加糖尿病肾病患者的PTH水平,并增加磷酸再吸收增加引起的FGF23升高,从而降低活性维生素D水平,进而影响骨代谢。
高尿钙症是遗传性SGLT2缺乏症儿童的一种众所周知的现象[25]。因此,SGLT2i与钙代谢的关系得到证实。动物实验也证明,健康的DBA/2J小鼠卡格列净治疗9~10周会出现高尿钙症,同时伴有部分骨皮质厚度[26]、矿物密度降低[27],抑制骨基质的矿化[28]。slc5a2基因突变的“Jimbee”小鼠模型(终身SGLT2i功能丧失)表现出慢性多尿、糖尿和高钙尿症,并导致一些骨组织矿物质密度降低。但皮质骨强度不受突变的影响,不升高骨折风险[29]。有研究提示卡格列净促进成骨细胞MC3T3-E1分化并改善T2DM小鼠的骨微结构[30]。因此,SGLT2i可以影响钙磷代谢、骨矿代谢、骨微结构,对骨折风险的影响不明确。
3 SGLT2i通过减重间接影响骨转化
SGLT2负责约90%的肾葡萄糖的重吸收。尚无数据表明SGLT2在与骨稳态相关的骨源性细胞(如成骨细胞或破骨细胞、骨髓巨噬细胞)中表达[31],一项啮齿动物研究称,SGLT2在骨骼组织及其他肾外组织中均无表达[32]。予以小鼠静脉注射4-[18F]-达格列净,在骨组织中未检测到结合[33]。因此,推测SGLT2对骨代谢影响可能为间接作用。
一项随机临床试验[34]显示,与安慰剂组相比,卡格列净治疗104周后髋关节BMD小幅度下降,治疗52周后,血清骨吸收(β-CTX)和骨形成(骨钙素)标志物显著增加。β-CTX与体重下降显著相关。多项研究证实,由运动和饮食诱导的体重减轻与BMD的降低和骨转换的增加有关[35-38]。有荟萃分析显示,在超重和肥胖的个体中,饮食相关的体重减轻与髋关节BMD的显著降低相关,并且总髋关节BMD的下降发生在骨钙素、CTX和I型胶原交联N-末端肽(NTX)血清浓度的统计学显著升高之后,这表明减肥饮食增加了骨转化率[39]。在接受卡格列净治疗的患者中,BMD和β-CTX的增加与体重减轻之间存在显著关系,大约40%的髋关节BMD的减少与体重减轻有关[34,40]。因此推测,研究中观察到的BMD及骨转化的变化可能在一定程度上是由于SGLT2i治疗导致的体重减轻,而不是药物的直接作用于骨代谢所致。
抑制SGLT2降低肾糖阈,促进热量的消耗,可增加肝异生、胰高血糖素的分泌、酮体生成和脂质氧化,促进脂肪的减少[41-42]。多项临床试验也证实SGLT2i可降低T2DM患者脂肪量,且对内脏脂肪的影响大于皮下脂肪[43-46]。SGLT2i并不直接抑制炎症反应,但是可抑制T2DM状态下的慢性炎症,并降低细胞因子和趋化因子(包括TNF-a、IL-6和MCP-1)的mRNA表达,改善脂肪组织功能,诱导血清瘦素、脂联素和IL-6有利变化[47],机制可能与减少脂肪量有关。脂肪含量减低后脂联素水平升高,且与β-CTX水平呈正相关[48],提示骨转换增强。基于现有的随机对照试验数据进行的Meta分析并不支持SGLT2i与T2DM患者骨折风险增加有显著相关性[49]。因此,SGLT2i可能通过体重减轻影响体脂分布对糖尿病骨代谢障碍产生有益影响,其机制可能与减轻炎症反应有关[50]。
4 SGLT2i通过维持肌肉质量对T2DM骨代谢障碍产生有益影响
T2DM患者常表现为异位脂肪积累,肌肉质量、功能进行性下降。需要通过减少脂肪量和保持肌肉量来减轻体重的降糖药物。因SGLT2i有减重作用,肌肉质量损失成为临床医师使用SGLT2i时担心的主要问题,可能机制为:SGLT2促进胰岛素水平的降低和胰高血糖素水平的升高导致糖异生的激活,这不仅可能促进脂肪分解,还可能促进骨骼肌中的蛋白质水解,向肝脏提供氨基酸,从而导致肌少症[51]。然而,SGLT2i的长期作用可能提高胰岛素敏感性,抑制肌肉分解代谢,维持骨骼肌功能和质量[52]。
为确定SGLT2i对肌肉质量及功能的影响,近年来开展多个有关试验。普遍认为,SGLT2i诱导的渗透性利尿是初期体重下降的原因,而长期的体重下降则是脂肪量减少的结果,不影响肌肉质量[53-54]。在一项为期102周的临床试验中,达格列净引起的脂肪量减少大于安慰剂,瘦质量减少相当[55];在日本T2DM患者中,达格列净治疗6个月显著降低了体重和总脂肪量,而不影响肌肉质量[56];甚至有研究证实SGLT2i治疗10周后可增加握力[57];达格列净短期治疗可有效改善T2DM患者肌肉组织的胰岛素敏感性[58-59]。关于这些SGLT2i对肌肉质量和功能的有益作用,可能的机制是对慢性炎症和脂肪因子谱的影响[60],以及改善线粒体功能[61]。T2DM患者达格列净治疗可显著降低肌肉生长抑素水平并维持骨骼肌质量[62]。卡格列净通过抑制肌肉抑制素产生的肌内通路从而降低肌肉抑制素水平,升高IGF-1水平,降低肌肉组织炎症细胞因子水平、巨噬细胞积累,防止肌肉质量下降,恢复肌肉的收缩力[58]。总之,SGLT2i可降低T2DM患者肌肉萎缩风险。骨骼肌是处理葡萄糖的主要部位,维持骨骼肌质量有助于增加能量消耗,破坏了肥胖和炎症反应的恶性循环。因SGLT2i对于脂肪与肌肉的有益作用,笔者推测SGLT2i在2型糖尿病患者骨代谢障碍方面存在潜在好处。
5 SGLT2i增加骨折风险可能与渗透利尿继发的跌倒和容量不足有关
关于SGLT2i对骨折风险影响的研究表明,其使用与骨折发生率增加有关,特别是在病程较长、微血管并发症、肾功能受损和心血管风险升高的老年患者中[63-64]。在EmpaReg试验中,发生骨折与容量不足的患者比例相似[64]。因此,容量不足事件发生率增加可能是卡格列净治疗后发生与跌倒相关的骨折的原因。因没收集跌倒后的数据,不能作为确定性的结论[63]。另一项研究评估了达格列净对252例T2DM和轻度肾衰竭患者骨折风险的影响,容量不足是骨折的一个促进因素[65]。
现有研究表明,SGLT2i对骨折风险的影响更可能继发于渗透性利尿的容量不足。容量不足是SGLT2i常见的不良反应,抑制了SGLT2后,减少了钠及葡萄糖的重吸收,肾小管内的葡萄糖浓度升高使水重吸收减少,尿量增加,机体容量减少,特别是在血糖过高的患者,肾脏滤过的葡萄糖超过了肾糖阈,出现渗透性利尿,丢失大量血容量。容量减少是老年人出现体位性低血压、体位性头晕、晕厥、乏力、嗜睡、酮症酸中毒、高渗性昏迷的高危因素[66]。最终导致老年患者发生跌倒性骨折的风险增加。然而仍需要大规模的临床研究来验证这些推测。在得到确切结论之前,SGLT2i在病程较长、肾功能受损和高骨折风险的老年患者中应慎用。
6 总结
综上所述,SGLT2i对骨骼无直接作用,可能通过减重、维持肌肉质量对T2DM骨代谢障碍产生影响,其机制可能是脂肪及肌肉组织的细胞因子介导的(图2)。SGLT2i导致钙和磷酸盐稳态紊乱,触发甲状旁腺激素(PTH)水平升高,1,25-二羟基维生素D水平降低,影响骨代谢。SGLT2i可能通过体重减轻影响体脂分布及维持肌肉质量对糖尿病骨代谢障碍产生有益影响。在使用SGLT2i治疗的肾功能受损和心血管疾病风险升高的老年患者中观察到骨折风险,更可能与渗透利尿继发的跌倒和容量不足有关。因此,用药过程中应监测患者容量变化,避免并发症的发生。

图2 SGLT2i对骨代谢影响的潜在机制Fig.2 Potential mechanism of the effect of SGLT2i on bone metabolism

