骨髓间充质干细胞衰老研究进展
于淼瑛 宋晓东 王艳辉 刘曾旭
1.上饶师范学院生命科学学院,江西 上饶 334001 2.江西医学高等专科学校基础医学院,江西 上饶 334000 3.南昌大学基础医学院,江西 南昌 330006
多种损伤或应激刺激均可导致细胞衰老,产生表观遗传、形态和功能改变,以及由多种促炎因子组成的衰老相关分泌表型(senescence-associated secretory phenotype,SASP),是各种年龄相关和代谢性疾病的驱动因素[1-2]。间充质干细胞(mesenchymal stem cells,MSCs)具有组织再生、抗炎和免疫调节等功能,且不受免疫排斥、恶性转化和伦理问题等限制;同时,易于分离和扩增,被认为是最适合移植治疗的干细胞类型。目前,骨髓组织是MSCs最重要的获取来源,骨髓间充质干细胞(bone marrow mesenchymal stem cells,BM-MSCs)已在多种创伤性、炎症性、自身免疫性和退行性疾病的研究与治疗中被广泛应用且效果良好[3]。随年龄增长而出现的自然衰老和由疾病损伤等原因造成的复制性与应激性衰老导致BM-MSCs的形态学、染色质结构、迁移归巢、再生分化、代谢平衡和旁分泌等细胞特性发生显著改变,造成其有益功能急剧下降并诱发慢性炎症。衰老BM-MSCs的积累造成骨髓的更新活性、新骨形成率和骨折修复率显著降低,引发骨骼愈合延迟、骨丢失和骨关节炎等骨组织退行性病变,是骨质疏松症等代谢性骨病和高龄体重增加以及机体衰老的核心诱因。为满足细胞移植的数量需求而对分离后BM-MSCs进行的长期体外扩增可诱发其复制性与应激性衰老,导致移植后的组织修复和免疫调控能力下降,且极易引起免疫排斥、炎症反应和恶性转化等安全风险[4-5](图1)。因此,全面探讨和深入理解BM-MSCs的衰老过程是延缓和逆转年龄相关退行性病变以及完善BM-MSCs临床治疗的重要前提。
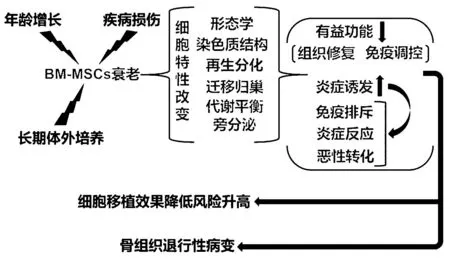
图1 BM-MSCs衰老导致骨组织退行性病变和移植价值降低Fig.1 Senescence of BM-MSCs leads to bone tissue degenerative diseases and decreased transplantation value
1 衰老改变BM-MSCs细胞特性
1.1 衰老导致BM-MSCs出现细胞周期阻滞
衰老BM-MSCs中,多能性转录因子和细胞周期调控基因的表达发生显著变化,引起细胞周期G1/G0期阻滞和S期缩短[4,6]。Cdkn2a(Cyclin-dependent kinase 2a)位点编码的肿瘤抑制因子p16INK4A、成视网膜细胞瘤蛋白(retinoblastoma,Rb)、肿瘤抑制基因p53及其下游因子p21WAF1/CIP1、以及共济失调毛细血管扩张症突变蛋白(ataxia-telangiectasia mutated,ATM)是经典的细胞周期抑制因子,其活性表达在BM-MSCs衰老过程中显著增加。各种刺激下的应激和持续过度的DNA损伤反应(DNA damage response,DDR)通过激活p16INK4A-Rb或p53-p21WAF1/CIP1信号通路诱导细胞进入永久性的细胞周期阻滞和显著的结构功能改变是衰老细胞的共同特征;而消融p16INK4A或p21WAF1/CIP1可逆转BM-MSCs衰老[7-9]。快速衰老的MSCs中,p16INK4A、p53、p21WAF1/CIP1和ATM的表达均显著增加;而延迟衰老的MSCs中p16INK4A表达上调,p21WAF1/CIP1、p53和ATM表达降低[10-11]。
MSCs的快速增殖是通过维持Nanog、Oct4、Sox-2、PBX1和Rex1等多能性转录因子表达以抑制p16INK4A和p21WAF1/CIP1等细胞周期抑制因子实现的。Nanog和Oct4直接结合到DNA甲基转移酶DNMT1的启动子上增强其表达以维持p16INK4A和p21WAF1/CIP1启动子的DNA甲基化进而抑制两者表达[12]。PBX1激活Nanog启动子并与Nanog、Oct4和Sox-2合作抑制MSCs衰老,其下游通路包括通过抑制p16INK4A和p21WAF1/CIP1,以及AIF、cleaved caspase 3和CytC等凋亡蛋白的表达,并激活PI3K-AKT信号通路,以维持MSCs的自我更新和分化平衡;同时,通过减少活性氧(reactive oxygen species,ROS)积累,并调节PARP1、Ku70、Ku80和Rad51等DNA损伤修复蛋白表达,来降低ROS介导的DDR[13-14](图2)。PI3K-AKT信号通路对MSCs衰老的调节具有双重作用,AKT激活可降低p16INK4A、p53和p21WAF1/CIP1表达;而持续的AKT过度活化则直接磷酸化p21WAF1/CIP1触发MSCs的过早衰老[15]。快速衰老的BM-MSCs中,Nanog、Oct4、Sox-2和Rex1的表达水平均显著下降;而延迟衰老过程中,Sox-2和Rex1的表达水平没有显著变化[12-14]。
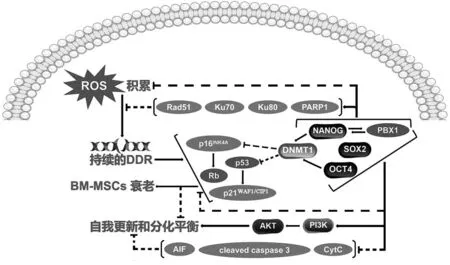
图2 多能性转录因子抑制BM-MSCs衰老并促进其自我更新和分化平衡Fig.2 Pluripotent transcription factors inhibit senescence of BM-MSCs and promote their self-renewal and differentiation balance
1.2 衰老过程中BM-MSCs的表观遗传修饰改变
1.2.1衰老过程中BM-MSCs的染色质结构改变:衰老BM-MSCs中,染色质上出现大量密集紧缩转录不活跃的衰老相关异染色质灶(senescence-associated heterochromatin foci,SAHF),结构富含γH2AX和53BP1等DDR相关蛋白,且有利于维持BM-MSCs衰老所需的持续DNA损伤修复过程,抑制E2Fs活性及其调控的Cyclin A、Cyclin E、PCNA和MCM4等细胞增殖基因表达。同时,组蛋白去乙酰化酶(histone deacetylases,HDACs)表达降低,导致组蛋白的H3K9和H3K14乙酰化加剧,引起Naong、Oct4、Sox-2和端粒酶催化亚基Tert表达降低,以及众多microRNAs表达激活来抑制高迁移率族蛋白A2(high mobility group A2,HMGA2)翻译。HMGA2可激活Cyclin A、Cyclin E1、Cyclin F和CDC25A等细胞增殖基因,诱导PI3K-AKT与mTOR-p70S6K信号通路,并抑制p16INK4A等衰老基因表达[16-17]。DNA甲基转移酶(DNA methyltransferases,DNMTs)通过促进组蛋白甲基转移酶EZH1和EZH2增加p16INK4A和p21WAF1/CIP1启动子区域的抑制性靶向标记。MSCs衰老过程中,DNMT1和DNMT3B表达逐渐下调,引起p16INK4A和p21WAF1/CIP1的表达升高(图3)。与DNMT1和DNMT3B相反,DNMT3A在MSCs衰老过程中表达增加并诱导相关基因的新甲基化[18-19]。
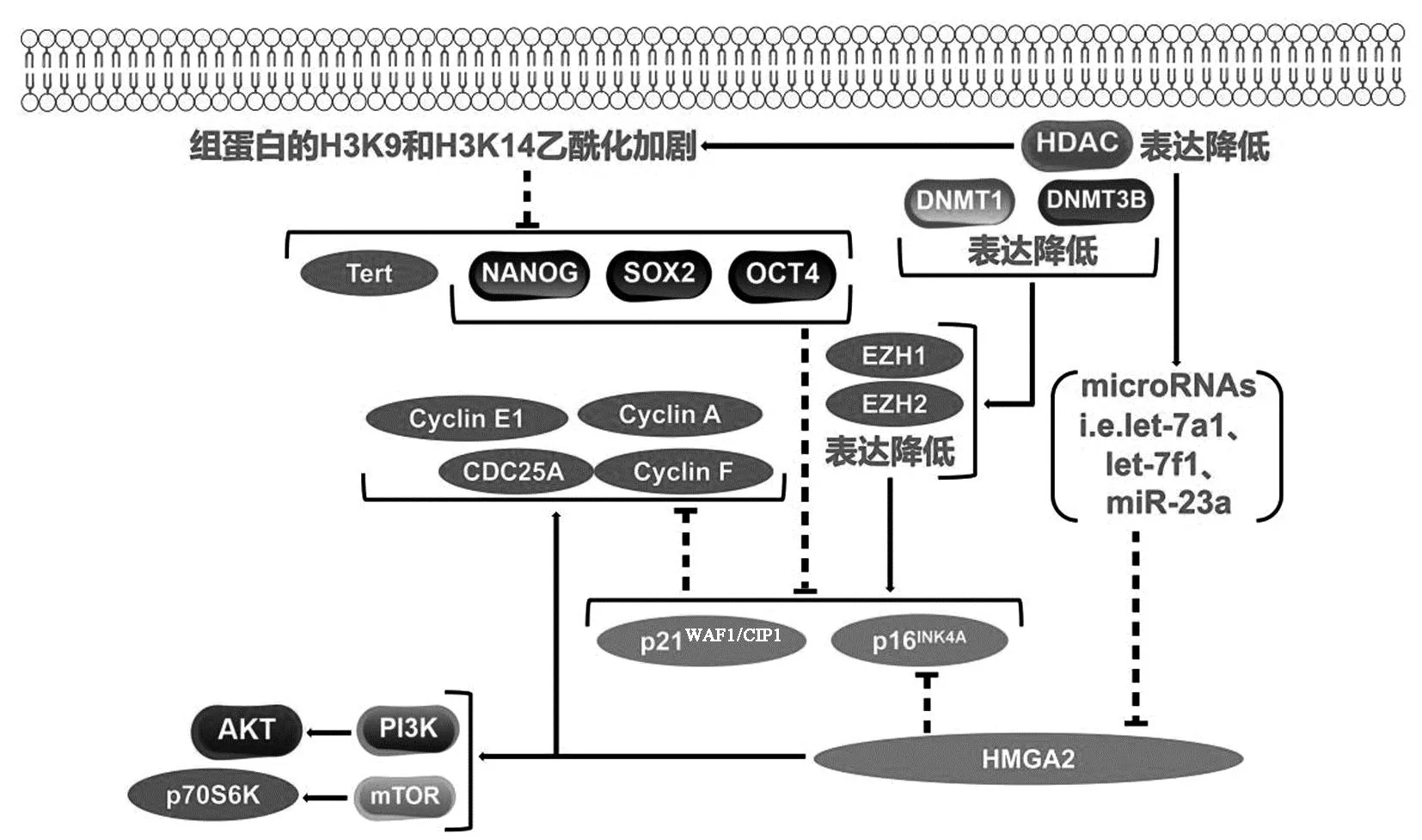
图3 衰老BM-MSCs中的表观遗传修饰因子及下游靶基因表达变化Fig.3 Expression changes of epigenetic modification factors and downstream target genes in senescence BM-MSCs
1.2.2衰老过程中BM-MSCs的microRNAs及其下游靶基因表达变化:作为重要的表观遗传调控因子,众多microRNAs在DDR、氧化应激和线粒体功能障碍等因素对BM-MSCs的衰老诱导中发挥重要作用。miR-21直接靶向抑制Sox-2表达,或通过降低Nanog和Oct4表达间接抑制Sox-2表达[20-21]。miR-200c和miR-155抑制线粒体活性并促进ROS生成[22-23]。miR-195通过抑制Tert、Sirt1、AKT和FOXO3的磷酸化表达,诱导端粒损伤并抑制自噬进而促进BM-MSCs衰老[24]。Epas1是重要的过氧化物酶体选择性自噬调节蛋白,也是miR-142的靶基因。衰老BM-MSCs中,miR-142表达显著上调并靶向抑制Epas1活性表达,导致ROS升高和受损过氧化物酶体积累[25]。随着年龄增长,BM-MSCs中的miR-31a-5p表达上调,抑制E2F2和SATB2转录促进SAHF结构形成,进而诱导BM-MSCs衰老[20-21]。miR-204和miR-320调控IL-6和MMP-3等SASP因子分泌,并靶向抑制Runx2等成骨分化基因表达[26-27]。miR-34a介导p53对Nampt-NAD+-Sirt1信号通路的抑制,通过代谢障碍诱导MSCs衰老[28]。miR29b-1-5p的靶基因SDF-1可增强BM-MSCs的募集、增殖分化,以及在氧化应激中的自噬,衰老骨髓微环境激活miR29b-1-5p,降低SDF-1表达,诱导BM-BMSCs衰老[20-21]。
1.3 衰老BM-MSCs中发生细胞骨架重组和迁移归巢能力下降
衰老BM-MSCs的肌动蛋白应力纤维增加而微管结合蛋白数量减少,使细胞内的力学结构变得更加均匀,细胞核更加收缩、细胞质中积累更多的颗粒和包涵体,导致细胞形态由典型的收缩纺锤形转变为扩张扁平且不均匀的颗粒煎蛋状,与塑料表面的粘附能力、集落形成能力和运动迁移能力均显著降低[29]。
1.4 衰老BM-MSCs呈现SASP表型
衰老BM-MSCs呈现独特的SASP表型,释放多种促炎因子以自分泌的方式稳定自身衰老,并通过旁分泌诱导邻近BM-MSCs等成骨谱系细胞中ROS生成增加和促进破骨细胞生成,加剧BM-MSCs的免疫调节和生态位支持功能受损,并增强全身水平的炎症反应过度激活免疫系统,被认为是诱发持续性慢性炎症和年龄相关疾病的重要原因[30]。随着年龄增长,全身和骨髓微环境中出现显著的IL-6等促炎因子水平升高和IL-10等抗炎因子水平降低,并与BM-MSCs的TGF-β、NF-κB、JAK-STAT3和MAPK等信号通路激活和免疫调节功能降低密切相关,是骨质疏松症与类风湿性关节炎等发生和维持的重要因素。IL-4和IL-13可触发BM-MSCs中的miR-142表达,通过氧化应激诱导BM-MSCs衰老[29]。TGF-β的分泌水平在衰老BM-MSCs中增加,并刺激各种细胞因子、炎症介质和其他活性物质分泌,以及影响细胞外基质的合成和降解,抑制TGF-β受体可促进体外培养BM-MSCs的扩增和维持未分化状态。NF-κB信号通路在BM-MSCs衰老过程中激活并促进TNF-α和IL-1β等促炎因子分泌,而TNF-α和IL-1β又可激活NF-κB信号通路,形成正反馈加剧BM-MSCs衰老[29,31]。
2 衰老导致BM-MSCs的细胞功能降低
2.1 衰老BM-MSCs丧失成骨与脂肪分化平衡
作为成骨细胞和骨髓脂肪细胞的共同祖细胞,BM-MSCs的成骨与脂肪分化平衡对维持骨脂平衡、骨稳态和重建骨代谢至关重要。随着年龄增长,氧化应激和DNA损伤积累在BM-MSCs中诱发其分化向脂肪方向倾斜,Runx2/CBFα1、Osterix、Alp和Ocn等成骨分化基因的表达和钙沉积形成显著降低,而C/EBP、PPARγ和Lpl等脂肪分化基因的表达和脂滴形成显著增加[5,32-33]。衰老BM-MSCs的自我更新和成骨分化逐渐降低甚至丧失,而成脂分化明显增加,造成骨组织稳态紊乱和再生受损;同时,衰老BM-MSCs的SASP因子促进破骨细胞生成和成骨细胞减少,损伤成骨细胞的骨形成和破骨细胞的骨吸收之间的平衡,加剧骨形成损伤并引发骨丢失和骨质疏松症等病变[34-35]。
2.2 衰老导致BM-MSCs的免疫调节功能降低
衰老对BM-MSCs在诱导巨噬细胞极化、抑制淋巴细胞增殖分化、应对促炎信号的迁移能力、以及平衡造血干细胞(hematopoietic stem cells,HSCs)的淋巴系与髓系分化等功能均产生重要影响,造成BM-MSCs的免疫调节功能受损和促炎因子表达升高,在自身免疫性疾病、炎症性疾病和退行性疾病的病理进程中发挥重要推动作用[36-37]。MSCs的免疫调节活性并不总是抑制性的,而是在本质上取决于所暴露微环境中不同的微环境因子[37]。MSCs通过分泌免疫抑制因子或直接的细胞-细胞间相互作用诱导并维持巨噬细胞的抗炎表型,而这两种过程均依赖于微环境中存在短暂但浓度很高的促炎信号刺激。随着年龄增长,骨髓组织中逐渐呈现出长期存在而维持在低水平的IFN-γ等促炎因子和相当水平的抗炎因子,构成慢性炎症微环境,通过TLR4调控BM-MSCs向免疫刺激表型转换,产生更多的促炎因子而阻碍炎症解决[38]。复制性衰老的BM-MSCs中FAS-L表达显著降低,诱导T细胞凋亡和抑制其增殖的能力减弱;同时,抑制T细胞分泌IFN-γ与TNF-α等促炎因子和促进其分泌IL-10等抗炎因子的功能也降低。衰老BM-MSCs呈现促炎的SASP表型,高表达IL-1、IL-6、IL-8、TNF-α、MIF、MCP1和GM-CSF等促炎因子并招募炎症细胞;而IL-2和IL-10等抑炎因子的分泌水平则显著降低,导致微环境中促炎表型巨噬细胞和T细胞的数量和迁移增加,Th1细胞和Th17细胞扩增,并过度产生TNF-α和IL-17等炎性因子[39-40]。衰老BM-MSCs分泌组中众多的炎性因子在系统水平上加剧炎症反应,过度激活免疫系统、诱发免疫衰老及促进癌细胞增殖和迁移[37]。
2.3 衰老BM-MSCs的干细胞生态位支持功能下降并引起骨髓造血重建恶化
随年龄增长而频繁出现的突变可诱发骨髓微环境老化和免疫细胞衰老,并逐渐导致机体的炎症状态;同时,骨髓中的HSCs也经历分化与自我更新的下降[41]。BM-MSCs的生态位支持功能对维持骨髓微环境和造血功能具有重要意义。然而,衰老导致BM-MSCs失去分化平衡,骨髓生态位和造血支持功能下降,骨髓中出现以牺牲骨发育为代价的脂肪积累,反过来又抑制骨髓的成骨再生和造血[6,10,17]。分化的脂肪细胞可中断淋巴细胞生成,抑制HSCs的淋巴系分化而促进髓系分化,造成骨髓的髓系偏倚和造血功能失调,增加骨髓生成的同时加剧骨髓造血重建恶化。同时,衰老BM-MSCs与炎症发展一致的SASP表型导致其与HSCs之间的通讯异常造成无效造血,诱发骨髓增生异常综合征;并促进微环境中ASXL1等基因突变的反复积累,引发造血系统基因组不稳定,驱动白血病等恶性肿瘤发生[17,40-42](图4)。骨髓增生异常综合征、椎间盘退变和哈钦森吉尔福德综合征等衰老相关疾病患者的髓核中均被发现有衰老BM-MSCs的积累[5-6]。
3 预防和逆转BM-MSCs衰老的策略
3.1 小分子化合物和抑制剂
阿司匹林和维生素C等通过激活内源性端粒酶促进BM-MSCs再生增殖和成骨分化,但过度的端粒酶激活可诱发其恶性转化。N-乙酰-L-半胱氨酸、异硫氰酸盐和抗坏血酸等抗氧化剂,以及雷帕霉素等mTOR和MAPK信号通路抑制剂可改善氧化损伤恢复衰老MSCs功能[7,10-11,40]。
3.2 中药活性成分
槲皮素通过调节Wnt-β-catenin、MAPK和PI3K-AKT信号通路抑制BM-MSCs衰老[42-43]。左归丸通过抑制Wnt-β-catenin信号通路改善DNA损伤来延缓BM-MSCs衰老[44-45]。川芎嗪通过抑制NF-κB信号通路延缓BM-MSCs衰老,增强其自我更新和分化平衡并降低促炎因子分泌[42-43,46]。黄芪通过调节钙磷代谢抑制BM-MSCs衰老促进其成骨分化[47]。
3.3 生长因子和激素
FGF-2和PDGF等生长因子显著延缓MSCs衰老,促进其增殖和分化平衡[30]。MIF通过激活自噬恢复衰老BM-MSCs活力[48]。褪黑素通过上调Sirt1活性表达来抑制ROS的积累和p53、ERK与p38的活性表达,最终抑制BM-MSCs衰老[29]。
3.4 细胞基因工程
过表达Sirt3可通过降低ROS水平和抑制p16INK4A与p21WAF1/CIP1的活性表达实现对衰老MSCs的逆转。过表达天冬氨酸β-羟化酶通过抑制GSK3β介导的Wnt信号通路延缓BM-MSCs衰老并调控其成骨分化。过表达Tert可恢复衰老BM-MSCs的正常核型和再生分化能力[30,49]。过表达SATB2显著增强BM-MSCs的多能性转录因子表达和自噬,进而抑制其衰老[50]。敲除p16INK4A或沉默Rb可减少DNA损伤而抑制MSCs衰老,但沉默肿瘤抑制基因会破坏MSCs分化平衡并增加肿瘤发生风险[7-8]。
4 小结与展望
衰老损害BM-MSCs功能,并导致组织器官功能下降、个体衰老和相关疾病、以及肿瘤发生。衰老过程中,各种细胞特性发生相互影响的显著改变,然而目前对衰老BM-MSCs各种特性变化之间分子关联的研究尚鲜有报道。Nanog等多能性转录因子在BM-MSCs中呈现极低的表达水平,过表达这些多能性转录因子对衰老BM-MSCs的逆转作用可能是作为某些核心调控因子的替代来实现的,而BM-MSCs随衰老过程逐渐增强的异质性特性可成为通过单细胞测序技术挖掘这些核心调控基因的天然优势。骨髓微环境中的代谢产物和调控因子对BM-MSCs的细胞功能产生重要影响;同时,衰老BM-MSCs的SASP表型也影响骨髓微环境的分子信号组成。目前,对骨髓微环境恶化与BM-MSCs衰老之间的分子关系和由之引发骨组织退行性疾病的分子细节尚缺乏深入探讨。骨髓微环境信号因子对BM-MSCs分化平衡和其与免疫细胞及造血干细胞互作的影响主要是通过改变其染色质结构实现的,深入探索BM-MSCs衰老过程中染色质结构与分泌基因表达谱变化之间相互关联的分子细节有助于更完整和详细地揭示骨髓微环境恶化与BM-MSCs衰老诱发之间的相互关系。目前,更多的干预措施需要被开发出来以提高BM-MSCs临床应用的有效性和安全性。中药活性成分和小分子化合物与基因工程技术相结合将在这一领域中发挥巨大作用,中药的多靶点特性可在逆转BM-MSCs衰老分子通路的探明中发挥优势,而小分子化合物则以其低廉方便组合灵活的优势成为一些珍贵药材的替代,最后通过基因工程技术可获得稳定遗传的衰老抑制细胞系。

