氯化锂对OVX小鼠骨丢失和JAK/STAT3信号通路的影响
张浦燊 芦泊帆 胡云鹏 连强强 侯晓丽 邢磊 王玉丹 张柳 田发明*
1.华北理工大学公共卫生学院,河北 唐山 063210 2.河北医科大学基础医学院,河北 石家庄 050011 3.国家矿山医疗救助中心应急总医院骨科,北京 100028
骨质疏松症(osteoporosis,OP)是一种以骨密度(bone mineral density,BMD)降低、骨组织微结构受损为特征的全身性骨代谢疾病,同时发生脆性骨折的概率增加[1-2]。目前已有动物实验证实氯化锂(lithium chloride,LiCl)对OP有一定的治疗潜能,可以显著促进小鼠骨形成,改善骨骼质量[3-5]。
JAK/STAT3信号通路参与多种骨相关疾病的发生发展[6]。Sun等[7]发现JAK/STAT信号通路与OP关系密切,在成骨细胞(osteoblast,OB)分化过程中都具有重要作用[8]。STAT3可能增强Treg介导的抑炎作用,从而促进骨折愈合[9];JAK2/STAT3通路的活化可以促进骨髓间充质干细胞(bone marrow mesenchymal stem cells,BMSCs)向OB分化,加速骨再生和骨缺损愈合[10]。此外,Davidson等[11]研究表明,STAT3基因敲除小鼠的BMD和骨形成率显著下降。
基于以上笔者推测在相关因素刺激下OB的JAK/STAT3信号通路活性异常参与了OP的进展,而LiCl通过对该信号通路活性的调控最终延缓了OP的进程。本研究拟以OVX小鼠作为观察对象,通过动物模型建立、OB培养,结合LiCl干预,初步探讨LiCl对JAK/STAT3信号通路活性的调控作用以及防治OP的效果。
1 材料与方法
1.1 实验材料
1.1.1实验动物:8周龄C57BL6/J小鼠24只(购自华北理工大学实验动物中心,实验动物生产和使用许可NCSTALBS014)。随机将小鼠分为3组:假手术组(Sham组)、骨质疏松模型组(OVX组)、氯化锂干预组(OVX+LiCl组)。Sham组仅开腹后即缝合腹膜,而OVX与OVX+LiCl组则行双侧卵巢摘除术。OVX+LiCl组每日进行LiCl(100 mg/kg)腹腔注射,而Sham组与OVX组则给予等体积盐水注射,8周后取材。
1.1.2实验细胞:8周龄健康C57BL6/J小鼠,1对2只,适应性喂养1周后配笼繁殖,取新生3 d的乳鼠备用。采用DMEM培养基在体积分数为10%的无菌胎牛血清、1%的青-链霉素的培养液中以植块法培养原代OB,传代培养至第2代后,取对数生长期细胞进行实验,将细胞分为空白对照组(Control组)和LiCl组两组,实验组给予5 mmol/L LiCl干预。
1.1.3主要试剂:0.9%氯化钠注射液、PBS(北京索莱宝)、甲醛溶液、胰酶(北京索莱宝)、碘伏消毒液(500 mL)、NaOH颗粒、无水乙醇、二甲苯、低熔点石蜡(58℃~60℃)、高熔点石蜡(62℃~67℃)、一抗体稀释液(上海博士德)、DAB显色试剂盒(中杉金桥)、二抗 PV-6001试剂盒(中杉金桥)、内源性过氧化物酶阻断剂(上海博士德)。
1.2 实验方法
1.2.1样本采集:将右侧股骨和胫骨在4%的甲醛中固定;两天后右侧胫骨转移至70%乙醇中4℃保存用以Micro-CT分析骨微结构;左侧股骨迅速用0.9%氯化钠溶液浸润的无菌纱布包裹,在-80℃冻存,用于三点弯曲试验。
1.2.2胫骨Micro-CT检测:扫描Micro-CT采用8.99μm3的分辨率,采用Bruker公司(比利时)的Sky Scan1176型Micro-CT进行,松质骨感兴趣区域为小鼠右侧胫骨生长板下50层,整个区域的厚度为0.5 mm;皮质骨的感兴趣区域从松质骨所选区域后200层开始,继续计数100层。分析时使用Bruker公司所兼容的软件进行。
1.2.3股骨三点弯曲试验:将标本放在试验机支撑物中心,跨距为8 mm。设定参数值2 N,2 mm/min的恒定位移速率,试验机停止的终点为股骨断裂。整个实验操作采用SHIMDZU日本公司的万能电子试验机进行,主要指标包括最大载荷和最大应力。
这第二种“正在形成或者继续重建”的结构与存在论中的建构结构似乎具有某些相通之处。前提是,如果我们以存在主义观点而非生物主义观点来给这第二种结构定下基调——从人的活动即“此在”结构出发,就可以将“民间故事活动”看成一个“开放的活的”结构系统,始终处于未封闭的形成过程中,并通过不断的交流进行调节达到暂时平衡。[注]此观点详见张琼洁《当代民间故事活动价值发生研究》,《民族文学研究》,2018年,第1期。
1.2.4免疫组织化学染色检测P-STAT3、JAK2、STAT3蛋白表达情况:将Micro-CT检测完的胫骨标本脱钙完成后,脱蜡水化,抗原修复,阻断内源性过氧化物酶,一抗、二抗孵育,DAB显色,苏木素复染,脱水,封固,显微镜下观察染色结果。本实验应用图像分析专业软件Image Pro Plus(Med.Cybern,Inc,US)对图片进行分析,免疫组化染色强度用平均光密度(IOD/mm2)表示。由3人组成的实验小组自主独立采集数据,取3人平均值进行分析。
1.2.5CCK8法检测原代OB的增殖活性:待第二代的OB生长密度为80%~85%时,消化后以每孔3×103cell/mm2的密度接种于96孔板中,分为4组,每组设置7个复孔,24 h之后将培养基分别更换为不含LiCl、含LiCl(2.5、5、10 mmol/L)的培养基,培养箱保持37℃,5%CO2的环境,分别继续培养1、3、5 d后,每孔加入10 μL的CCK8检测试剂,避光孵育1 h,放置到酶标仪中在波长450 nm处检测,测量吸光度(OD值)。
1.2.7茜素红染色检测OB分化能力:茜素红染色步骤同ALP染色,确认染色良好后进行光镜下观察并照相。随后进行半定量检测,每孔加入1 mL 10%氯化十六烷基吡啶置在37℃温箱下放30 min,然后吸掉上清,使用分光光度计,在波长560 nm处测样本吸光值,用氯化十六烷基吡啶溶液调零。
1.2.8实时荧光定量PCR检测OB中STAT3 和OCN mRNA水平:提取总RNA后进行纯度以及浓度检测,反转录合成cDNA,Real-time PCR反应,根据Takara说明书进行操作,检测骨钙素(osteocalcin,OCN)和STAT3 mRNA的表达。各基因的引物序列见表1,由吉玛公司设计、合成。

表1 Real-time PCR引物序列Table 1 Primer sequences for real-time PCR
1.3 统计学方法
结果数据采用SPSS 17.0软件进行统计计算,全部计量数据以均数±标准差表示,两组间比较采用t检验,多组间比较用单因素方差分析,P<0.05认为差异有统计学意义。
2 结果
2.1 骨形态学参数
Mirco-CT分析结果见表2,三维重建结构见图1。松质骨结果显示,OVX 组的BMD、骨体积(bone volume,BV)、骨小梁相对体积(bone volume/tissue volume,BV/TV)、骨小梁数量(trabecular number,Tb.N)、骨小梁厚度(trabecular thickness,Tb.Th)均显著低于Sham组(P<0.05);OVX+LiCl组的BMD、BV、BV/TV、Tb.N、Tb.Th均明显低于Sham组(P<0.05);与OVX组相比,OVX+LiCl组的BMD和Tb.Sp显著升高(P<0.05)。皮质骨结果显示,OVX+LiCl组和OVX组的皮质骨面积(cortical bone area,Ct.Ar)较Sham组明显下降,差异有统计学意义(P<0.05),OVX+LiCl组相较于OVX组和Sham组Ct.Po显著升高(P<0.05)。

图1 干预2个月后各组三维骨重建情况注:A:Sham组;B:OVX组;C:LiCl组。Fig.1 Three-dimensional bone reconstruction in each group after 2 months of interventionA: Sham group; B: OVX group; C: LiCl group.
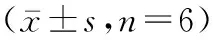
表2 各组松质骨、皮质骨参数Table 2 Cancellous and cortical bone parameters in each group n=6)
2.2 LiCl对骨骼力学的影响
OVX 组的最大载荷、最大应力均明显低于Sham组(P<0.05),OVX+LiCl组的最大载荷、最大应力较OVX组明显升高(P<0.05)。见表3。
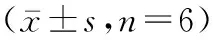
表3 各组LiCl对骨骼力学的影响Table 3 Effects of lithium chloride on the skeletal mechanics in each group n=6)
2.3 P-STAT3、JAK2、STAT3蛋白表达情况
P-STAT3、JAK2、STAT3的蛋白主要分布于骨小梁表面OB内。免疫组织化学染色定量分析检测P-STAT3的表达分析结果示OVX组的平均光密度均明显低于Sham组(P<0.05),OVX+LiCl组的平均光密度较OVX组明显升高(P<0.05)。JAK2、STAT3的表达分析结果示OVX+LiCl 组的平均光密度较OVX组明显升高(P<0.05)。见图2、表4。
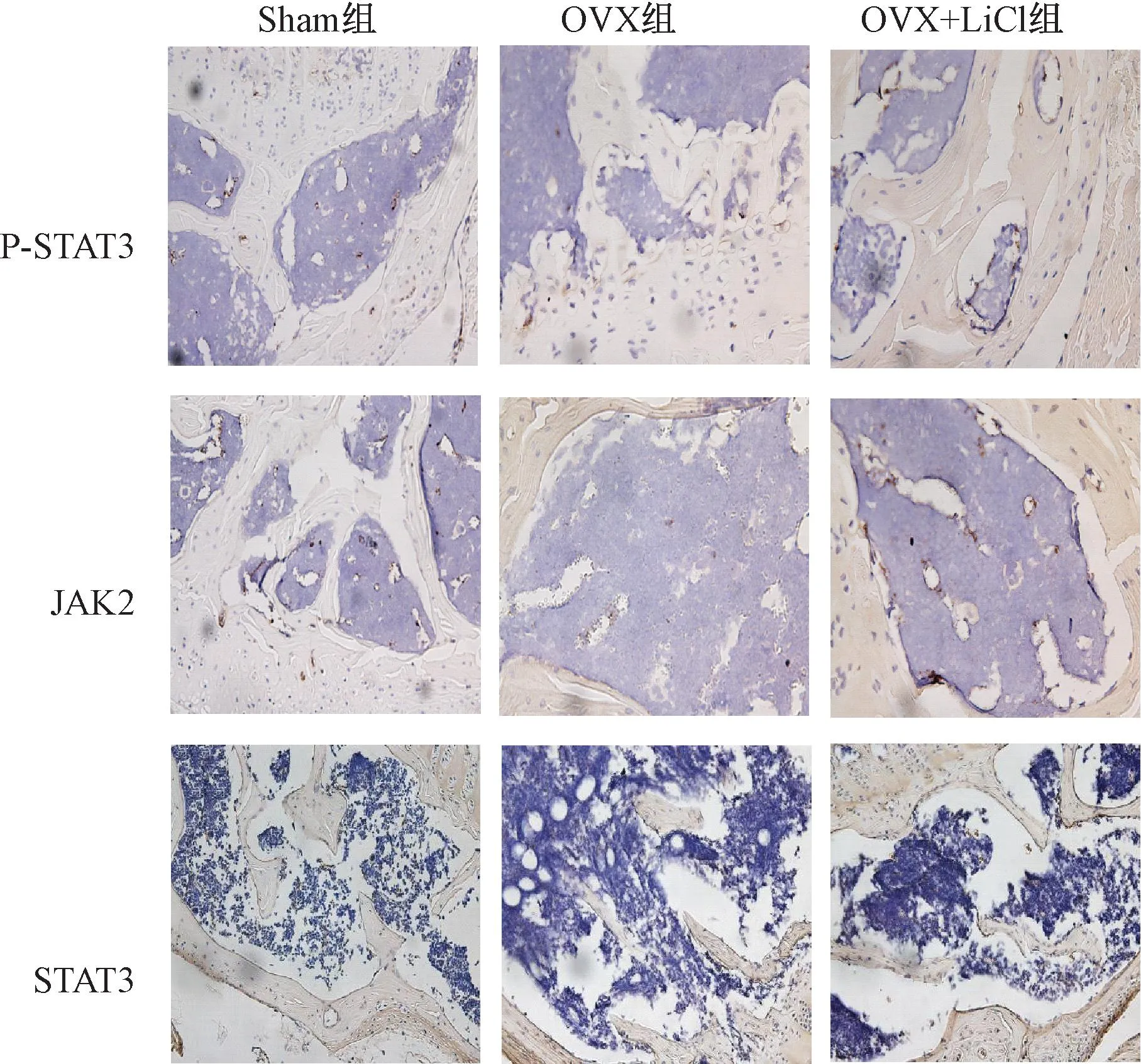
图2 干预2个月后各组P-STAT3、JAK2、STAT3蛋白免疫组织化学染色情况(光镜下400倍放大)Fig.2 Immunohistochemical staining of P-STAT3, JAK2, and STAT3 proteins in three groups after 2 months of intervention (scale bar: 400× magnification)
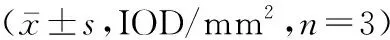
表4 干预2个月后各组P-STAT3、JAK2、STAT3蛋白表达情况Table 4 Protein levels of P-STAT3, JAK2, and STAT3 in three groups after 2 months of intervention IOD/mm2, n=3)
2.4 LiCl增强OB增殖能力
在第3、5天,2.5 mmol/L LiCl组的OB增殖显著高于Control组(P<0.05)。而每个时间点5 mmol/L LiCl组的OB增殖显著高于Control组(P<0.05),故后续实验LiCl浓度均为5 mmol/L。见表5。
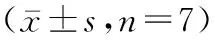
表5 各组LiCl增强OB增殖能力Table 5 Lithium chloride enhances the proliferation of osteoblasts in each group n=7)
2.5 LiCl增强OB分化能力
LiCl组的ALP活性显著升高,与Control组比较,差异有统计学意义(P<0.05),见图3、表6。LiCl组的茜素红染色可见红色矿化钙结节形成,LiCl组的红色矿化结节较多,而Control组只可见少量矿化结节,见图4、表6。
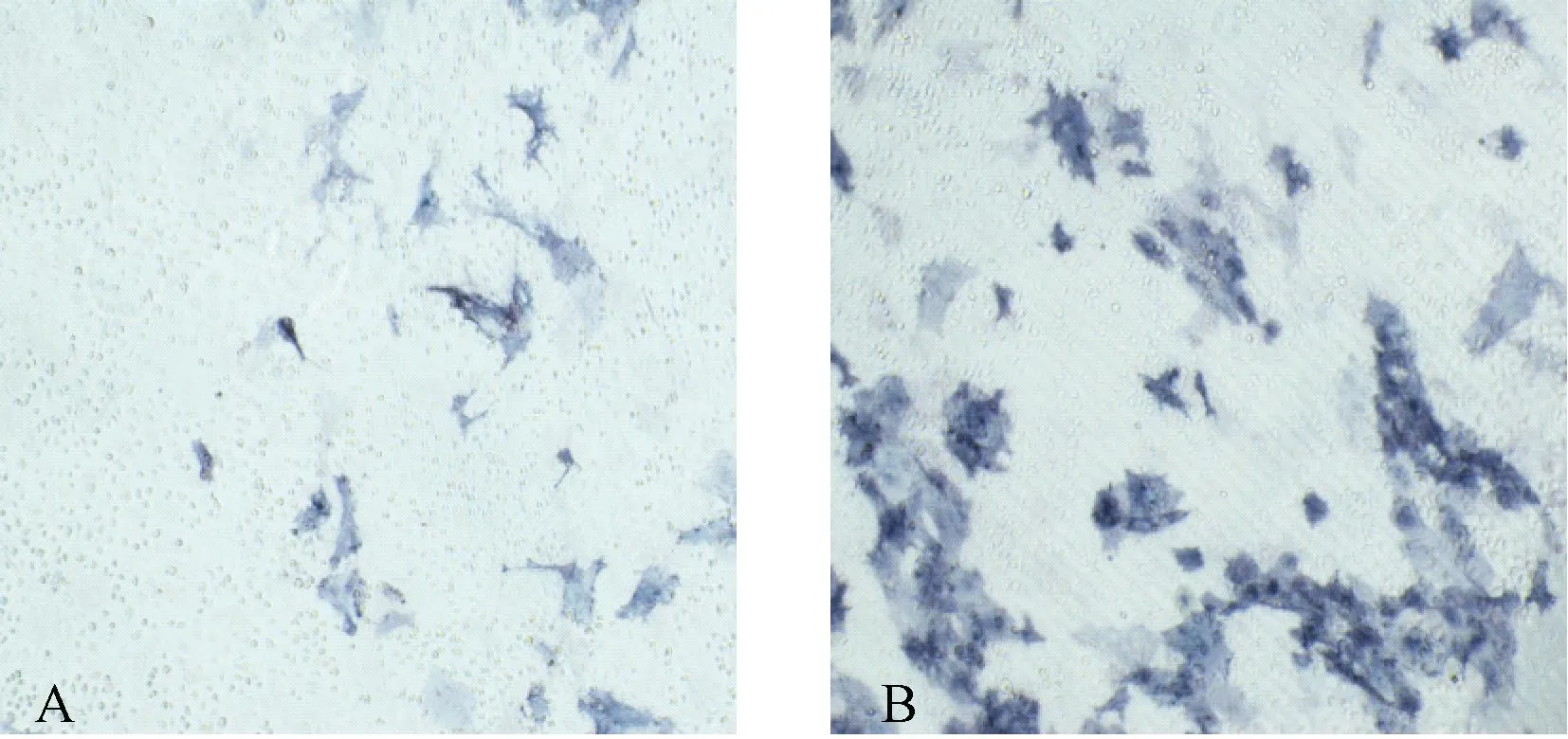
图3 两组OB细胞ALP染色情况(光镜下100倍放大)注:A:Control组;B:LiCl组。Fig.3 Results of ALP staining of OB in two groups (scale bar: 100× magnification)A: Control group; B: LiCl group.
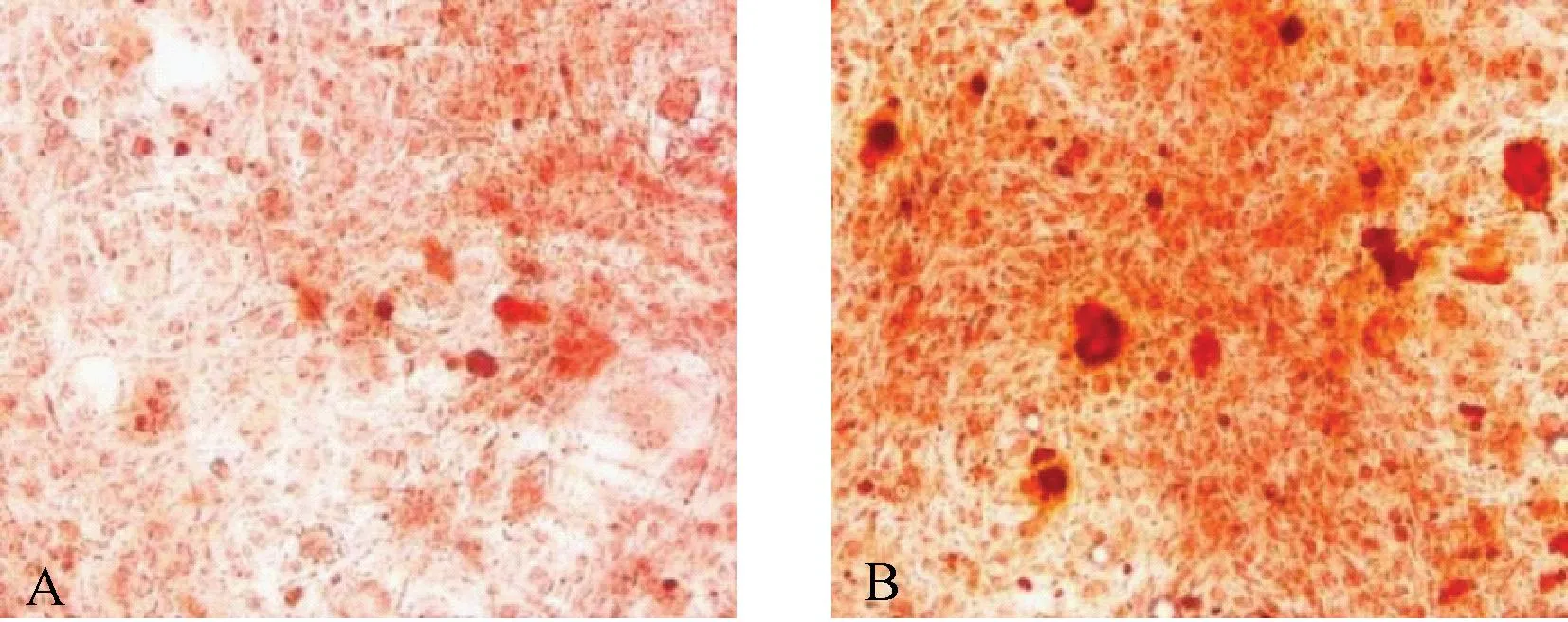
图4 两组OB茜素红染色结果(光镜下100倍放大)注:A:Control组;B:LiCl组。Fig.4 Results of Alizarin red staining of OB in two groups (Scale bar: 100× magnification)A: Control group; B: LiCl group.

表6 各组LiCl增强OB分化能力Table 6 Lithium chloride enhances the differentiation of osteoblasts in each group n=3)
2.6 STAT3和OCN mRNA水平检测结果
用LiCl干预OB 7 d,与Control组相比,LiCl组的STAT3 mRNA和OCN mRNA表达显著升高,差异有统计学意义(P<0.05)。见表7。
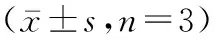
表7 各组OB中STAT3 mRNA和OCN mRNA水平检测结果Table 7 The results of STAT3 mRNA and OCN mRNA levels n=3)
3 讨论
OP的重要危险因素包括抑郁症,与健康者相比,绝经后女性精神障碍患者BMD显著降低[12-13]。研究表明,LiCl治疗精神障碍患者的同时,其骨量增加,骨转化率降低[14]。JAK/STAT3信号通路激活可以逆转OVX小鼠的骨丢失[15]。初步探讨LiCl对JAK/STAT3信号通路的作用,可以更深入地研究LiCl的作用机制,使其更好地应用于临床,在治疗精神障碍疾病的同时亦可预防OP发生。
Micro-CT的指标能够间接反映骨代谢状况,是皮质骨和松质骨骨量评价常用的指标[16-18]。本实验Micro-CT的结果显示,OVX+LiCl组相较于OVX组BV/TV增加,Tb.Sp降低,说明LiCl干预后BV/TV升高,Tb.Sp降低,OP程度有较明显改善。但在Bai等[19]的研究中,LiCl对Tb.N、Tb.Sp、SMI等参数的改善作用更为显著,这可能和本研究所选用的LiCl的剂量以及实验动物的种属有关。Zhang等[20]认为100 mg/kg的LiCl干预小鼠可以抑制GSK3β的表达,因此本研究选用了该剂量,根据上述结果,100 mg/kg的LiCl可能并非干预小鼠的最适剂量。
皮质骨的结构和材料参数对于骨骼的力学性能更具有决定意义[21]。提高Ct.Po会降低骨强度,Ct.Po增加4%可导致骨裂隙提高84%[22]。而Ct.Po从4%升高到10%会使骨静态压缩载荷下降50%[23]。Ct.Po从4%升高到20%时,未产生裂隙前的骨应力会降低3倍[24]。本实验OVX+LiCl组同OVX组相比,Ct.Po显著降低,而生物力学的最大载荷和最大应力均明显升高,说明Ct.Po降低时生物力学的最大载荷和最大应力会显著升高,这表明LiCl对OP的皮质骨的骨重建是有一定疗效的,而Sham组和OVX组相比,无显著差异的原因可能和不同状态下骨组织的结构及代谢调节机制有关。
利拉鲁肽通过活化STAT3对糖尿病骨质疏松大鼠骨代谢产生正向作用[25]。也有研究认为JAK2/STAT3信号通路对OP的作用是负向的,JAK2/STAT3信号途径可以降低BMD,抑制骨小梁形成从而促进OP的发生[26]。有文献提出,LiCl降低了P-STAT3的表达,从而抑制了STAT3的活性[27]。在本研究中,免疫组织化学分析发现,OVX+LiCl组JAK2、p-STAT3、STAT3蛋白表达较OVX组显著升高,表明LiCl对OVX小鼠骨丢失的抑制作用可能与其对JAK2/STAT3信号通路的调控有关,但该信号通路在此过程中是否发挥关键作用尚有待进一步实验证实。
此外,观察不同浓度LiCl干预相同时间后OB活性的变化,结果显示LiCl在2.5、5 mmol/L浓度对OB的生长均有不同程度的促进作用,随着干预浓度的增加,OB活性相较于空白组降低,10 mmol/L对OB生长的促进作用最弱,但仍然对OB存在促进增殖的效果。这一结果同Laiuppa等[28]发现在体外环境培养下,低浓度LiCl可以促进大鼠脂肪干细胞增殖类似,证实在一定剂量范围内,LiCl以剂量依赖的方式促进OB增殖。
OB是骨形成的主要功能细胞,负责细胞外基质的合成、分泌和矿化[29-30]。因此,本实验通过ALP和茜素红染色评估LiCl对OB 功能的影响,证明LiCl能增强ALP的活性和表达以及促进矿化结节的产生。OCN mRNA的转录和蛋白合成是OB分化成熟进入矿化期的主要指征之一[31]。本实验LiCl处理OB培养7 d后,LiCl组OB中OCN mRNA表达升高,表明LiCl能促进OB中OCN的表达。此外,LiCl干预7 d后,OB中STAT3 mRNA表达显著高于对照组,提示LiCl可以对OB中的STAT3基因起到促进作用,以上结果和Shi等[32]的研究LiCl能够调节miR-337对STAT3的抑制效果类似。
本研究结果表明LiCl尚未达到最适剂量,然而LiCl治疗量与中毒量很接近,当血锂浓度过高时可能诱发中毒反应,选择恰当剂量的LiCl既能达到治疗效果又可避免中毒反应,对于公共卫生预防和临床应用仍是需要进一步探讨的话题。
综上,LiCl通过调控OB改善OVX小鼠骨量和骨微结构,其机制可能与调节JAK/STAT3信号通路有关,但该信号通路在其中是否发挥关键作用,LiCl对骨代谢尤其是OB功能的影响是否有其他信号通路的参与,仍有待进一步研究。

