左归丸上调ALKBH5对小鼠BMSCs成骨分化的作用
刘慧雯 刘昊 尚奇 陈桂锋 陈弘林 伍子贤 余富勇 颜先伟 秦威城 沈耿杨 任辉* 江晓兵*
1.广州中医药大学,广东 广州 510405 2.广州中医药大学岭南医学研究中心,广东 广州 510405 3.黔西南州中医医院,贵州 黔西南州 562499 4.广州医科大学附属第二医院,广东 广州 510260
骨髓来源的间充质干细胞(bone marrow mesenchymal stem cells,BMSCs)是多功能祖细胞,可以自我更新并分化成不同的细胞谱系包括成骨细胞、软骨细胞和脂肪细胞发挥功能[1],关于BMSCs分化方向的调控一直以来都是骨修复研究的热点。烷基化修复同系蛋白5(ALKBH5)是一种关键的RNA去甲基化酶,现有对 ALKBH5影响成骨分化的机制研究结论不一[2-3],其作用仍存在争议。左归丸出自《景岳全书》,是滋阴补肾、益精填髓的代表方药。现有研究表明,左归丸能够改善年龄相关性骨质流失,在参与骨形成、促进骨修复方面具有一定的潜能[4-5],然其在细胞和分子水平上的作用机制尚未完全阐明。左归丸对ALKBH5的影响尚不明确。因此,本研究拟从去甲基化酶ALKBH5探讨左归丸对小鼠BMSCs成骨分化的作用,以期为左归丸应用于临床防治骨质疏松症提供一定的理论依据。
1 材料与方法
1.1 实验动物
2月龄C57BL/6小鼠22只,SPF级,体重20~25 g,雌性,由广州中医药大学实验动物中心提供[动物使用许可证号SYXK(粤)2018-0092]。
1.2 实验药物
左归丸(熟地黄24 g、山药12 g、枸杞子12 g、山萸肉12 g、川牛膝9 g、菟丝子12 g、鹿角胶12 g、龟甲胶12 g,参考《药典2020》标准),药物均购于广州中医药大学第一附属医院。
1.3 主要试剂及仪器
β-甘油磷酸钠(BGP)(Merck公司,G9244-50G),维生素C(Solarbio公司,A8100),胎牛血清(Cyagen公司,FBSAD-01011-500),地塞米松(Aladdin公司,50-02-2D),α-MEM培养基(Servicebio公司,G4551-500),BCIP/NBT碱性磷酸酶显色试剂盒(Beyotime公司,C3206),茜素红染色液(Cyagen公司,ALIR-10001),RT-qPCR试剂盒(TAKARA公司,RR420 L),EvoM-mLV反转录试剂(艾科瑞公司,AG11706),RIPA裂解液(Solarbio公司,R0020),siRNA(锐博生物公司,siG2207050849395006)、riboFECTTMCP Transfection Kit(166T)(锐博生物公司,C10511-05)、ALKBH5抗体(Affinity公司,DF2585),BMP4抗体(Abcam公司,ab39973),RUNX2抗体(CST公司,12556),BMP2抗体(Abcam公司,ab14933),HRP羊抗兔IgG(Affinity公司,S0001)、HRP羊抗鼠IgG(Affinity公司,S0002),全波长酶标仪、超净工作台、CO2细胞培养箱(美国Therom公司)、Western blot电泳转膜系统(美国Bio-Rad公司)、实时荧光定量PCR仪(美国Bio-Rad公司,CFX96型)。
1.4 实验方法
1.4.1药物制备:左归丸:熟地、山药、枸杞子、山萸肉、川牛膝、菟丝子煎煮、过滤、浓缩至5000 mL时加入鹿角胶和龟胶烊化,液氮冷冻、冻干机-50℃干燥、粉碎后低温干燥保存冻干粉。将左归丸冻干粉用PBS溶解,过滤备用。成骨诱导液:维生素C:88.6 mg+10 mL PBS;BGP:4.32 g+10 mL PBS;地塞米松:19.623 mg+10 mL无水乙醇。-20℃保存。过滤备用,使用时终浓度:维生素C:8.86 μg/mL,BGP:4.32μg/mL,地塞米松:0.196 μg/mL。
1.4.2细胞提取与培养:BMSCs分离、培养和传代 2月龄C57BL/6小鼠2只,脱颈椎处死后置于75%乙醇中5 min,分离双下肢股骨和胫骨,无菌条件下暴露骨髓腔,用完全培养基冲洗骨髓腔,随后将冲洗液轻轻吹打混匀,无菌培养瓶中培养,置于37℃、5%CO2细胞培养箱中,待生长至80%融合度时进行传代。细胞传至第3代时铺板,进行后续干预。
1.4.3细胞转染:采用设计合成的siRNA转染小鼠BMSCs,以1.5×104个/cm2的密度将小鼠BMSCs接种于6孔板中,待6孔板内的细胞融合度达30%~50%时开始转染。以riboFECTTMCP Reagent 转染siRNA于6孔板。配制转染复合物,过程中轻轻混匀,室温孵育0~15 min。将转染复合物逐滴加入适量无双抗的成骨诱导培养基中轻轻混匀。细胞置于37℃、5%CO2培养箱中培养48 h后通过RT-qPCR法检测其沉默效率。按相同操作构建空载体转染的对照组(si-NC),ALKBH5沉默成功后,应用左归丸混悬液(1000 μg/mL)干预。
1.4.4ALP与ARS染色:将小鼠BMSCs按6000个/mL种入48孔板中。①用配置好的成骨诱导培养基分别干预0、3、7 d;②对照组用含10%FBS的α-MEM完全培养基进行干预,实验组细胞加入1000 μg/mL浓度的左归丸混悬液进行干预,放置于恒温培养箱中7 d。③细胞分组:对照组(si-NC)、左归丸组(si-NC+ZGW)、沉默组(si-ALKBH5)、沉默+左归丸组(si-ALKBH5+ZGW)。对对数生长期的细胞进行siALKBH5转染,构建ALKBH5沉默的小鼠BMSCs,同时构建空载体转染对照组,左归丸混悬液(1000 μg/mL)在转染48 h后加入,放置于恒温培养箱中3 d。准备染色时,PBS轻柔洗涤,4%多聚甲醛固定、PBS洗板,将孔板置于室温中分别以ALP染色液和茜素红染色液染色,PBS洗涤3次。染色后用扫描仪拍摄。
1.4.5RT-qPCR检测:①成骨诱导培养基干预小鼠BMSCs 0、3、7 d;②参照1.4.3分别用si-ALKBH5和si-NC转染细胞48 h。上述样本用Trizol法提取BMSCs的RNA。测量RNA浓度,-80℃保存。将提取的RNA样品按1 μg/20μL体系配制反应溶液,反转录得到cDNA模板。12.5 μL/孔TB Green Premix Ex Taq(2×)及2 μL/孔cDNA,上、下游引物各0.5 μL,并参照25 μL体系配平后按SYBR法开始RT-qPCR反应程序。引物由生工生物工程股份有限公司合成,引物序列见表1。
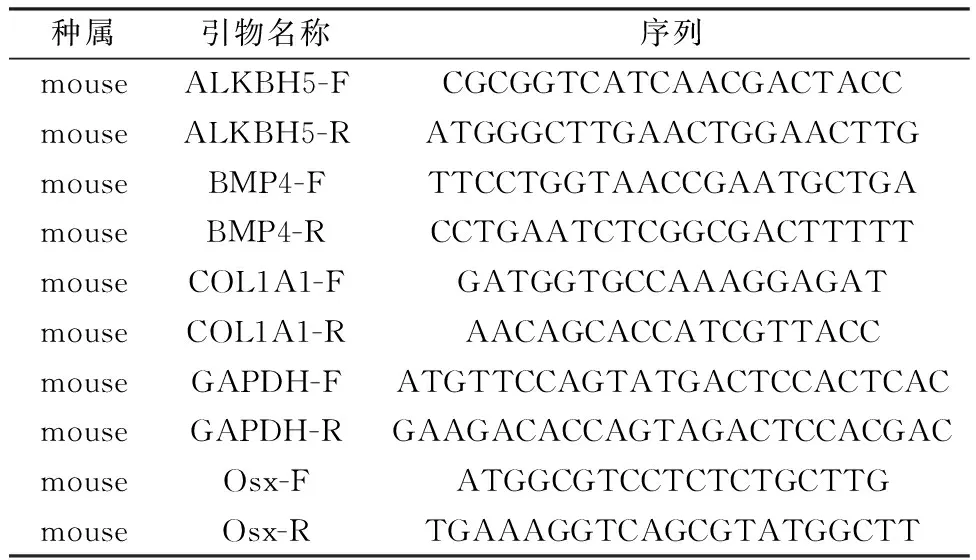
表1 RT-qPCR引物序列Table 1 Primer sequence of RT-qPCR
1.4.6Western-blotting(WB)检测:①成骨诱导培养基干预小鼠BMSCs 0、3、7 d,检测各组ALKBH5、BMP4蛋白表达。②空白组BMSCs不做处理,药物组用左归丸混悬液(1000 μg/mL)干预7 d,检测两组ALKBH5、Runx2蛋白表达。③将细胞随机分为对照组(si-NC)、左归丸组(si-NC+ZGW)、沉默组(si-ALKBH5)、沉默+左归丸组(si-ALKBH5+ZGW),参照1.4.3分别用si-ALKBH5和si-NC转染细胞48 h,而后用左归丸混悬液(1000 μg/mL)干预3 d,检测各组ALKBH5、BMP2蛋白表达。裂解细胞提取蛋白,BCA法测定浓度。加入5×loading buffer,100℃变性10 min,上样。电泳、转膜、封闭、洗膜。一抗4℃孵育过夜,室温下二抗孵育1 h,洗膜,最后显影分析。
1.5 统计学处理
采用Graphpad Prism 8.0统计软件对本研究数据进行分析。本研究数据均为计量资料,实验数据以均数±标准差表示,各组间比较应用独立样本t检验分析,P<0.05为差异具有统计学意义。
2 结果
2.1 小鼠BMSCs成骨分化过程中ALKBH5的表达
ALP染色结果显示,随着时间延长,ALP染色逐渐深染,成骨诱导液成功诱导mBMSCs成骨分化。见图1。
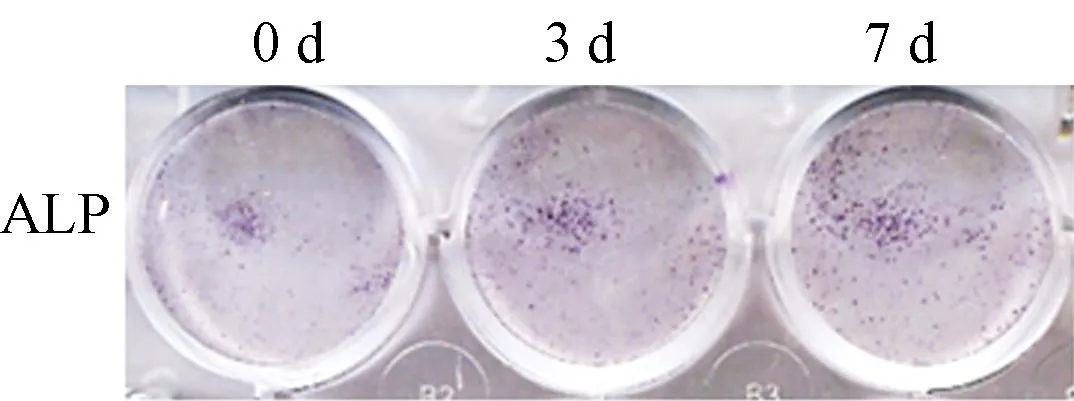
图1 成骨诱导条件下ALP染色结果的变化Fig.1 Changes of ALP staining after osteogenic stimulation
RT-qPCR结果显示,与0 d相比,成骨诱导3 d的 BMSCs COL1A1 mRNA表达上调(P<0.001),成骨诱导7 d的 BMSCs ALKBH5、COL1A1、BMP4 mRNA表达均上调(P<0.01),说明成骨分化过程中,ALKBH5 mRNA的表达上调。见图2。
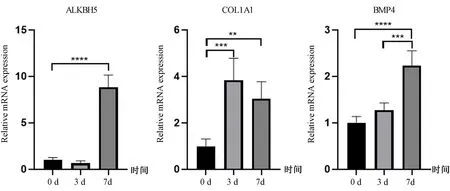
图2 成骨诱导条件下成骨相关基因和ALKBH5 mRNA表达的变化Fig.2 The mRNA expression changes of osteogenesis-related genes and ALKBH5 after osteogenic stimulation注: **P<0.01,***P<0.001,****P<0.0001。
WB结果显示,与0 d相比,成骨诱导3、7 d后ALKBH5、BMP4的蛋白表达水平均上调,说明成骨分化过程ALKBH5的蛋白表达水平逐渐上调。见图3。
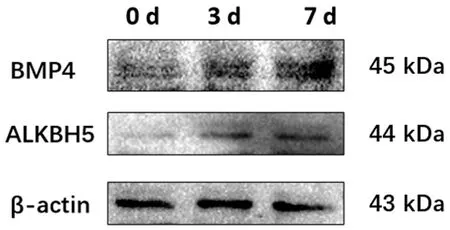
图3 成骨诱导条件下成骨标志物和ALKBH5的蛋白表达的变化Fig.3 The protein expression changes of osteogenic markers and ALKBH5 after osteogenic stimulation
2.2 左归丸对小鼠BMSCs成骨分化及ALKBH5的调控作用
ALP染色结果显示,与对照组相比,左归丸组的ALP染色阳性率显著升高,颜色深染;ARS染色结果显示,左归丸组的ARS染色阳性率明显高于空白组,矿化结节明显增多。说明左归丸能够增加小鼠BMSCs成骨分化能力和矿化能力。见图4。
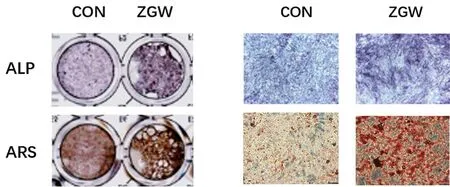
图4 ALP和ARS染色评估左归丸干预对BMSCs成骨分化的影响Fig.4 Effects of ZGW on the osteoblast differentiation ability of BMSCs by ALP staining and ARS staining注:右为×100镜下图。
WB结果显示,与对照组相比,左归丸组的ALKBH5、Runx2的蛋白表达水平均上调(P<0.05),说明左归丸能够上调ALKBH5的表达,促进成骨分化。见图5。
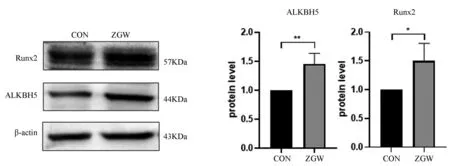
图5 左归丸干预对成骨标志物和ALKBH5的蛋白表达的影响Fig.5 Effects of ZGW on the protein expression of osteogenic markers and ALKBH5注:*P<0.05,**P<0.01。
2.3 小鼠BMSCs沉默ALKBH5后对成骨分化的影响及左归丸的干预作用
2.3.1小鼠BMSCs沉默ALKBH5的鉴定及成骨相关因子的表达变化:RT-qPCR结果显示,与对照组相比,沉默组ALKBH5表达下调(P<0.01),沉默效率约为50%,同时成骨分化相关因子Osx、Runx2均表达下调(P<0.05)。见图6。
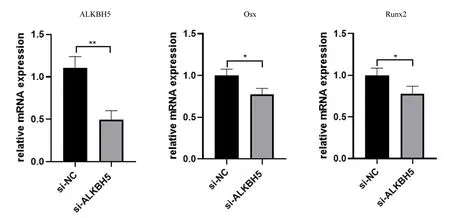
图6 siALKBH5沉默效率及ALKBH5沉默后成骨相关因子的变化Fig.6 Efficacy of siALKBH5 knockdowm and the expression of osteogenesis-related genes changes after ALKBH5 knockdown注:*P<0.05,**P<0.01。
2.3.2小鼠BMSCs沉默ALKBH5后左归丸的干预作用:WB结果显示,与对照组(si-NC组)相比,左归丸组(si-NC+ZGW组)上调ALKBH5(P<0.001)、成骨标志物Runx2(P<0.01)、BMP2(P<0.01)的蛋白表达;沉默组(si-ALKBH5)相较于对照组ALKBH5(P<0.01)蛋白表达下调,Runx2(P<0.05)、BMP2(P<0.05)的蛋白表达相应下调,ALKBH5沉默+左归丸组(si-ALKBH5+ZGW组)相较于沉默组则又上调了ALKBH5(P<0.001)的蛋白表达,逆转了沉默组Runx2(P<0.05)、BMP2(P<0.05)的蛋白表达下调。说明左归丸能够促进ALKBH5的蛋白表达,促进成骨分化相关蛋白Runx2和BMP2的表达,将ALKBH5敲降后,成骨分化相关蛋白Runx2和BMP2表达减少,左归丸干预能够上调ALKBH5的表达,逆转ALKBH5敲降后Runx2和BMP2表达下调。见图7。ALP染色结果显示,与对照组相比,左归丸组染色阳性率显著升高,颜色深染。沉默组染色阳性率较对照组下降,染色变浅,左归丸干预后染色阳性率明显升高。说明左归丸能够促进小鼠BMSCs成骨分化;将ALKBH5沉默后,小鼠BMSCs成骨分化能力下降,在此基础上加入左归丸能够抑制小鼠BMSCs的成骨分化能力下降。见图8。
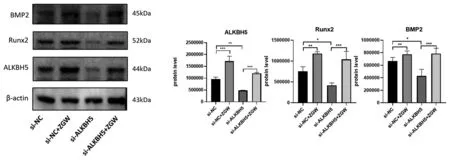
图7 ALKBH5敲降后左归丸干预对成骨标志物和ALKBH5蛋白表达的影响Fig.7 Effects of ZGW on the protein expression of osteogenic markers and ALKBH5 after ALKBH5 knockdown注:*P<0.05,**P<0.01,***P<0.001。
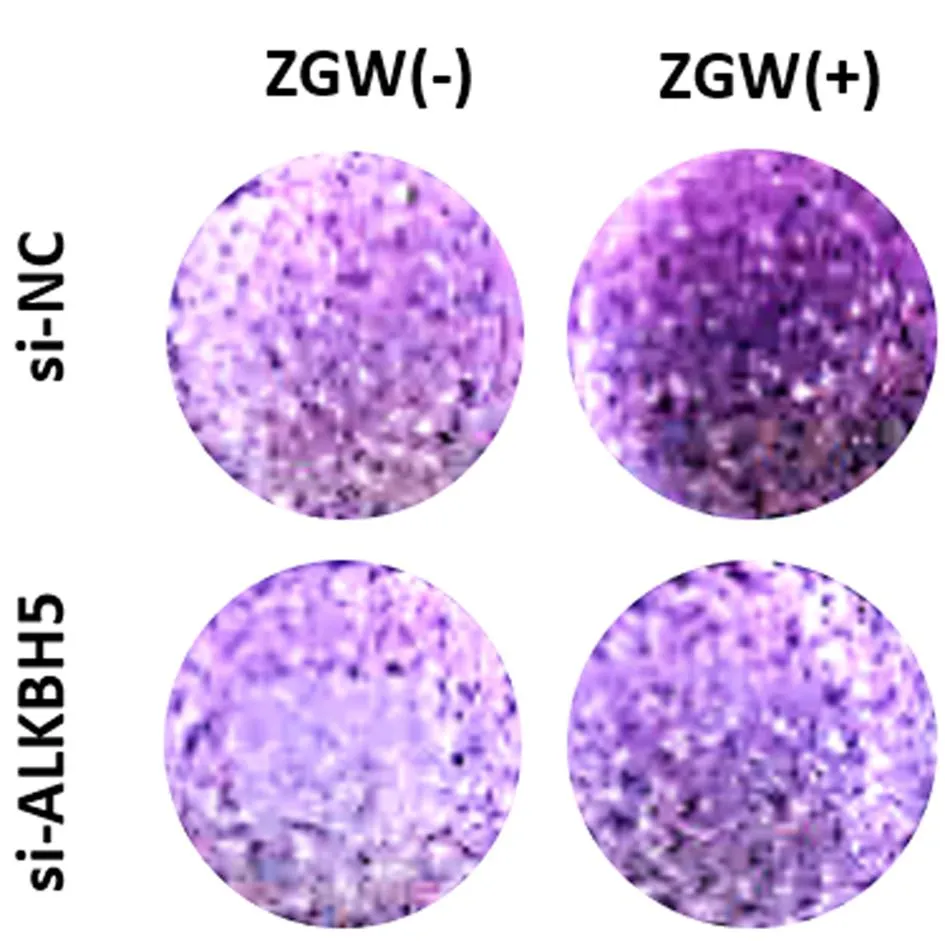
图8 ALP染色评估ALKBH5沉默后左归丸干预对小鼠BMSCs成骨分化的影响Fig.8 Effects of ZGW on the osteoblast differentiation ability of mouse BMSCs after ALKBH5 knockdown with ALP staining注:“-”代表无,“+”代表有。
3 讨论
负责骨形成的成骨细胞长期以来一直被认为是治疗骨质疏松症或者骨质疏松骨折修复等骨病的重要媒介[6-7]。而BMSCs不仅能够分化为成骨细胞,且能一定程度上维系其寿命,参与到骨组织的生长和修复过程中来,维持骨稳态[8]。BMSCs的成骨分化过程包括一系列事件。祖细胞经历连续的分化阶段,增殖潜力降低,从而产生前成骨细胞。随后,成骨细胞前分化为成熟的成骨细胞,沉积形成骨基质所需的成分,然后矿化。最终,成熟的矿化成骨细胞嵌入新分泌的骨基质中,并进行终末分化以形成骨细胞[9]。分化过程中伴随着碱性磷酸酶(ALP)活性的增加[10]。其他成骨标志物如Runt相关转录因子2(Runx2)[11]、成骨细胞特异性转录因子Osx[12]、α1-1型胶原基因(COL1A1)[13]、骨形态发生蛋白4[14]、骨形态发生蛋白2[15]也在成骨分化过程中逐渐表达上调。
m6A是真核生物体内一种动态可逆的RNA修饰,主要受甲基化转移酶“writer”、去甲基化酶“eraser”调控,结合蛋白“reader”识别其作用[16]。ALKBH5作为重要的去甲基化酶之一,可通过调控mRNA稳定性影响成骨分化,但存在积极作用、消极作用两种结果。Yu等[17]研究发现,ALKBH5可以逆转甲基化转移酶METTL3激活NF-κB通路产生的成骨抑制作用;Feng等[18]研究发现,ALKBH5 mRNA和蛋白质表达在成骨细胞分化过程中上调,并且ALKBH5沉默后成骨细胞分化收到抑制,矿化和成骨生物标志物的表达。本文通过在成骨诱导条件下检测ALKBH5和成骨标志物的mRNA和蛋白表达水平,发现在第7天时成骨标志物表达上调,此时ALKBH5表达明显上调。为进一步明确ALKBH5在小鼠BMSCs成骨分化过程中的作用,作者应用细胞转染技术将BMSCs中的ALKBH5敲降,发现ALKBH5敲降后成骨生物标志物的表达下调,成骨细胞分化能力下降,又一次证实ALKBH5在小鼠BMSCs成骨分化过程中起着正向调控作用。
左归丸出自《景岳全书》卷五十一,为补益剂,具有壮水之主,培肾之元阴之功效。关于左归丸促进BMSCs的成骨分化治疗骨质疏松症的作用虽已多次得到证实[19-20],其作用机制大部分是关于 Wnt/β-catenin、AMPK/mTOR等信号通路的研究,目前关于左归丸通过调控RNA修饰影响小鼠BMSCs成骨分化的研究尚无文献报道。本课题组前期研究发现[21],左归丸可以通过激活let-7f抑制自噬来促进BMSC的成骨分化,从而改善糖皮质激素导致的激素性骨质疏松。其中,左归丸的最佳干预浓度为1000 μg/mL。因此,本研究在此基础上采用1000 μg/mL的左归丸混悬液干预小鼠BMSCs,研究去甲基化酶ALKBH5在其成骨分化过程中的作用机制。研究表明左归丸促进成骨分化过程中,ALKBH5表达上调,为进一步证实左归丸通过上调ALKBH5对小鼠BMSCs成骨分化产生影响,作者对ALKBH5沉默的小鼠BMSCs加入左归丸干预,结果表明左归丸能够逆转ALKBH5沉默导致的小鼠BMSCs成骨分化能力下降。
综上所述,本研究证实左归丸能够促进小鼠BMSCs的成骨分化,并发现上调去甲基化酶ALKBH5的表达可能是其发挥作用的机制之一。然而,本研究尚存在不足,尚未明确左归丸通过上调ALKBH5的去甲基化作用影响调控的mRNA,下一步将继续进行研究。

