骨小梁评分结合骨密度用于骨质疏松诊疗及骨折风险预测
李黎 唐魁韩 王荣 黄华 陈静 曾进海 宋红
北京积水潭医院贵州医院骨内科,贵州 贵阳 550000
骨质疏松(osteoporosis,OP)是最常见的骨骼疾病,作为一种全身性骨代谢病其特征是低骨量和骨组织微结构损坏,从而导致骨脆性增加和易发生骨折[1],影响患者的生活质量。双能X线吸收检测法(dual energy X-ray absorptiometry,DXA)测量的骨密度(bone mineral density,BMD)是世界公认的诊断骨质疏松的金标准,骨量正常:T≥-1.0;骨量减少:-2.5 骨折风险预测工具(fracture risk assessment tool,FRAX)基于来自国外等多个独立大样本前瞻性人群研究和大样本的荟萃分析,针对我国骨质疏松性骨折发病率及其影响因素的大样本流行病学研究正在进行中,初步研究提示目前FRAX预测结果可能低估了中国人群的骨折风险[2]。目前国内使用的GE Lunar双能X线骨密度仪遵循我国骨质疏松症诊疗指南并采用中国人数据库计算T值,能准确诊断中国人群骨质疏松以及评估骨折风险[3],GE Lunar双能X线骨密度仪测量BMD以及骨小梁评分(trabecular bone score,TBS),其中TBS是一种对腰椎DXA获得的图像进行不同于BMD的灰阶纹理分析方法,获取与骨小梁微结构相关的信息,从而对骨折风险进行独立的预测。临床中将TBS、BMD与风险预测工具相结合,可用于调整骨折风险评分并评估脆性骨折风险,对于判断是否需要早期开展抗骨质疏松治疗,以及骨质疏松脆性骨折的预防及诊疗有一定价值。基于不同的TBS阈值可判断不同的骨小梁受损程度及骨折风险[4],骨折低风险(骨微结构正常):TBS≥1.310;骨折中风险(骨微结构部分受损):1.230 纳入标准:2022年1月17日至2022年8月22日在我院使用GE Lunar双能X线骨密度仪(型号:GE Lunar iDXA)检测的患者,采用骨小梁评分软件TBS(iNsight 3.0.0版本,法国Medimaps公司)进行评分。本研究经过本院伦理委员会审查通过(批件号:LW20230423)。 排除标准:①患有急性感染性疾病、自身免疫性疾病(类风湿关节炎除外)、具有遗传性疾病史、急性创伤者;②长期使用肾上腺皮质素以及进行过其他影响骨代谢激素替代治疗的患者;③患有慢性和严重的血液疾病患者;④合并肾病、肝病、营养不良、甲状旁腺疾病、甲状腺功能亢进、垂体功能异常、强直性脊柱炎、Paget’s骨病、肿瘤、非创伤性骨折患者及长期卧床者。 收集性别、年龄、身高、体重等一般资料,记录患者入院时体质量指数(body mass index,BMI)。根据《原发性骨质疏松症诊疗指南(2017)》诊断标准,50岁以上男性及绝经后女性根据L1-L4椎体骨密度水平平均T值,分为骨量正常、骨量减少、骨质疏松,50岁以下及绝经前女性根据L1-L4骨密度水平平均Z值(Z值≤-2.0视为“低于同年龄段预期范围”或“低骨量”),分为骨量正常和低骨量。观察50岁以下男性及绝经前女性不同骨量患者占比及BMD、TBS数据趋势,将50岁以上男性及绝经后女性患者根据是否发生脆性骨折分为脆性骨折组和非骨折组,探讨其年龄、BMI、BMD、T值及TBS等因素对脆性骨折发生的影响。 采用SPSS 20.0软件进行数据分析。计量资料以均数±标准差表示,组间比较用独立样本t检验,多组间比较采用方差分析;计数资料采用χ2检验。多因素Logistic回归法分析脆性骨折的影响因素。P<0.05为差异有统计学意义。 根据纳入及排除标准,选择3 248人进行数据分析,其中男性877人,女性2 371人。其中50岁以下男性共170人,年龄最大49岁,最小21岁,平均40.77岁,Z值:-2.7~3.5,TBS:1.195~1.624。50岁及以上男性共707人,年龄最大96岁,最小50岁,平均66.4岁,T值:-4.7~6.7,TBS:1.016~1.75。绝经前女性共294人,年龄最大52岁,最小20岁,平均43.56岁,Z值:-3.7~-2.8,TBS:1.129~1.582。绝经后女性共2 077人,年龄最大93岁,最小42岁,平均65.58岁,T值:-6.3~5.1,TBS:0.948~1.557。 50岁以下男性骨量正常占97.06%,其中骨折中风险占8.82%,骨折高风险占8.82%,绝经前女性骨量正常占96.26%,其中骨折中风险占8.50%,骨折高风险占2.38%,BMD及TBS数据相关评分图见图1、2。50岁以上男性脆性骨折66例,非骨折641例,其中两组之间年龄、BMI、BMD、T值及TBS差异均具有统计学意义(P<0.01),绝经后女性患者脆性骨折283例,非骨折1 794例,其中两组之间年龄、BMD、T值及TBS差异均具有统计学意义(P<0.01),BMI差异无统计学意义(P=0.12),见表1、2,其BMD及TBS相关评分图见图3、4。 表1 50岁及以上男性BMD及TBS数据统计Table 1 BMD and TBS data of men over 50 years 表2 绝经后女性BMD及TBS数据统计Table 2 BMD and TBS of postmenopausal 图1 50岁以下男性BMD及TBS数据Fig.1 BMD and TBS data of men under 50 years old注:斜线为趋势线。 图2 绝经前女性BMD及TBS数据Fig.2 BMD and TBS data of premenopausal women注:斜线为趋势线。 图3 50岁及以上男性BMD及TBS数据Fig.3 BMD and TBS data of men over 50 years old注:斜线为趋势线。 图4 绝经后女性BMD及TBS数据Fig.4 BMD and TBS of postmenopausal women注:斜线为趋势线。 针对50岁以上男性及绝经后女性人群,基于Logistic回归分析的诊断性能显示,单因素Logistic分析下BMD和TBS均为脆性骨折的独立预测指标(两者P<0.001),联合BMD和TBS进行多因素Logistic进一步分析发现两者仍具有显著性(两者P<0.001);基于Logistic回归分析的预测概率,对各模型(模型1:单独BMD,模型2:单独TBS,以及模型3:联合BMD+TBS)进行受试者工作特征曲线(ROC)绘制,利用ROC下面积(AUC)表征模型性能,并使用Delong test对各模型下的AUC差异进行检验,结果表明,联合BMD+TBS的AUC最大(0.748,95%CI:0.733~0.763),然后是单独的BMD(0.717,95%CI:0.701~0.732)和单独的TBS(0.685,95%CI:0.668~0.701)。Delong test显示各模型间的AUC差异具有统计学意义(模型1和2的P=0.00157,模型1和模型3的P=0.0005,以及模型2和模型3的P<0.0001),见图5。 图5 50岁以上男性及绝经后女性脆性骨折Logistic回归分析Fig.5 Logistic regression analysis of fragility fracture in men over 50 years old and postmenopausal women 骨质疏松是一个严重的公共卫生问题,随着人口老龄化,其发病率越来越高,骨质疏松脆性骨折是其严重的并发症之一。研究发现仅有不足1/4患有骨质疏松骨折的老年女性进行骨密度测量或抗骨质疏松治疗[5],虽然目前我国主动治疗骨质疏松的人群逐渐增加,但临床就诊的患者多数均为已发生脆性骨折的患者,骨质疏松脆性骨折的风险及其后果没有得到充分的重视,Silverman 等[6]发现仅有35.7%的骨质疏松患者进行为期3年的抗骨质疏松治疗,有超过一半的骨质疏松患者服用抗骨质疏松药物不足1年,该调查还发现单纯补充钙和维生素D对无法改善老年人脆性骨折的发生率[7]。临床中许多骨科医生往往容易忽视骨质疏松的早期诊疗及早期预防,在诊断骨质疏松以及评价疗效大多依据BMD变化以及骨标志物检查,少数会利用QCT进行评价,而世界卫生组织推荐的FRAX预测结果可能低估了中国人群的骨折风险[8-9],从而我国缺乏客观真实的骨折风险预测及评估方法。不同于BMD,TBS测量的是骨小梁微结构,可给出每个椎体的结果,异常的椎体也可从TBS分析中剔除;另外,TBS的计算基于DXA扫描获得的腰椎图像,无需二次扫描因而没有额外的辐射剂量,临床上对于患者的骨微结构和骨折风险评估可带来效益。临床研究显示,结合TBS可以改善骨折的预测性能。多项对绝经后妇女研究的结果证实TBS与BMD是两个互相独立的参数,而TBS已被证实在腰椎骨折的预测作用[10],近期发现TBS还能预测强直性脊柱炎的骨折[11],脆性骨折的发生有时候与BMD并无直接关系,而是与骨微结构有关,即骨密度正常或仅为骨量减少,骨微结构受损或严重受损,也易发生脆性骨折,故对骨折风险的评估不能单纯依靠BMD,应将TBS作为临床上用于骨质疏松患者管理的一个实用工具。 本研究旨在统计BMD及TBS的大概关系,骨质疏松的病理机制包括体内雌激素下降、炎性因子刺激和维生素D和血脂代谢异常等[12],其中体内钙和维生素D缺乏使甲状旁腺激素代偿性分泌从而导致骨溶解增加,同时在炎症因子刺激下可诱导体内破骨细胞增加而增加骨吸收[13],从而容易导致脆性骨折,所以BMD数值越低,骨量丢失越多,其发生脆性骨折的几率越高。本研究中50岁以上男性和绝经后女性BMD与TBS呈正相关,其骨折风险随着骨密度降低而变大,经过统计学分析发现脆性骨折和非骨折患者的年龄、BMD、TBS、T值均存在显著差异,与既往研究相符合。50岁以上男性发生任意部位脆性骨折患者的BMI偏低,而非骨折患者整体BMI偏高,部分达到超重水平,其差异具有统计学意义。在50岁以上女性患者中无论是否发生脆性骨折,其BMI都相对偏高,BMI是否增加能影响骨的强度而影响脆性骨折的发生几率,则需进一步研究分析。然而以上数据趋势图及占比显示即使BMD T值显示骨量正常,TBS显示仍有部分患者的骨微结构受损或高度受损,其中对于骨量减少的患者,尤其是50岁以上男性及绝经后女性,该部分比例更高,分别占58.57%和79.76%,临床中除了骨量以外,高龄、BMI、骨折史和长期糖皮质激素的使用同样也是骨折风险增加的影响因素[14],单独应用BMD并不能很好地预测脆性骨折,故结合BMD与TBS能改善未来发生骨折风险的预测性能,提高对骨折的识别能力[15]。基于Logistic回归分析,本研究发现不仅仅BMD,TBS的增加意味着骨微结构的改善,有利于降低脆性骨折发生风险。TBS作为独立于BMD的预测风险因子,可作为BMD的补充指标,联合TBS和BMD有助于进一步提升骨折风险的预测性能,这对于实际的骨折风险预测和判断能力、甚至诊疗过程都有重要意义。Hans等[16]研究表明联合TBS和BMD可逐步提高绝经后妇女骨折的预测,临床应予以重视联合运用而不应单纯只依赖BMD。以上数据发现在50岁以下男性和绝经前女性的骨质疏松患者中,TBS显示骨折中风险比例偏高,骨折风险并未与骨密度数值直接呈正相关,说明临床中应该同时考虑随雌激素变化及年龄增长而来的一系列病理变化对骨折风险的影响。近期研究发现骨质退变、BMI、女性绝经和男性吸烟与TBS结果有关[17-18]。一项横断面研究也证实,对于骨减少、骨密度水平正常的患者,TBS与椎体骨折显著相关,使用TBS对骨微结构的额外评估能够更好地识别骨折风险[19]。 虽然TBS在骨折风险评价方面优于DXA等检查,但目前没有供临床参考的共识和相关指南,且没有证据显示骨质疏松人群中骨折低风险人群不需要进行抗骨质疏松治疗和预防骨折,弓健等[14]认为虽然TBS可用于评估绝经后糖尿病妇女骨质疏松性骨折的风险,与临床中各种骨脆性相关疾病的骨折风险有关,但仍不建议单独使用TBS来确定治疗决策或方案,不推荐用于50岁以下男性及绝经前女性的骨折预测,且TBS的变化并不能预测开始接受骨质疏松治疗的女性的骨折[20]。故临床使用TBS、BMD和FRAX相结合用于骨质疏松脆性骨折的预测及指导治疗有较大意义,尤其推荐使用于未发生骨折的中老年人群。另外,TBS不受退行性疾病的影响,在骨密度的补充诊断中可以发挥主导作用[21],同时应考虑影响骨代谢相关用药及慢性肾病疾病、类风湿性关节炎、BMI等情况。影响TBS的因素众多,建议开展基于中国种族群体的不同方向的大样本多中心临床研究。本研究将本院数据进行整理分享供临床参考,今后将搜集多中心大样本数据进一步细分,以深入探讨TBS结合BMD在临床中的应用。1 资料与方法
1.1 研究对象
1.2 观察指标
1.3 统计学方法
2 结果
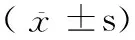
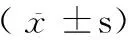
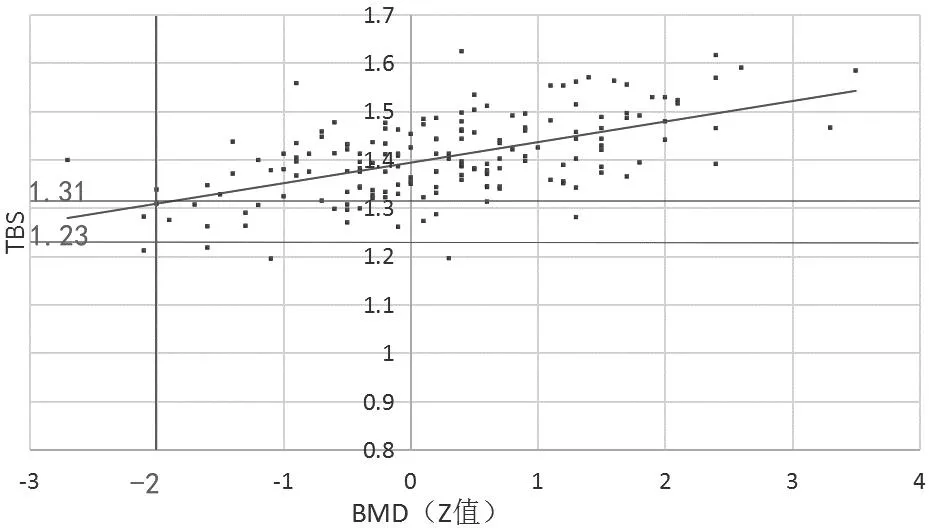
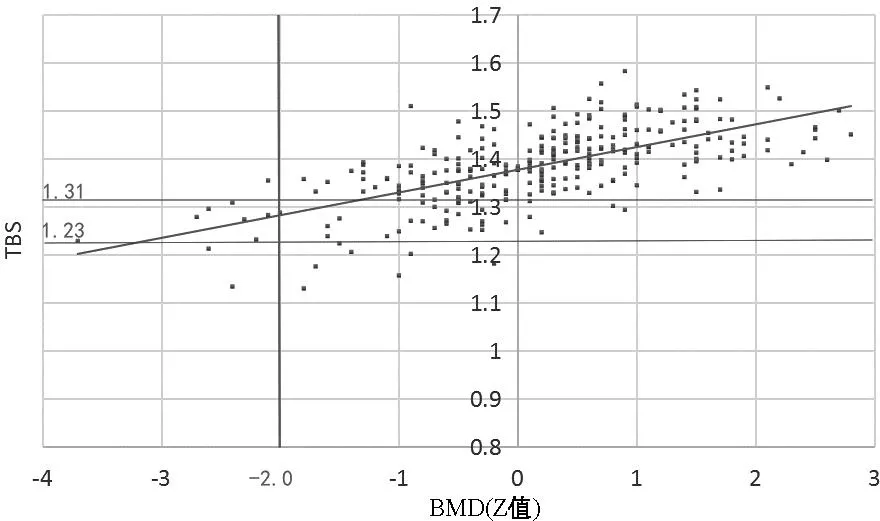
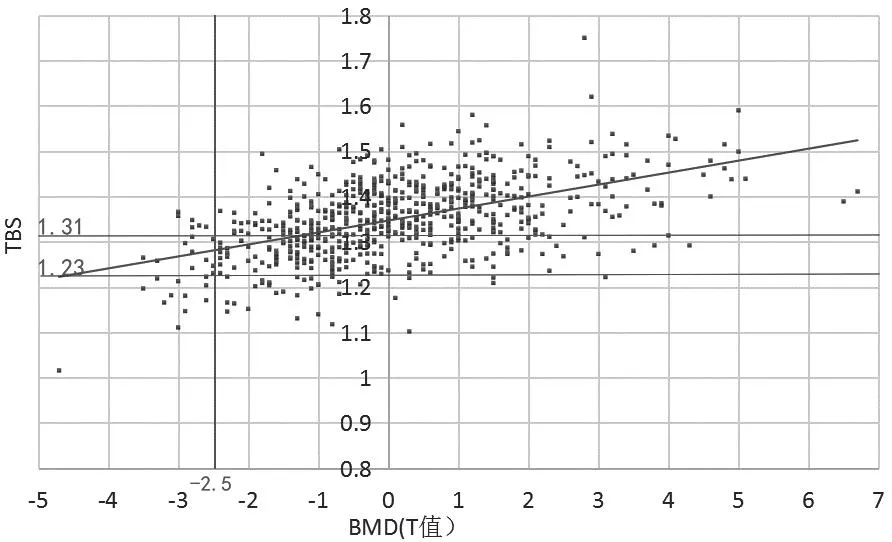
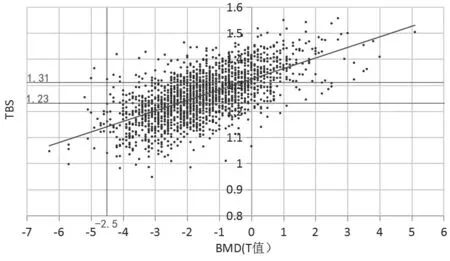
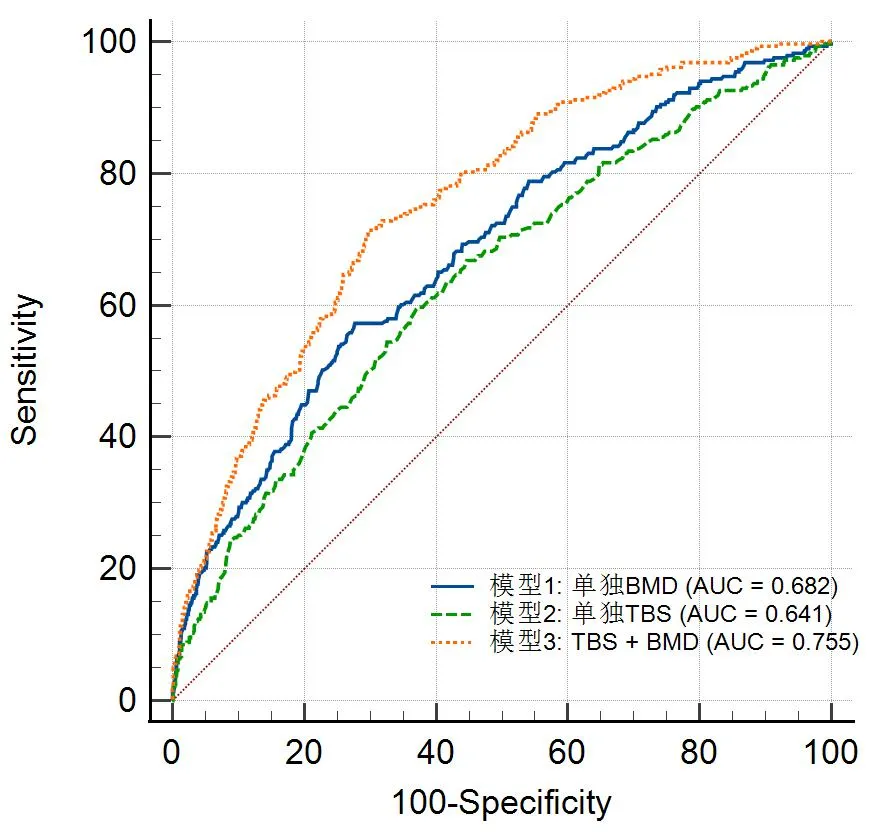
3 讨论

