高温胁迫下刺参H3K9ac特征及HATs、HDACs的表达*
张京京, 徐冬雪, 宋文琦, 夏 斌, 高勤峰**
(1. 海水养殖教育部重点实验室(中国海洋大学), 山东 青岛 266003; 2. 青岛农业大学海洋科学与工程学院, 山东 青岛 266109)
刺参(Apostichopusjaponicus)属于棘皮动物门(Echinodermata)海参纲(Holothuroidea)[1],主要生存于浅海或岩礁底质的沿海、内湾等海域。温度是影响刺参生长与代谢的重要环境因素之一,刺参适宜的生长温度为10~17 ℃。水温高于20 ℃时大部分刺参会逐渐进入夏眠状态,而水温急剧升高时则会出现吐脏、化皮等应激反应,严重时导致死亡[2-4]。刺参是我国海洋农业产业中单种产值高的养殖对象之一,但是近年来频发的夏季高温对刺参养殖产业造成了重大冲击,山东、辽宁等主产地多次出现夏季刺参大面积死亡现象,部分地区死亡率高达60%以上。解析刺参高温胁迫响应的调控机制将为耐高温品种的选育与遗传改良奠定基础。
组蛋白是真核生物染色体的基本结构蛋白,共有H1、H2A、H2B、H3和H4五种类型,其中H2A、H2B、H3和H4为核心组蛋白,聚合组成了组蛋白八聚体,它与DNA相互缠绕组成核小体。组蛋白末端氨基酸可以发生多种修饰,如乙酰化、甲基化、磷酸化和泛素化等,这些修饰模式可作为一种标志或语言,即“组蛋白密码”[5]。组蛋白修饰是可逆的动态变化过程,可影响染色质的结构及DNA的结合能力,从而调控相关基因的转录和表达。看家基因的组蛋白处于相对稳定的状态,而诱导基因的染色质状态会发生修饰变化,这也为组蛋白修饰参与诱导基因的表达调控提供了重要依据[6]。
组蛋白乙酰化修饰是最重要的基因转录表观调控因子之一,主要发生在H3和H4亚基:H3上修饰位点有第4、9、14、18、23和27位赖氨酸残基, H4上修饰位点有第5、8、12和16位赖氨酸残基[5]。研究证明组蛋白通过特定位点的乙酰化修饰参与高温胁迫下基因的转录表达的调控,为深入解析调控基因表达的机制研究带来突破。组蛋白乙酰化修饰对HSP22、HSP26和HSP70等基因的调控作用相继被证实[7-10]。目前大多数研究认为:组蛋白乙酰化可以使其染色质结构变得松散, 有利于转录调控因子、RNA聚合酶等与基因关键作用元件的结合,从而促进基因的转录激活或延伸过程[11-13]。环境胁迫下H3K9的乙酰化水平发生显著变化,是调控基因表达的重要方式之一,其变化由多种组蛋白乙酰转移酶(Histone acetyltransferase, HATs)和去乙酰化酶(Histone deacetylases, HDACs)竞争性作用共同决定,例如:在植核后马氏珠母贝的血细胞组蛋白H3和H4的乙酰化修饰都显著上升[14];玉米幼苗根系在盐度胁迫24 h后H3K9ac显著上升,哺乳动物细胞在低氧胁迫下H3K9ac明显降低[15-16]。在高温胁迫下,H3K9ac也有明显的动态变化,例如短暂的高温胁迫导致的玉米幼苗叶片组织和鸡的脑组织的H3K9ac明显升高[17-18]。本研究分别选取了4种HATs的代表性酶基因和4种HDACs的代表性酶基因作为研究对象。KAT2B(又被称为KAT2A/GCN5)是最受关注的组蛋白乙酰化转移酶之一,其被发现不仅影响组蛋白的乙酰化状态,还可在基因区域被招募富集,调控高温胁迫下基因的转录表达过程[19-20]。KAT5是MYST乙酰转移酶家族中保守且广泛表达的成员,研究发现其在胚胎干细胞(ES)细胞自我更新、DNA损伤修复、转录共活化和组蛋白乙酰化中起着关键作用[21-22]。本研究还挑选了MYST家族的另外两个乙酰转移酶:KAT7和KAT8[23]。KAT7(又被称为MYST2/HBO1)在各种复合物中与其他表观遗传调控因子协同工作,调节细胞的自我更新[23]。KAT8(也称为MOF/MYST1)具有组蛋白和非组蛋白底物,在多种细胞功能中发挥作用[24-25]。HDACs分为四类:HDAC1、2、3和8作为Ⅰ类,HDAC4、5、6、7、9和10作为Ⅱ类,Sirtuin1至7为Ⅲ类,HDAC11为Ⅳ类[26]。SIRT1(Sirtuin1)是一种依赖于烟酰胺腺苷二核苷酸(NAD+)的去乙酰化酶,与酵母细胞中与物质代谢和长寿有关的沉默信息调节因子SIR2同源,与众多基因的转录调控、能量代谢及细胞衰老过程的调节有关[27]。研究发现SIRT1对多种胁迫因子,包括温度、渗透压等都有明显的响应[28-29]。而HDAC1是多种蛋白复合物的催化亚基,参与多种细胞活动[30]。HDAC3参与许多病理过程,具有独特的结构和亚细胞分布特征以及共抑制依赖性[31]。HDAC4作为Ⅱa类HDAC的成员穿梭于细胞核和细胞质之间,是介导多种细胞反应的应激响应因子[32]。
本研究通过Western Blot技术发现刺参H3K9ac水平在高温胁迫下发生了动态变化,并对刺参基因组中ajKAT2B、ajKAT5、ajKAT7、ajKAT8和ajSIRT1、ajHDAC1、ajHDAC3、ajHDAC4基因进行基因结构解析和系统进化树分析;利用qRT-PCR定量研究刺参在高温胁迫0、6、48和96 h后这8个基因的表达变化模式,为深入开展刺参H3K9ac对高温胁迫下基因的转录调控机制研究奠定基础。
1 材料与方法
1.1 样品处理
实验所用刺参于2021年6月采集自山东烟台养殖场,快速转运至实验室暂养。每个养殖缸随机放置6头健康且体质量为(100±10) g的刺参,在温度18 ℃、盐度30的条件下暂养7 d。在此期间,每天过量喂食一次配合饲料,并及时清除残饵和粪便。暂养结束后,参考徐冬雪[33]的实验方法,每组设置8个生物学重复,取第一个养殖缸(水温18 ℃)中的刺参肠道作为对照组,另外3个养殖缸通过快速加热的方式,将水温从18 ℃升至27 ℃,升温速度约为2 ℃/h,而后保持(26±0.5) ℃水温[33-34]。温度升至26 ℃时刻记为0时刻,分别于6、48和96 h取刺参的肠道组织,并及时固定,保存在-80 ℃冰箱中备用。
1.2 H3K9的乙酰化水平(H3K9ac)的相对定量
H3K9ac抗体选用Rabbit Acetyl-Histone H3 (Lys9) Antiboy(9649,CST),内参蛋白选用histone H3,一抗为rabbit Histone H3 Antibody (4499,CST),二抗均为goat anti-rabbit IgG labelled with HRP (A0208,碧云天)。在预冷的离心管中放入准确称取的刺参肠道组织,并以1∶9比例加入预冷的RIPA裂解液。4 ℃以12 000 r/min的转速离心30 min。保留上清液,测定蛋白浓度。将浓度一致的蛋白样品在冰上解冻,并按4∶1比例加入5×蛋白上样缓冲液,在95 ℃下煮沸变性5 min。蛋白样品经过12% SDS-PAGE电泳分离后转移到PVDF膜上,然后放置于5%的脱脂牛奶中,室温封闭1 h,封闭结束后,将膜放置于一抗中,4 ℃孵育过夜[33]。TBST溶液漂洗3次,将膜与指示抗体在4 ℃下孵育过夜,加入二抗室温孵育1 h[35]。用BeyoECL Plus显色工作液显影、定影,获得蛋白条带,用 NIH Image 1.63 software (Syngene, Cambridge, UK)图像分析软件对条带的灰度值进行分析,获得目的蛋白的相对表达量[36]。
1.3 刺参HATs 和 HDACs基因结构分析和系统进化树的构建
从NCBI中获得刺参基因组信息(ASM275485v1),筛选并分析HATs和HDACs基因的CDS和其对应的基因组序列。通过pI/Mw tool (https://web.expasy.org/compute_pi/)分析蛋白质分子量(Molecular weight, Mw)和等电点等特征(Isoelectric point, pI)。通过在线程序MEME(https://meme-suite.org/meme/tools/meme)获得蛋白的基序组成。通过TBtools生成外显子-内含子基因结构图。
从NCBI下载各物种的ajKAT2B、ajKAT5、ajKAT7、ajKAT8和ajSIRT1、ajHDAC1、ajHDAC3、ajHDAC4基因的氨基酸序列,利用Clustal W和 Mega4.0 软件进行物种间的多重序列比对,并构建物种间各基因的系统进化树,通过在线程序Evolview (https://www.evolgenius.info/evolview/#login)美化进化树。
1.4 mRNA提取及qRT-PCR检测
采用Trizol试剂(Invitrogen)提取刺参肠道组织的mRNA,检测RNA提取的完整性、纯度和浓度后,利用试剂盒PrimeScriptTMRT reagent Kit with gDNA Eraser(RR047A, Takara)反转为cDNA,用试剂TB Green©Premix Ex TaqTM(RR420A, Takara)进行qRT-PCR 实验[33]。根据各基因的序列信息,设计qRT-PCR所需要的正向引物和反向引物,以β-actin作为内参基因,并设计出对应的引物(见表1)。体系为20 μL,反应程序为:94 ℃维持5 min;40个循环的94 ℃ 30 s,58 ℃ 30 s,72 ℃ 30 min;72 ℃ 10 min;并添加溶解曲线[37]。以β-actin作为内参基因, 采用 2-△△Ct法计算目的基因的相对表达水平[38]。
1.5 数据分析
利用SPSS19.0 软件 (SPSS Inc., Chicago, IL, USA) 对所有目的基因表达量的数据进行方差齐性检验(F-test)[39]。采用单因素方差分析(One-way ANOVA)对符合方差齐性的数据进行检验。相对表达量表示为平均数±标准差(Mean±SD)。P<0.05为显著性差异。
2 结果
2.1 高温胁迫下刺参H3K9ac动态变化特征
在高温胁迫下,刺参的H3K9乙酰化水平有明显动态变化(见图1)。在26 ℃胁迫48 h后,刺参H3K9乙酰化显著升高,是对照组的1.73倍(P<0.05);在26 ℃胁迫96 h后,刺参H3K9乙酰化显著降低,是对照组的0.70倍(P<0.05)。
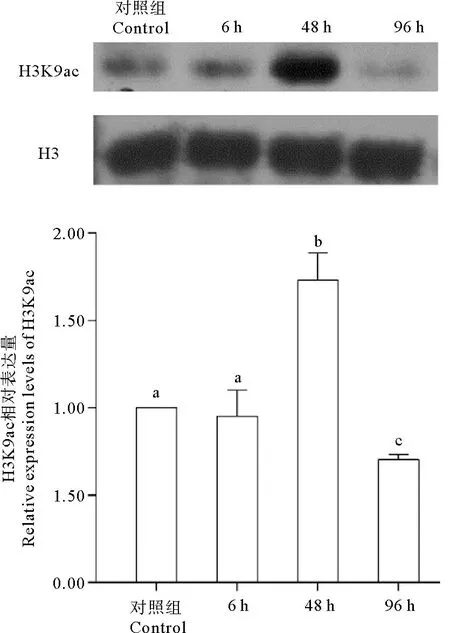
(数值含义为平均值±标准差(n=3)。图形上方标不同的字母表示差异显著(P<0.05),标相同的字母表示差异不显著(P>0.05)。Values indicate mean±SD (n=3).The different letters in the figure mean significant difference (P<0.05), and the same letters mean insignificant difference (P>0.05).)
2.2 刺参HATs和HDACs基因结构和系统进化树分析
组蛋白乙酰化水平受到乙酰化酶和去乙酰化酶的调控。通过刺参基因组序列,筛选并分析重要的乙酰化酶和去乙酰化酶的基因和蛋白结构(见图2):ajKAT2B基因长度为9 976 bp,有11个外显子,编码540个氨基酸序列,蛋白等电点和分子量预测为8.79
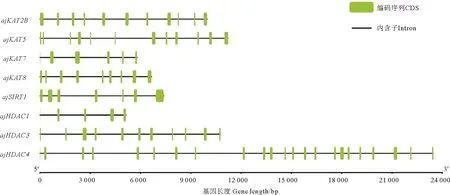
图2 刺参HATs和HDACs基因结构
和61.41 kDa;ajSIRT1基因长度为7 338 bp,有7个外显子,蛋白等电点和分子量预测为5.51和55.14 kDa;ajKAT7基因长度为5 797 bp,有6个外显子,编码281个氨基酸,蛋白质等电点和分子量分别预测为8.99和33.35 kDa;ajKAT5基因长度为11 219 bp,有12个外显子,编码470个氨基酸,蛋白质等电点和分子量分别预测为9.10和55.08 kDa;ajKAT8基因长度为6 652 bp,有9个外显子,编码429个氨基酸,蛋白质等电点和分子量分别预测为9.05和51.03 kDa;ajHDAC1基因长度为5 121 bp,有5个外显子,编码202个氨基酸,蛋白质等电点和分子量分别预测为6.59和23.26 kDa;ajHDAC3基因长度为10 768 bp,有11个外显子,编码428个氨基酸,蛋白质等电点和分子量分别预测为5.16和49.08 kDa;ajHDAC4基因长度为23 459 bp,有23个外显子,编码875个氨基酸,蛋白质等电点预测为7.22(见表2)。下载各个物种相应基因后,进行进化树构建。结果表明:刺参ajKAT2B和ajSIRT1均与棘皮动物门的棘冠海星(Acanthasterplanci)和紫色球海胆(Strongylocentrotuspurpuratus)的对应基因聚类在最近的分支,ajKAT5与绿海胆(Lytechinusvariegatus)的对应基因聚类在最近分支,ajKAT7、ajKAT8和ajHDAC3、ajHDAC4与棘皮动物门的红海盘车(Asteriasrubens)位于相邻的枝条上,具有较强的同源性;刺参大多数HATs和HDACs基因与哺乳动物门的人类(Homosapiens)和鼠科(Rattusrattus和Musmusculus)对应的基因聚类在最远的分支(见图3)。
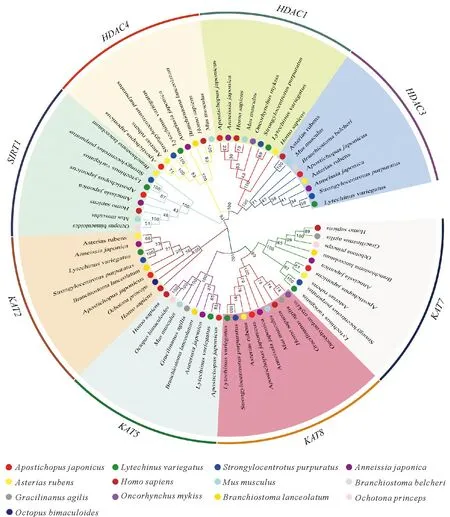
图3 刺参HATs和HDACs基因结构和系统进化树
通过MEME共鉴定出15个基序。如图4所示,除了ajKAT2B,乙酰化酶的大多数基因的基序分布和数量相同,且基序在结构上排列一致,在基本相同的位置,基序高度保守;类似的,去乙酰化酶除了ajSIRT1和ajHDAC4外,大多数基因的基序分布和数量相同,且基序在基本相同的位置且排列一致。

图4 刺参HATs和HDACs基因保守基序
2.3 刺参HATs和HDACs基因在高温胁迫下的mRNA表达量
通过qRT-PCR对4种HATs基因的mRNA表达的定量研究发现(见图5),ajKAT2B在高温胁迫48 h后有显著上升,表达量是对照组的1.90倍(P<0.05);在高温胁迫96 h后,ajKAT2B的表达量则开始下降,与对照组无显著差异(P>0.05)。ajKAT5在高温胁迫48 h后表达量显著高于对照组,约为对照组的2.39倍(P<0.05);在高温胁迫96 h后,ajKAT5的表达量则与对照组相比显著下降(P<0.05)。ajKAT7的表达量在高温胁迫48和96 h后均显著高于对照组,分别为对照组的2.76和2.37倍(P<0.05)。在高温胁迫48 h后ajKAT8的表达量显著上升,约为对照组的4.64倍;在高温胁迫96 h后,ajKAT8的表达量开始下降,与对照组无显著差异(P>0.05)。
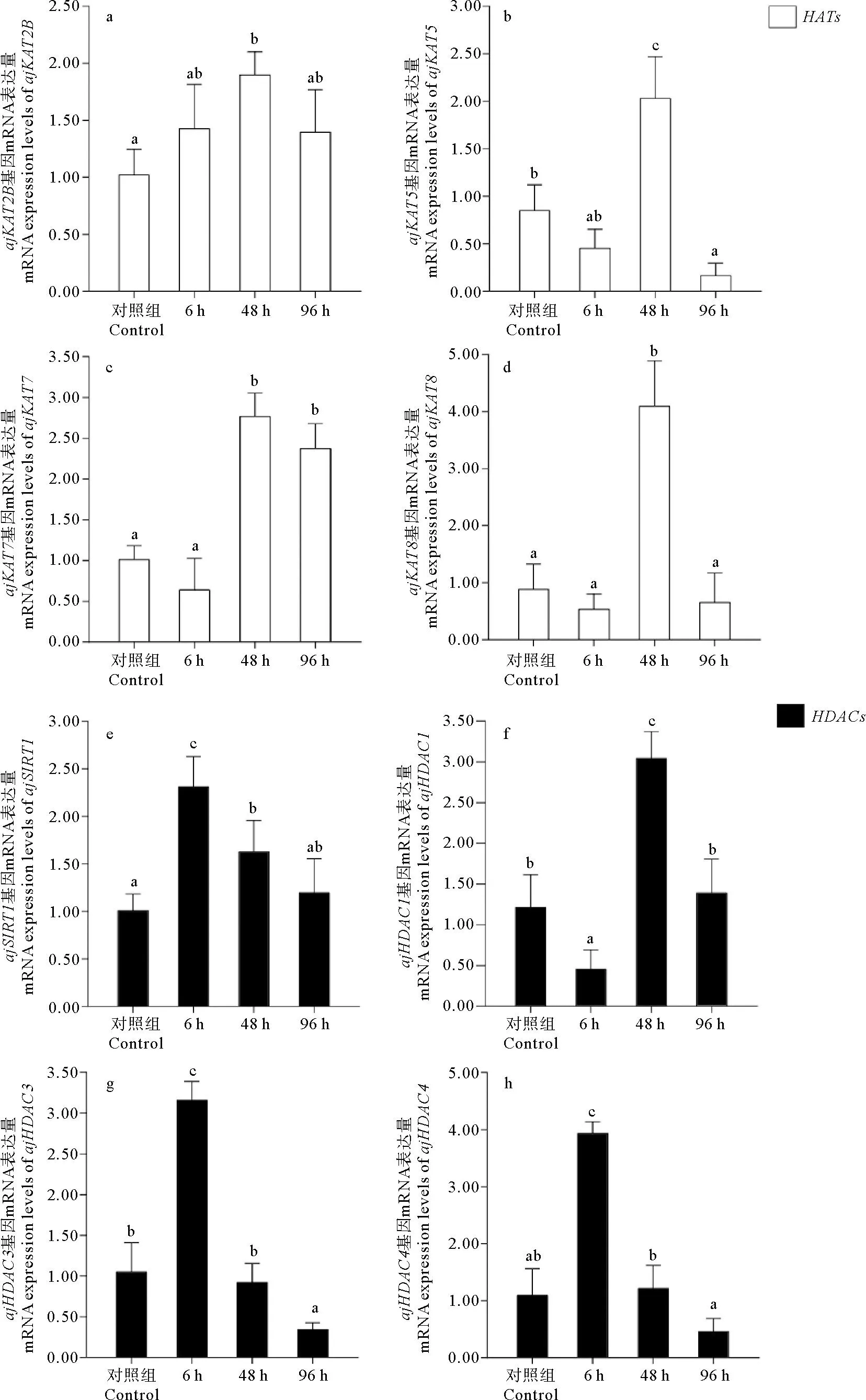
(数值含义为平均值±标准差(n=5)。图形上方标不同的字母表示差异显著(P<0.05),标相同的字母表示差异不显著(P>0.05)。 Values indicate mean±SD (n=5).The different letters in the figure mean significant difference (P<0.05), and the same letters mean insignificant difference (P>0.05). )
对4种HDACs基因的mRNA表达的定量研究发现(见图5):刺参基因ajSIRT1在高温胁迫6和48 h后均有明显的上升,表达量分别为对照组的2.31和1.63倍(P<0.05);在高温胁迫96 h后,ajSIRT1的表达量下降至与对照组无显著差异水平(P>0.05)。ajHDAC1在高温胁迫6 h后表达量显著降低,在48 h后显著升高并达到峰值,约为对照组的2.51倍;在高温胁迫96 h后,ajHDAC1的表达量开始下降,与对照组无显著差异(P>0.05)。ajHDAC3和ajHDAC4的表达量的变化趋势类似,在高温胁迫6 h后均显著上升,表达量分别为对照组的3.01和3.61倍(P<0.05),在48 h后开始下降至与对照组无显著差异的水平(P>0.05),在高温胁迫96 h后,ajHDAC3与对照组相比显著下降(P<0.05),而ajHDAC4继续下降与对照组无显著差异(P>0.05)。
3 讨论
组蛋白乙酰化是重要的转录后修饰方式之一,对生物的环境适应性具有重要意义[40]。H3K9ac作为一种组蛋白乙酰化修饰,常被认为与基因的转录激活相关[41-42]。有关H3K9ac在环境胁迫下的变化特征,及其对基因转录的调控作用在植物和高等动物中的研究较为广泛,例如,在拟南芥(Arabidopsisthaliana)的研究中发现,干旱胁迫可导致其H3K9ac增加,增加水分后其H3K9ac又迅速降低[43]。低氧处理下,哺乳动物细胞整体的H3K9乙酰化水平显著下降[16,44]。温度是影响生物最重要的环境因子之一。在植物中研究发现,低温可导致组蛋白乙酰化水平的快速变化,且这种变化是可逆的[45]。短暂的高温胁迫导致的玉米幼苗叶片组织的H3K9ac明显升高[17]。研究海洋生物对高温的生理生态响应在全球变暖的背景下意义重大,但目前在海洋动物中对高温胁迫下H3K9乙酰化水平的特征及作用却鲜有报道。
由于刺参对于温度非常敏感,在温度骤升情况下,会出现吐脏、化皮等应激反应。组蛋白乙酰化作为重要的转录后调控方式,在刺参中开展高温胁迫下组蛋白乙酰化修饰特征及其调控机制的研究具有重要的意义。本研究结果表明:在26 ℃高温胁迫下,刺参肠道组织整体的H3K9ac水平随着胁迫时间呈明显的动态变化:具体表现为胁迫48 h后有明显的上升,然后在96 h又迅速下降。目前普遍认为组蛋白乙酰化可以使其染色质结构变得松散,促进基因的转录激活或延伸过程[11-13]。我们从以上结果推测:高温胁迫下,受到H3K9ac调控的基因转录也呈先上升后下降的趋势。高温胁迫会导致很多功能基因表达量发生显著变化,很多重要的热胁迫响应基因(如HSP10、HSP60、HSP26、HSP70和HSP90)mRNA表达量在短时间内迅速升高,但随着胁迫时间的延长而逐渐下降[34,46]。因此,我们推测高温胁迫下刺参H3K9ac的动态变化对调控热胁迫响应基因的转录起到重要作用。
组蛋白的乙酰化水平由一系列组蛋白乙酰转移酶(HATs)和去乙酰化酶(HDACs)竞争性作用共同决定。组蛋白乙酰化修饰相关基因的表达情况可以间接反映组蛋白乙酰化修饰的过程,本研究在刺参基因组中筛选了组蛋白乙酰化修饰的8个代表性酶基因(HATs:ajKAT2B、ajKAT5、ajKAT7和ajKAT8;HDACs:ajSIRT1、ajHDAC1、ajHDAC3和ajHDAC4),然后对其基因结构进行解析并对保守基序进行分析。结果表明,刺参的大多数HATs基因的基序分布和数量相同,其中ajKAT5、ajKAT7和ajKAT8同属于组蛋白乙酰转移酶MYST家族,基序在结构上排列一致,基序在基本相同的位置,且高度保守,因此推测这3种基因行使大致相同的功能,对组蛋白进行乙酰化修饰;在HDACs中也发现相同的情况,ajHDAC1、ajHDAC3作为Ⅰ类HDACs具有结构相似的保守基序,与其他两类HDACs有很大的区别,推测ajHDAC1、ajHDAC3行使类似的功能,而ajSIRT1和ajHDAC4调控不同的组蛋白去乙酰化修饰。此外,4种HATs基因和4种HDACs基因的系统进化树与物种进化树呈现一致的趋势,这也证明刺参HATs和HDACs的功能较保守。
为了进一步证明ajKAT2B和ajSIRT1在刺参高温胁迫响应中发挥作用,我们通过qRT-PCR对8个基因的mRNA表达进行了定量研究。结果表明:4种HATs基因的表达量均在高温胁迫48 h后有明显上升,并在胁迫96 h后出现下降趋势,其中ajKAT2B,ajKAT8下降到对照组水平,这与之前王天明等[47]在对刺参长时间夏眠的研究中KAT2B在0~5 d的表达量无明显变化的结果是一致的。4种HDACs基因中,除ajHDAC1外,其余3种HDACs均在高温胁迫6 h后表达量达到最高,而后逐渐下降;ajHDAC1在高温胁迫6 h后有明显的下降,又在48 h后迅速上升,后降低至对照组水平,这与陈慕雁等研究结果中刺参组蛋白脱乙酰基转移酶在夏眠期间表达量的检测结果相符,这表明HDAC4的表达量在深度夏眠期的肠道组织中显著增加,当夏眠解除时又恢复到正常水平[38],李尚俊等的研究也证明刺参肠道的HDAC3在高温胁迫下迅速上升,在6 h后略有下降,说明刺参在高温胁迫下的表观遗传调控随着胁迫时间的延长最终趋于平稳[48]。上述结果表明,在高温胁迫下,刺参HATs和HDACs的响应均是短暂而动态的。以上结果与其他物种中相关基因mRNA表达水平的研究结果相一致,例如,40 ℃胁迫1 h处理会导致拟南芥GCN5基因的mRNA水平显著上升[19]。在对斑马鱼的研究中发现,敲降组蛋白去乙酰化酶基因HDAC8使ZF4细胞的死亡增加[49]。对一种潮间带帽贝(Cellanatoreuma)的研究发现,SIRT1对高温胁迫和渗透压胁迫均有明显的响应,可作为胁迫环境下的指示基因[28]。研究还发现,在34 ℃胁迫1和4 h的帽贝SIRT1的mRNA表达量相比于对照组(16 ℃)显著升高[50]。
在高温胁迫下刺参HATs和HDACs均有短暂升高的响应,两者表达量的变化可能是导致高温胁迫下H3K9ac动态变化的原因之一,从而进一步影响基因的转录调控及其对高温的耐受能力。但是,组蛋白乙酰化动态变化的调控机制非常复杂,可能有除以上HATs和HDACs外的其他关键的组蛋白乙酰化相关酶基因参与该过程,这还需要进一步深入研究落实。
4 结语
组蛋白修饰是重要的表观调控方式,对生物在环境胁迫下基因的转录表达和环境耐受性有明显的作用。本文首次在刺参中研究了高温胁迫下H3K9乙酰化水平的动态变化,推测该变化对刺参高温胁迫下基因的转录表达调控有明显的作用。组蛋白乙酰化水平由乙酰转移酶和去乙酰化酶共同决定,刺参多种HATs和HDACs在mRNA水平上对高温胁迫均有明显响应,这可能是导致该过程中H3K9ac变化的因素之一。

