单中心慢性肾脏病3~5期患者肾性贫血的相关因素分析*
王春花, 胡文博, 王宁宁, 李瑜琳, 刘海琴, 罗玉霞, 高蕾, 刘文花
(青海省人民医院 肾内科, 青海 西宁 810000)
慢性肾脏病(chronic kidney disease, CKD)是各种原因导致的肾脏功能与结构障碍。近年来,全球范围内CKD 患病率逐年升高,因其具有发病隐匿、预后差等特点,已成为全球重要疾病负担与公共卫生问题[1]。研究报道,我国一般人群CKD 患病率约为10.8%,女性显著高于男性[2]。
肾性贫血(renal anemia, RA)是CKD 常见并发症。既往研究证实,RA 是CKD 患者产生左心室肥厚的相关因素,可提高患者出现不良心血管事件概率[3-4]。但CKD 产生RA 的影响因素复杂,目前尚无统一意见,异质性较大。因此,探讨青海地区CKD患者发生RA 的潜在因素,并据此采取早期针对性干预,对改善患者预后具有积极作用。本研究回顾性分析在青海省人民医院肾内科住院治疗的CKD患者的临床资料并进行相关因素分析,旨在提高RA治疗达标率,优化患者生活质量,延缓CKD 进程,延长患者生存时间。
1 资料与方法
1.1 一般资料
选取2019 年6 月—2021 年5 月在青海省人民医院肾内科住院治疗的CKD 3~5 期患者(海拔1 500~4 500 m)282 例。其中,男性177 例,女性105 例;年龄20~77 岁,平均(54±13)岁;原发病:慢性肾小球肾炎119 例,糖尿病肾病114 例,高血压肾损害18 例,多囊肾6 例,不明原因25 例。RA 组176 例,非RA 组106 例,两组年龄比较,差异无统计学意义(P>0.05)。本研究经医院医学伦理委员批准,研究对象均签署知情同意书。
CKD 诊断依据改善全球肾脏病预后组织(kidney disease:improving global outcomes, KDIGO)2020 年CKD 临床实践指南标准[5]:①肾损害(结构或功能)≥ 3 个月,包括发生组织学与影像学异常、肾小管相关病变、尿沉渣异常、蛋白尿等肾损伤标志或存在肾移植史,有或无肾小球滤过率(glomerular filtration rate, GFR)降低;②无明确原因GFR 降低≥3 个月。
CKD 分期诊断标准参照KDIGO 会议共识[6],根据慢性肾脏病流行病学合作研究公式(chronic kidney disease epidemiology collaboration, CKD-EPI)的GFR 估算值(estimated GFR, eGFR)进行CKD 分期:1 期肾功能正常,GFR ≥ 90 mL/(min·1.73m2);2 期肾功能轻度下降,GFR 60~< 90 mL/(min·1.73m2);3a期肾功能轻度到中度下降,GFR 45~< 60 mL/(min·1.73m2);3b 期肾功能中度下降,GFR 30~< 45 mL/(min·1.73m2);4期肾功能重度下降,GFR 15~< 30 mL/(min·1.73m2);5 期肾功能衰竭,GFR < 15 mL/(min·1.73m2)。
RA 参考KDIGO 2012 年CKD 贫血诊治指南标准[7],年龄≥ 16 岁,血红蛋白(hemoglobin, HGB)成年女性< 120 g/L,成年男性< 130 g/L,同时符合CKD 诊断要求,即可进行诊断。
1.2 纳入与排除标准
1.2.1 纳入标准 ①CKD 3~5 期;②年龄18~75 岁;③初次诊断为RA。
1.2.2 排除标准 ①合并内分泌、神经或心血管系统等其他严重疾病;②合并严重营养不良、恶性肿瘤、消化道出血;③近期有输血史;④合并急性感染性疾病、急性肾损伤;⑤既往接受促红细胞生成素(erythropoietin, EPO)、低氧诱导因子-脯氨酰羟化酶抑制剂(hypoxia inducible factor-prolyl hydroxylase inhibitor, HIF-PHI)治疗;⑥临床资料不全;⑦孕妇或哺乳期女性。
1.3 人口学特征
通过电子病历系统采集282 例患者的性别、年龄、原发病、家庭地址、合并症等人口学特征。
1.4 生化指标测定
清晨采集患者空腹血10 mL,3 000 r/min 离心10 min,取血清,采用日本日立公司的全自动生化分析仪测定HGB、红细胞(red blood cell, RBC)数量、叶酸、维生素B12(vitamin B12, VITB12)、铁蛋白(serum ferritin, SF)、尿素氮(blood urea nitrogen, BUN)、血肌酐(serum creatinine, Scr)、血清铁(serum iron, SI)、总铁结合力(total iron binding capacity, TIBC)、不饱和铁结合力(unsaturated iron binding capacity, UIBC)、转铁蛋白饱和度(transferrin saturation, TSAT)、甲状旁腺激素(intact parathyroid hormone, IPTH)、促黄体激素(Lutropin, LH)、睾酮(Testosterone, T)、促卵泡激素(follicle-stimulating hormone, FSH)、孕酮(Progesterone, P)、泌乳素(Prolactin, PRL)、雌二醇(Estradiol 2, E2)、EPO、低氧诱导因子-1α(hypoxia inducible factor-1α, HIF-1α)、铁调素(Hepcidin,Hepc)水平。
1.5 统计学方法
数据分析采用SPSS 26.0 统计软件。计量资料以均数±标准差(±s)或中位数和四分位数[M(P25,P75)]表示,比较用t检验或秩和检验;计数资料以构成比或率(%)表示,比较用χ2检验;影响因素分析用多因素逐步Logistic 回归分析;相关性分析用Spearman 法。P<0.05 为差异有统计学意义。
2 结果
2.1 两组一般资料比较
CKD 患者中,CKD 5 期占比最高为65.3%(184/282),其次为CKD 4 期占19.1%(54/282),CKD 3 期仅占15.6%(44/282)。CKD 3~5 期患者中,慢性肾小球肾炎为主要发病原因,占比为42.2%(119/282);其次为糖尿病肾病,占比为40.4%(114/282);高血压肾损害、多囊肾、不明原因占比分别为6.4%(18/282)、2.1%(6/282)、8.9%(25/282)。将研究人群按照GFR 水平分为CKD 3、4、5 期,其RA 患病率分别为25.0%(11/176)、46.3%(25/176)、76.1%(140/176),不同分期患者RA 患病率比较,差异有统计学意义(χ2=22.325,P=0.000),且两两比较差异均有统计学意义(P<0.05),随着肾功能不断减退,RA 患病率逐渐升高。
2.2 CKD 3~5期患者合并RA的相关因素分析
RA 组与RA 组性别比较,经χ2检验,差异有统计学意义(P<0.05),RA 组女性占比高于非RA 组。RA 组与RA 组RBC、BUN、Scr、SI、TIBC、TSAT、IPTH、LH、T、PRL、EPO、HIF、Hepc 水平比较,经t检验,差异均有统计学意义(P<0.05);RA 组BUN、Scr、IPTH、LH、PRL、Hepc 水平高于非RA 组,RA 组患者RBC、SI、TIBC、TSAT、T、EPO、HIF 水平低于非RA 组。RA组与RA 组海拔、年龄、原发病、叶酸、VITB12、SF、UIBC、FSH、P、E2 比较,差异均无统计学意义(P>0.05)。见表1。
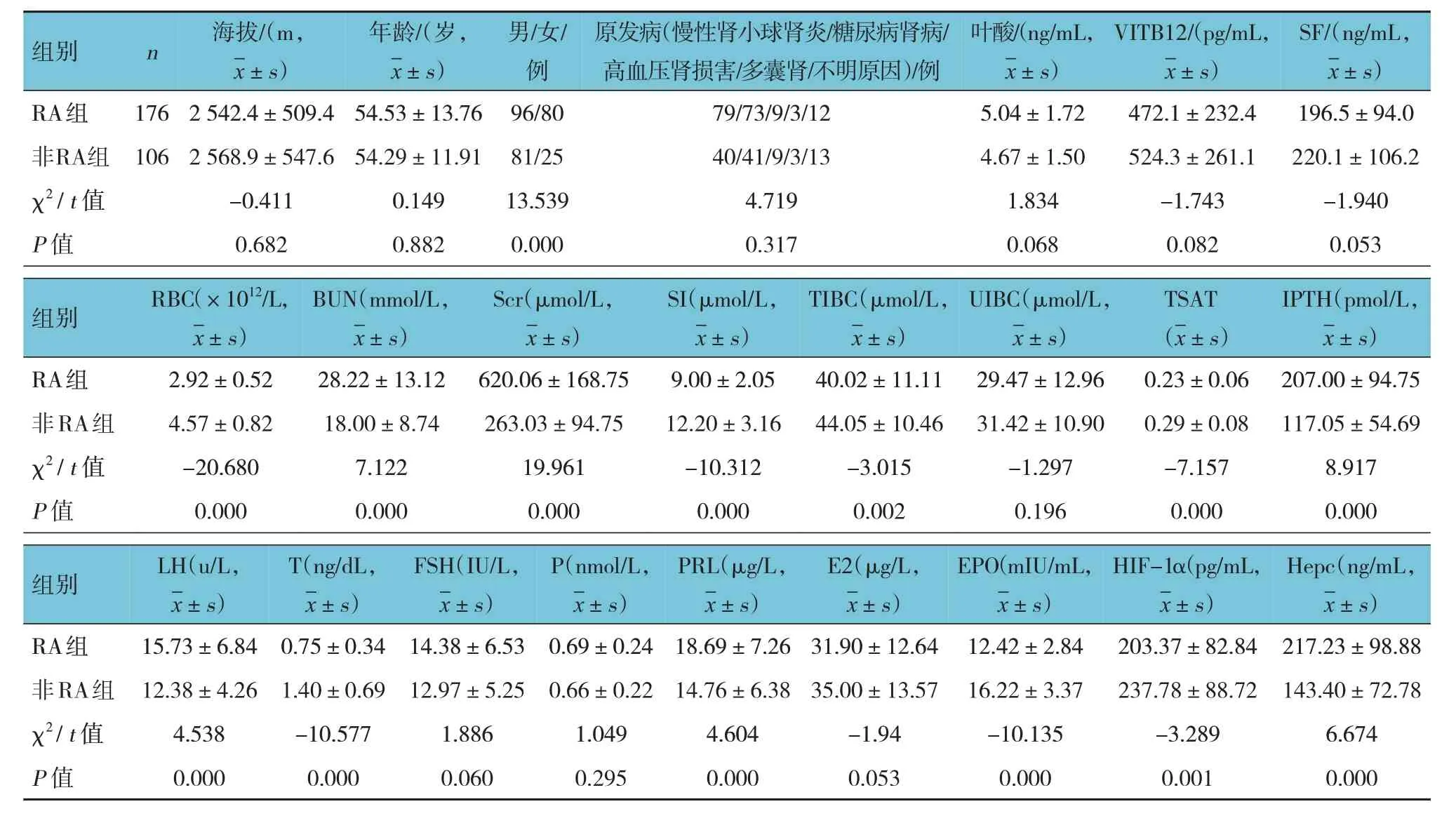
表1 两组患者临床资料比较
2.3 CKD 3~5 期患者合并RA 的多因素逐步Logistic回归分析
将CKD 3~5 期患者是否合并RA 作为因变量,单因素分析中差异有统计学意义的指标作为自变量[性别(女性= 1,男性= 2)、RBC、BUN、Scr、SI、TIBC、TSAT、IPTH、LH、T、PRL、EPO、HIF、Hepc 为实测值],行多因素逐步Logistic 回归分析(α入=0.05,α出=0.10),结果:BUN [=1.413(95% CI:1.026,1.947)]、Scr [=1.079(95% CI:1.008,1.154)]、Hepc[=1.104(95% CI:1.029,1.185)]是CKD 3~5 期患者发生RA 的危险因素;RBC [=0.560(95% CI:0.394,0.796)]、SI [=0.627(95% CI:0.457,0.861)]、EPO [=0.652(95% CI:0.506,0.839)]、HIF [=0.943(95% CI:0.914,0.972)]是CKD 3~5 期患者发生RA 的保护因素(P<0.05)。见表2。

表2 CKD 3~5期患者合并RA的多因素逐步Logistic回归分析参数
2.4 CKD 3~5期患者HGB水平与各指标的相关性
CKD 3~5 期患者HGB 水平与性别、CKD 分期、BUN、Scr、IPTH、LH、FSH、PRL、Hepc 呈负相关(r=-0.304、-0.488、-0.405、-0.404、-0.297、-0.256、-0.195、-0.232 和-0.312,P=0.000、0.000、0.000、0.000、0.000、0.003、0.024、0.007 和0.000);与RBC、SI、TIBC、T、EPO、HIF 呈正相关(r=0.967、0.224、0.183、0.266、0.253 和0.151,P=0.000、0.000、0.002、0.002、0.000 和0.014);与TSAT、P、E2 与HGB 无相关性(r=0.118、-0.061 和0.093,P=0.050、0.483 和0.282)。
3 讨论
RA 是导致CKD 病情进展及预后差的重要因素。既往研究证实,RA 可导致血液携氧能力降低,加重心脏前负荷,提高患者死亡风险,且RA 可能受多种因素影响[8]。2018 年一项透析预后与实践模式研究证实,RBC 每增加10 个单位,尿毒症患者的住院率、病死率可分别降低12%、10%[9]。故准确评估CKD 出现RA 的潜在影响因素并加以纠正,对减缓CKD病程进展、优化患者预后具有积极意义。有证据显示,高原暴露不仅能影响终末期肾病(end-stage renal disease, ESRD)患者RA 发生率,而且对RA 患者治疗效果亦有明显影响[10]。探讨高原暴露人群EPO表达和铁代谢情况可以为氧分压变化能否影响RA提供理论依据。青海地区位于青藏高原东部,平均海拔> 3 000 m,属于中高海拔地区,本研究主要以中高海拔地区CKD 3~5 期患者为研究对象,分析探讨其CKD 患者RA 的危险因素与实验室指标的相关性。
近年来,关于CKD 的病因研究逐渐深入。LI等[11]通过一项上海的横断面调查显示,糖尿病肾病(13.34%)、高血压肾损害(13.69%)、慢性肾小球肾炎(57.26%)居非透析CKD 患者基础疾病前3 位。随全球糖尿病患病率不断升高,其可能成为未来推动CKD 患病率升高的主要病因。本研究发现,慢性肾小球肾炎为CKD 3~5 期患者主要原因(42.2%),其次为糖尿病肾病(40.4%),与吴宇等[12]研究结果相符。
据研究报道,CKD 3、4、5 期患者RA 发生率分别为51.7%、82.4%、94.4%,提示随着肾功能减退,GFR不断降低,RA 发生风险可不断增加[13]。国外研究也证实,由CKD 3 期开始CKD 患者RA 发生率处于较高水平,且随GFR 降低发生率不断升高[14-15]。本研究中,CKD 患者RA 发生率为62.42%,CKD 3、4、5 期患者RA 患病率分别为25.0%、46.3%、76.1%,提示随患者肾功能的减退,RA 发生率不断升高,与前述研究相符。既往认为,与低海拔RA 患者相比,高海拔患者使用较少的红细胞生成刺激剂(erythropoiesis stimulating agents, ESAs)即能达到相同或更高的血红蛋白水平,并且EPO 抵抗发生率也降低,引起该现象的原因可能与高原地区ESRD 患者产生更多的内源性EPO 有关[16]。本研究中CKD 3~5 期患者RA 的患病率较国内已报道患病率明显偏低。这可能与本研究中患者均来自中高海拔(海拔1 500~4 500 m)有关,高原暴露可带来低氧、低压环境,人体长期处于此环境内EPO 分泌可明显增多,HGB 代偿性增加,这可能是中高海拔地区RA 患病率低于低海拔地区的原因,但仍有可能与不同人群血红蛋白基础水平、RA 诊断标准和种族间遗传背景差异有关。
有研究表明,CKD 患者缺铁性贫与CKD 相关炎症密切相关,受CKD 相关炎性介质的影响,肾脏清除铁调素能力下降,引起铁调素含量增加,影响铁吸收与输出,造成机体SI 含量减少,RBC 生成量降低,引起缺铁性贫[17-19]。本研究单因素分析中,RA组与非RA 组SI、TIBC 存在差异,表明SI、TIBC 与RA发生风险有关,与上述研究相符。本研究相关性分析结果显示,SI、TIBC 与HGB 水平呈正相关,SI、TIBC 水平越低则HGB 越低。及时发现并纠正铁代谢紊乱,对减少CKD 患者并发RA 具有重要作用。
有研究报道,CKD 3 期患者的RA 患病率为74.47%,至5 期患病率可增长至100%[20]。提示,随肾功能减退与GFR 降低,RA 发生率显著升高。本研究中单因素分析结果表明,两组BUN、Scr 有差异,多因素逐步Logistic 回归分析结果显示BUN、Scr、Hepc 负向预测CKD 3~5 期患者RA,是RA 的危险因素;相关性分析结果显示,HGB水平与RBC、SI呈正相关,与Scr、BUN 呈负相关,提示肾功能状况与RA 风险独立相关,BUN、Scr 水平越低,RA 发生风险越高,反之则相反,与上述平原地区研究结果一致。肾功能减退会造成RA 发生率升高,推究原因在于随着GFR 降低,内源性EPO 形成不断减少,导致RA 患者增加。
本研究单因素分析中RA 组与非RA 组间海拔差异无统计学意义,这可能与研究人群为长期居住在中高海拔地区的CKD 患者有关。当患者肾功能减退,其肾脏产生的EPO 细胞损伤加重,肾脏氧感应机制受损,脯氨酰羟化酶异构体与氧的亲和力异常增强,导致HIF 活性降低,红细胞生成相关基因的转录也相应减少[21-23]。中高海拔地区的CKD 患者虽处在低氧环境,但因肾脏产生EPO 细胞损伤,肾脏氧感应机制受损,所以HIF 活性降低,EPO 合成不足。但引起该现象的原因尚不完全清楚,可能不仅与高原地区特殊的环境有关,也与患者本身的遗传背景密不可分,仍需进一步研究。
CKD 造成EPO 产生相对或者绝对不足是导致RA 的主要原因,同时CKD 患者多存在铁吸收和利用障碍,均可导致红细胞生成障碍。临床研究认为,HIF 可使铁调素表达下降,促使膜铁转运蛋白释放,增加肠道铁的吸收,并促进巨噬细胞内的铁释放;当CKD 患者出现RA 时,组织缺氧,通过激活HIF,下调铁调素的表达,同时刺激EPO 产生增加,从而促进红细胞生成[24-26]。本研究结果显示,非RA 组EPO、HIF水平均高于RA 组,Hepc 则相反,提示EPO、HIF 水平升高,Hepc 低表达有利于纠正RA 状态,因本研究纳入患者有一部分已接受铁剂、ESAs 及PHI 治疗,可能在一定程度上影响研究结果,使结果向利于纠正RA的方向发展,这也证实铁剂、ESAs 及PHI 对RA 的治疗是有效的。本研究结果还显示,EPO、HIF、RBC、SI、BUN、Scr、Hepc 是CKD 3~5 期患者RA 的预测因素,CKD 3~5 期患者HGB 水平与EPO、HIF 呈正相关。由此可见,EPO、HIF 高表达是CKD 3~5 期患者RA 的保护因素。
本研究结果显示,CKD 3~5 期患者HGB 水平与BUN、Scr 呈负相关,与RBC、SI、TIBC、EPO、HIF 呈正相关。由此可见,BUN、Scr 水平越高,RA 发生率越高;EPO、HIF 水平越高,RA 发生率越低。
本研究独特性与局限性在于研究对象均来自中高海拔地区的青海省人民医院,未进行多中心联合取样,可能导致结果代表性不足,针对结果需慎重解读。且中高海拔暴露人群中氧分压变化是否能影响RA 仍需进一步研究,后续研究需完善上述数据,使研究结果更全面、更有说服力。
综上所述,本研究探讨CKD 3~5 期RA 患者的一般生化指标及海拔相关因素,结果表明,EPO、HIF、RBC、SI、BUN、Scr、Hepc 均是CKD 3~5 期患者RA 的影响因素。由于RA 治疗困难,青海省人民医院制订个体化RA 治疗方案,加强细致化慢性管理,以提高本中心CKD 患者RA 的达标率,从而改善生活质量。

