右美托咪定对脓毒症小鼠认知功能及HSP70表达的影响*
赵园园, 邱高林, 蔡雯, 周静文, 李元海, 夏晓琼, 张梦英
(1.安徽医科大学附属巢湖医院 麻醉科, 安徽 巢湖 238000; 2.安徽医科大学第一附属医院 麻醉科, 安徽 合肥 230031)
脓毒症是机体对感染反应失调所致的脏器功能障碍综合征,脓毒症相关性脑病(sepsis-associated encephalopathy, SAE)是脓毒症的中枢系统并发症,与脑内炎症、氧化应激有关,病死率较高,幸存者多存在长期认知缺陷,但目前尚无有效的治疗方式[1]。热休克蛋白70(heat shock protein70, HSP70)是热休克蛋白家族的重要成员,是一种高度保守的蛋白,作用广泛,能协助蛋白正确地折叠、促进异常蛋白的降解、阻止Tau 蛋白和Aβ 聚集、抑制神经炎症与氧化应激,在神经退行性疾病、血管性脑病中发挥脑保护作用[2-5]。
右美托咪定(Dexmedetomidine, Dex)是一种高选择性的α2 受体激动剂,兼具镇静与镇痛作用,广泛用于临床麻醉和重症监护室镇静。有研究显示,Dex 定能通过抗炎、抗氧化、抗交感、降低氨基酸毒性、减少神经元凋亡等机制改善脓毒症患者认知功能[6-7],但HSP70 是否参与其脑保护过程目前尚不清楚。本研究以脂多糖(Lipopolysaccharide, LPS)复制脓毒血症相关的认知障碍模型,探讨Dex 对脓毒症小鼠认知功能的影响和HSP70 表达的调控,为其脑保护机制的研究提供参考。
1 材料与方法
1.1 实验动物
SPF 级雄性C57BL/6 小鼠[实验动物生产许可证号:SCXK(皖)2022-001,实验动物使用许可证号:SYXK(皖)2020-001]80 只,周龄7~8 周,体重20~25 g,购于安徽医科大学实验动物中心。本研究经医院医学伦理委员会批准。
1.2 试剂与仪器
1.2.1 主要试剂 盐酸右美托咪定注射液(扬子江药业集团有限公司,批号:22041031),LPS(上海优宁维生物科技股份有限公司,批号:abs42020800),BCA 蛋白定量试剂盒(爱必信生物科技股份有限公司,批号:abs9232),过氧化物歧化酶(superoxide dismutase, SOD)活性、谷胱甘肽(Glutathione, GSH)和丙二醛(Malondialdehyde, MDA)试剂盒(南京建成生物工程研究所,批号:A001-1-3-2、A006-2-1、A003-1-2),肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)、白细胞介素-1β(Interleukin-1β, IL-1β)酶联免疫吸附试验(enzyme linked immunosorbent assay,ELISA)试剂盒(上海碧云天生物技术有限公司,批号:PI303、PT512),RNA 提取液、Synthesis Super Mix for qPCR 和2×SYBR Green qPCR Master Mix(武汉赛维尔科技有限公司,批号:G3013、G3337、G3320),HSP70 单克隆抗体、免疫组织化学染色试剂盒(武汉三鹰生物技术有限公司,批号:66183-1-lg、PK10018)。
1.2.2 主要仪器 低速冷冻离心机(型号:KDC-2046,安徽中科中佳科学仪器有限公司),酶标仪[型号:Multiskan FC,赛默飞世尔(上海)仪器有限公司],荧光定量PCR 仪[型号:CPX96 Touch,伯乐生命医学产品(上海)有限公司],生物显微镜(型号:DM2500,德国徕卡公司)。
1.3 方法
1.3.1 动物分组与模型复制 将C57BL/6 小鼠随机分为对照组(CON 组)、单纯Dex 组(Dex 组)、脓毒血症组(LPS 组)和Dex + 脓毒血症组(D + L 组),每组20 只。首先,Dex 组和D + L 组按照参考文献[8]方法,腹腔注射Dex 25 μg/kg,CON 组和LPS 组腹腔注射等剂量的生理盐水;30 min 后LPS 组和D+L 组参 照 文 献[9] 腹 腔 注 射 5 mg/kg 脂 多 糖(Lipopolysaccharide, LPS)复制脓毒血症模型,CON 组和Dex 组腹腔注射等剂量的生理盐水。
1.3.2 Morris 水迷宫实验 每组给药后24 h 随机选8 只小鼠进行实验。Morris 水迷宫为直径100 cm,深30 cm 的圆形水池,水温控制在(22±1)℃,将直径10 cm 的圆形平台放入目标象限,并隐匿于水面下1 cm。第1~5 天进行定位航行实验,每日将小鼠面向池壁从4 个象限依次放入水中,记录每次爬上平台的时间(逃避潜伏期),若60 s 内未爬上平台则按60 s 计算,并引导其至平台上停留30 s。第6 天进行空间探索实验,撤离平台,将小鼠从原平台对侧的象限放入水中,记录小鼠60 s 内在目标象限的停留时间及穿越平台的次数。
1.3.3 ELISA 检测血清TNF-α 和IL-1β 水平 每组给药后24 h 取8 只小鼠眼球取血,室温静置2 h,4℃、3 000 r/min 离心10 min,取上清液,按照试剂盒说明书操作,采用ELISA 检测小鼠血清TNF-α、IL-1β 水平。处死小鼠取海马组织,置入-80 ℃冰箱冷冻保存备用。
1.3.4 化学比色法检测海马组织SOD 活性和GSH、MDA 水平 取备用的海马组织清洗称重,按质量∶体积=1∶9 加入生理盐水,用组织匀浆器在冰上充分研磨制备10%海马组织匀浆,4 ℃、3 000 r/min 离心10 min 后取上清液,采用BCA 法测定海马组织蛋白浓度,化学比色法测定SOD 活性和GSH、MDA 水平。
1.3.5 苏木精-伊红(hematoxylin-eosin, HE)染色观察小鼠海马组织病理变化 每组给药后24 h 取4 只小鼠断颈处死,冰上分离出完整的海马组织,用4%多聚甲醛固定,经脱水、石蜡包埋和切片制备成4 μm 厚的切片,烘干备用。每只取3 张切片,经二甲苯和酒精脱蜡至水后进行HE 染色,于400 倍显微镜下观察海马CA1 区组织形态变化。
1.3.6 免疫组织化学染色检测海马组织HSP70 蛋白的表达 取制备的海马切片,每只3 张切片,常规脱蜡和水化后抗原热(96~98 ℃)修复20 min,ddH20润洗、缓冲液浸泡;滴加封闭液湿盒内封闭30 min;滴加2 μg/mL 的HSP70 一抗50 μL 湿盒中孵育1 h,缓冲液洗涤2 次,1 min/次;滴加2~4 滴二抗湿盒中孵育30 min,缓冲液洗涤3 次,1 min/次;滴加DAB,变色后缓冲液冲洗,ddH20 浸泡3~4 次、30 s/次;滴加信号加强液,孵育5 min,缓冲液润洗,复染、封片。显微镜下观察海马CA1 区,应用Image J 软件分析免疫组织化学染色结果,阳性细胞率=视野内阳性细胞数/细胞总数×100%。
1.3.7 实时荧光定量聚合酶链反应(quantitative realtime polymerase chain reaction, qRT-PCR)检测海马组织HSP70 mRNA表达 取适量海马组织,按10 mg组织中加100 μL RNA 提取液的比例研磨均匀,提取总RNA,根据试剂盒说明书进行逆转录和qRTPCR。HSP70 正向引物:5'-CCGACAAGGAGGAGTTC GTG-3',反向引物:5'-ACAGTAATCGGTGCCCAAGC-3',长度均为249 bp;GAPDH 正向引物:5'-CCTCGTCCCGTAGACAAAATG-3',反向引物:5'-TGAGGTCAATGAAGGGGTCGT-3',长度均为133 bp。反应条件:95 ℃预变性30 s、95 ℃变性15 s、60 ℃退火并延伸30 s,共40 个循环。以GAPDH 为内参,采用2-ΔΔCt法计算HSP70 mRNA 相对表达量。
1.4 统计学方法
数据分析采用SPSS 22.0 统计软件。计量资料以均数±标准差(±s)表示,比较用单因素方差分析或重复测量设计的方差分析,两两比较用LSD-t检验。P<0.05 为差异有统计学意义。
2 结果
2.1 各组小鼠Morris水迷宫实验指标比较
各组小鼠第1、2、3、4、5 天逃避潜伏期比较,经重复测量设计的方差分析,结果:①不同时间点的逃避潜伏期比较,差异有统计学意义(F=206.485,P=0.000);②各组小鼠的逃避潜伏期比较,差异有统计学意义(F=14.576,P=0.000),LPS 组较CON 组延长,D+L 组较LPS 组缩短;③各组小鼠逃避潜伏期变化趋势比较,差异有统计学意义(F=3.877,P=0.020)。见表1。
表1 各组小鼠不同时间点逃避潜伏期比较 (n =8, s, ±s)
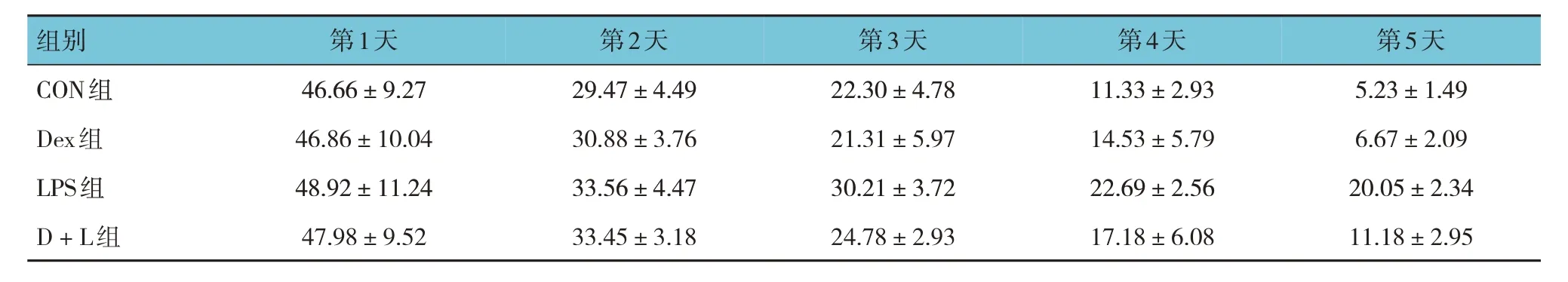
表1 各组小鼠不同时间点逃避潜伏期比较 (n =8, s, ±s)
组别第1天第2天第3天第4天第5天CON组Dex组LPS组D + L组46.66±9.27 46.86±10.04 48.92±11.24 47.98±9.52 29.47±4.49 30.88±3.76 33.56±4.47 33.45±3.18 22.30±4.78 21.31±5.97 30.21±3.72 24.78±2.93 11.33±2.93 14.53±5.79 22.69±2.56 17.18±6.08 5.23±1.49 6.67±2.09 20.05±2.34 11.18±2.95
空间探索实验结果显示,各组小鼠游泳速度比较,差异无统计学意义(P>0.05)。各组小鼠目标象限停留时间、穿越平台次数比较,差异均有统计学意义(P<0.05),LPS 组目标象限停留时间短于CON组,D+L 组长于LPS 组;LPS 组穿越平台次数少于CON 组,D+L 组多于LPS 组。见表2。
表2 各组小鼠空间探索结果比较 (n =8, ±s)

表2 各组小鼠空间探索结果比较 (n =8, ±s)
注:①与CON组比较,P <0.05; ②与LPS组比较,P <0.05
组别穿越平台次数游泳速度/(cm/s)目标象限停留时间/s CON组Dex组LPS组D + L组F 值P 值8.13±1.55 6.75±2.12 4.13±1.13①6.38±1.19②9.190 0.000 23.99±2.67 23.10±1.66 24.59±2.17 23.24±2.27 0.779 0.515 31.65±5.63 29.06±5.96 20.33±3.74①28.05±4.28②7.632 0.001
2.2 各组小鼠血清TNF-α、IL-1β水平比较
各组小鼠血清TNF-α、IL-1β 水平比较,差异均有统计学意义(P<0.05),LPS 组较CON 组升高,D+L组较LPS 组降低。见表3。
表3 各组小鼠血清TNF-α、IL-1β水平比较(n =8, pg/mL, ±s)

表3 各组小鼠血清TNF-α、IL-1β水平比较(n =8, pg/mL, ±s)
注:①与CON组比较,P <0.05; ②与LPS组比较,P <0.05。
组别IL-1β TNF-α CON组Dex组LPS组D + L组F 值P 值25.50±5.90 26.26±6.58 65.85±9.05①41.94±4.58②63.101 0.000 57.12±12.29 57.38±15.07 154.80±17.50①86.13±9.15②88.232 0.000
2.3 各组小鼠海马组织SOD、GSH、MDA水平比较
各组小鼠海马组织中SOD、GSH、MDA 水平比较,差异均有统计学意义(P<0.05),LPS 组GSH、SOD 水平较CON 组降低,MDA 水平较CON 组升高,D+L 组GSH、SOD 水平较LPS 组升高,MDA 水平较LPS 组降低。见表4。
表4 各组海马组织中氧化应激水平比较 (n =8, ±s)

表4 各组海马组织中氧化应激水平比较 (n =8, ±s)
注:①与CON组比较,P <0.05; ②与LPS组比较,P <0.05。
组别MDA/(nmol/mg·prot)SOD/(u/mg·prot)GSH/(nmol/mg·prot)CON组Dex组LPS组D + L组F 值P 值1.11±0.27 1.25±0.24 2.60±0.32①1.85±0.26②49.576 0.000 127.41±17.22 126.21±15.98 56.58±6.80①97.79±8.42②52.816 0.000 26.72±4.62 23.60±4.74 9.75±2.29①16.50±3.02②31.614 0.000
2.4 各组小鼠海马CA1区病理变化
HE 染色结果显示,CON 组和Dex 组海马CA1 区神经元结构完整,排列整齐,核染色清晰;LPS 组海马CA1 区神经元数量减少,排列紊乱,大量细胞染色加深、核固缩;D+L 组海马CA1 区上述病理改变较LPS 组减轻,受损细胞明显减少。见图1。

图1 各组小鼠海马CA1区病理变化 (HE染色×400)
2.5 各组小鼠海马组织HSP70 蛋白阳性表达率比较
CON 组、Dex 组、LPS 组、D + L 组小鼠海马CA1区HSP70 蛋白阳性表达率分别为(15.55±1.67)%、(17.80±3.13)%、(43.13±2.55)%、(63.63±3.17)%,经单因素方差分析,差异有统计学意义(F=285.419,P=0.000),LPS 组较CON 组升高(P<0.05),D+L 组较LPS 组升高(P<0.05),Dex 组与CON 组比较,差异无统计学意义(P>0.05)。见图2。

图2 各组小鼠海马CA1区HSP70蛋白阳性表达情况 (免疫组织化学×400)
2.6 各组小鼠海马组织HSP70 mRNA 相对表达量比较
CON 组、Dex 组、LPS 组、D+L 组小鼠海马组织HSP70 mRNA相对表达量分别为(1.03±0.29)、(1.30±0.19)、(1.97±0.11)、(3.24±0.54),经单因素方差分析,差异有统计学意义(F=73.024,P=0.000),LPS 组较CON 组升高(P<0.05),D+L 组较LPS 组升高(P<0.05),Dex 组与CON 组比较,差异无统计学意义(P>0.05)。
3 讨论
SAE 是脓毒血症最常见的器官功能障碍之一,病理机制复杂,主要表现为认知功能和意识受损。据统计,9%~71% 脓毒症患者伴有不同程度的SAE,给患者及其家庭造成极大痛苦[10]。HSP70 是细胞在应激刺激下分泌的自我保护性蛋白,细胞内的HSP70 能降低脓毒症的氧化应激水平,减少LPS 诱导的小胶质细胞活化,降低活性氧和TNF-α 生成,减少神经细胞坏死和凋亡,缓解脓毒症相关的中枢炎症与认知能力下降[5,11-13]。研究显示,Dex 对SAE具有脑保护作用,但具体作用机制不详[14]。ZHANG等[8]发现Dex 可通过上调海马组织HSP70,抑制神经元凋亡,改善脑缺血大鼠的认知障碍;LU 等[15]发现,使用常规药物联合腹腔注射Dex 进行CPR 时,显著提高了复苏大鼠的神经功能,并且证实与Dex 增加海马组织HSP70 的表达有关。这些研究提示Dex 可能通过HSP70 改善SAE 的认知功能。
海马是学习和记忆形成的重要位置,CA1 区是海马中的缺血缺氧脆弱区,与空间学习记忆密切相关,LPS 是G-杆菌细胞壁主要成分,腹腔注射后能迅速提高血清炎症因子,并诱发海马组织出现氧化应激迹象,导致神经元萎缩和降低损伤空间认知能力[16-18],因此笔者选择腹腔注射LPS 复制SAE 模型。结果显示,LPS 组小鼠腹腔注射LPS 后血清中IL-6、TNF-α 明显升高,海马组织中SOD 活性和GSH 水平降低、MDA 水平升高,海马CA1 区出现神经元损伤,并且在Morris 水迷宫实验中逃避潜伏期延长,目标象限停留时间和穿越平台次数减少,说明SAE 模型复制成功。而D + L 组预先给予Dex 降低脓毒症小鼠体内的炎症和氧化应激水平,减轻海马CA1 区的神经元损伤,缩短了逃避潜伏期,增加目标象限停留时间和穿越平台次数,说明Dex 在脓毒症中具有一定的脑保护作用,但是否与HSP70 相关尚不清楚。本研究通过qRT-PCR 和免疫组织化学实验检测了各组小鼠海马组织内HSP70 mRNA 和蛋白的表达,结果显示,与对照组比较,LPS 组小鼠海马组织HSP70 mRNA 相对表达量及蛋白阳性表达率升高,这可能与LPS 的刺激有关[19]。文献显示,LPS 暴露2~6 h 后细胞内HSP70 表达增加,但增加量相对较少并且多在12 h 后开始下降,不足以抵抗LPS 所致的损伤[20-21],故可解释LPS 组小鼠体内炎症和氧化应激水平的升高及SAE 的发生。而与LPS 组比较,D+L 组小鼠海马组织HSP70 mRNA、蛋白表达被进一步上调,说明预先腹腔注射Dex 可增加脓毒症小鼠海马内的HSP70 转录与表达。有研究发现,HSP70 能通过抑制核因子-κB,降低炎症因子释放、干扰诱导型一氧化碳合酶合成与提高核转录因子E2 相关因子2/血红素氧合酶1,减少活性氧产生,从而提高细胞应激耐受能力,减少神经细胞损伤[3,22],与本研究结果一致。因此,笔者推测Dex 可能通过上调HSP70 改善SAE 小鼠的认知功能。
综上所述,本研究初次在脓毒症模型中探讨Dex 的认知保护作用与海马组织HSP70 表达的关系,推断Dex 可能通过上调HSP70 缓解脓毒症小鼠的炎症反应和氧化应激水平,减轻海马组织损伤程度,改善脓毒症小鼠的认知障碍,为探讨Dex 脑保护的新机制提供参考。但是,本研究未就Dex 调控HSP70 表达做剂量相关性研究,且未对其具体过程进一步探究,将在后期的实验中继续补充。

