基于血清代谢组学探讨化湿定痛汤治疗大鼠膝关节骨性关节炎的机制*
朱佳威,葛海雅,耿秋东,沈默金,李楠,2
1.福建中医药大学,福建 福州 350122; 2.中医骨伤及运动康复教育部重点实验室,福建 福州 350122
膝关节骨性关节炎是一种慢性退行性骨关节疾病,以关节疼痛、肿胀、僵硬、活动受限、畸形甚至残疾为主要临床表现[1]。最新研究显示,我国症状性膝关节骨性关节炎(诊断明确,存在膝关节疼痛等症状且需要就诊)的患病率约为8.1%,且呈现出患病率逐年上升、确诊年龄逐年下降的趋势[2-3]。在临床实践中,中医药防治膝关节骨性关节炎的疗效显著。
化湿定痛汤是王和鸣教授根据我国著名中医骨伤科专家林如高的经验方化裁而来,其主要成分包括苍术、炮穿山甲、山药、五加皮、羌活、独活、当归、肉桂、甘草等。该方具有化湿散瘀、温经止痛之功,可显著改善膝关节骨性关节炎患者的临床症状。前期有关化湿定痛汤的研究表明,首先,其可通过减少滑膜组织中炎症因子白细胞介素-1β(interleukin-1β,IL-1β)、肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)分泌,降低环氧化酶-2(cyclooxygenase-2,COX-2)表达及前列腺素E2(prostaglandin E2,PGE2)合成,从而减轻关节周围组织炎症,缓解膝关节疼痛;其次,其可抑制丝裂原活化蛋白激酶(mitogen-activated protein kinase,MAPK)通路下游凋亡相关因子p53释放,从而减少软骨细胞凋亡[4-5]。但化湿定痛汤治疗膝关节骨性关节炎的具体作用机制仍不明确,有待进一步研究。
代谢组学作为近年来迅速发展的一项技术,在疾病的早期诊断、机制研究及药物研发领域得到了广泛应用[6]。因此,本研究拟通过膝关节腔注射Ⅱ型胶原酶建立大鼠膝关节骨性关节炎模型,进而对大鼠血清代谢物进行鉴定与分析,旨在挖掘重要的代谢物及代谢通路,为化湿定痛汤治疗膝关节骨性关节炎的临床应用提供依据。
1 材料
1.1 动物选取SPF级SD大鼠28只,8周龄,雌雄各半,体质量180~220 g,购自上海斯莱克实验动物有限公司,合格证号SCXK(沪)2017-0005。动物在福建中医药大学动物实验中心SPF级动物房饲养,实验动物使用许可证号SYXK(闽)2019-0007。每笼4~5只,雌雄分开饲养,环境温度20~25 ℃,湿度50%~60%,光暗循环为12 h/12 h,普通饲料喂养,自由进食和饮水。本实验由福建中医药大学动物伦理委员会审核批准,伦理审批编号:FUTCM-201928。
1.2 药物与试剂甲醇(Honeywell,货号:34741);乙腈(Honeywell,货号:34726、09676);甲酸、Ⅱ型胶原酶(SIGMA,F0507、C-6885);乌拉坦(上海源叶生物科技有限公司,货号:S11036);大鼠IL-1β ELISA试剂盒(武汉博士德生物工程有限公司,货号:EK0393)。
1.3 仪器恒温烘箱离心机(Thermo Fisher Scientific,型号:51028112、Heraeus Fresco17);旋转蒸发仪(Ika,型号:RV10V);超高效液相色谱仪、液相色谱高分辨串联质谱仪(Sciex,型号:ExionLC、TripleTOF 5600);电子天平(Sartorius,型号:BSA124S-CW);纯水/超纯水一体化系统(Merck Millipore,型号:明澈D24 UV);色谱柱(Waters,型号:ACQUITY UPLC HSS T3,1.8 μm,2.1 mm×100 mm)。
2 方法
2.1 药物制备化湿定痛汤组成包括:苍术6 g,炮穿山甲6 g,山药9 g,五加皮9 g,羌活6 g,独活6 g,当归6 g,肉桂1 g,甘草3 g,由福建中医药大学附属第三人民医院中药房提供。所有药材煎煮前用水浸泡30 min,武火煮沸后,文火煎煮30 min,过滤药液;药渣加入冷水,以同样方法煎煮并过滤药液。将两次所得药液合并,使用旋转蒸发仪进行浓缩,最终得到浓度为0.5 g·mL-1的药液,保存于4 ℃冰箱备用。
2.2 膝关节骨性关节炎动物模型制备采用膝关节腔注射Ⅱ型胶原酶[7]的方法制备膝关节骨性关节炎动物模型,具体步骤为:造模第1天和第4天,腹腔注射乌拉坦溶液(200 g·L-1)麻醉大鼠[8],屈曲大鼠膝关节,用记号笔标记膝眼位置,手持1 mL注射器垂直进入膝眼,针下有落空感则说明注射位置正确,随即注入50 μL Ⅱ型胶原酶溶液(0.4 g·L-1),注射后适当屈伸膝关节,使其充分与膝关节腔内组织接触。空白组大鼠以同样方式注射等体积生理盐水。
2.3 动物分组及给药SD大鼠适应性喂养1周后,随机分为空白组11只,造模组17只,按照“2.2”项方法进行造模。因操作不当、麻醉过量及笼内打斗等原因,造模组大鼠死亡1只,空白组大鼠死亡3只。将造模成功的16只大鼠随机分为模型组和化湿定痛汤组,每组各8只。化湿定痛汤组大鼠的灌胃剂量为4.68 mg·kg-1,由成人(70 kg)与动物体表面积换算公式[9]得出,每次灌胃前将中药水浴加热(38 ℃)20 min;空白组和模型组大鼠给予等体积生理盐水灌胃,每天1次,持续4周。
2.4 样本制备末次灌胃后2 h,腹腔注射乌拉坦溶液(200 g·L-1)麻醉大鼠,麻醉剂量为5 mL·kg-1。腹主动脉采血,静置1 h后离心(3 000 r·min-1)10 min,取上清。取20 μL血清样品,加入50%甲醇120 μL,充分震荡混匀,提取样品中的代谢物,常温静置10 min。提取液放-20 ℃冰箱过夜,使样品中的蛋白质发生沉淀。然后,提取液离心(6 000 r·min-1)20 min,留取上清液,-80 ℃冰箱中保存备用。每个血清样品各取出10 μL混合,即为质量控制(quality control,QC)样品。
2.5 ELISA检测血清IL-1β浓度严格按照试剂盒说明书进行操作,大致步骤如下:首先,配制标准品溶液和抗体工作液;然后加样(标准品和待测样品),37 ℃恒温箱中孵育90 min;继而加入工作液进行反应,PBS洗涤3次;加入TMB显色液,37 ℃避光孵育30 min,加入TMB终止液终止反应;最后在 450 nm 波长处测量光密度(optical density,OD)值,并计算血清IL-1β浓度。
2.6 液相色谱-串联质谱(LC-MS/MS)非靶向代谢组学检测
2.6.1 液相检测条件采用超高效液相色谱仪采集数据,色谱柱温度为35 ℃,流速为0.4 mL·min-1。流动相A:1%甲酸水溶液,B:乙腈(1%甲酸),梯度洗脱:0~0.5 min,5%B;0.5~7 min,5%~100%B;7~8 min,100%B;8~8.1 min,100%~5%B;8.1~10 min,5%B。
2.6.2 质谱检测条件采用液相色谱高分辨串联质谱仪以信息依赖性采集(information-dependent acquisition,IDA)模式采集数据。每个样本进行一次正离子模式采集(5 000 V)和一次负离子模式采集(-4 500 V)。在一个采集循环中(0.56 s),一级采集范围为60~1 200 Da,采集时间为150 ms;然后从一级图谱中挑选带一个正电荷或负电荷,每秒信号积累强度超过100的前12个信号离子进行二级碎裂扫描。在采集过程中,每间隔20个样本进行一次仪器准确度校正操作。同时,每间隔10个样本进行一次QC样品扫描,根据QC样品的质量差距校正整批实验的系统误差。
2.6.3 数据分析
2.6.3.1 主成分分析(principal component analysis,PCA)为了更加直观地展示各组大鼠血清代谢轮廓的差异及相似性,通过主要新变量(主成分)对各组数据进行归类,去除重复性差的样本(离群样本)和异常样本(在置信区间-Hotelling T2椭圆外的样本),由此得到的PCA模型反映了数据的原始状态,有利于把握数据的总体情况。
2.6.3.2 偏最小二乘法-判别分析(partial least squares discriminant analysis,PLS-DA)PLS-DA是一种有监督的模式识别方法,在降维的同时结合了回归模型,并通过设定适当的阈值对回归结果进行判别分析。因此,该方法不仅能揭示不同组别样本间的差异,还可以识别导致这些差异的具体变量(如化合物或生物标志物)。
2.6.3.3 差异代谢物筛选及代谢通路分析根据非靶向代谢组学差异代谢物的筛选条件:ratio≥ 2或ratio≤1/2,Qvalue≤0.05或P≤0.05,及VIP≥1,分别筛选空白组与模型组、模型组与化湿定痛汤组的血清差异代谢物。
将差异代谢物上传至KEGG网站(https://www.kegg.jp/),分别得到空白组与模型组、模型组与化湿定痛汤组的代谢通路;根据P值进行升序排序,筛选显著性排名前25的代谢通路。
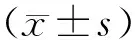
3 结果
3.1 各组大鼠血清IL-1β浓度比较与空白组比较,模型组大鼠血清IL-1β浓度显著升高(P<0.05);与模型组比较,化湿定痛汤组大鼠血清IL-1β浓度显著降低(P<0.05)。见图1。

注:与空白组比较,*P<0.05;与模型组比较,△P<0.05。 图1 各组大鼠血清IL-1β浓度比较
3.2 各组大鼠血清代谢组学分析结果
3.2.1 血清代谢物PCA结果空白组与模型组的PCA结果显示,两组样本的组内聚类情况良好且无离群值,但组间代谢轮廓差异明显,见图2。模型组与化湿定痛汤组的PCA结果显示,两组样本的组内聚类情况良好且无离群值,但组间代谢轮廓差异较大,见图3。

图2 空白组与模型组大鼠血清代谢组学数据PCA得分图
3.2.2 血清代谢物PLS-DA结果将空白组与模型组进行对比并建立回归模型,两组数据区分明显,见图4。经200次置换检验后,Q2在纵轴上的截距为-0.701,表明该PLS-DA模型可靠且不会过度拟合,见图5。将模型组与化湿定痛汤组进行对比并建立回归模型,两组数据区分明显,见图6。经200次置换检验后,Q2在纵轴上的截距为-0.615,表明该PLS-DA模型可靠且不会过度拟合,见图7。由此说明,空白组与模型组、模型组与化湿定痛汤组之间可能存在差异代谢物,有必要进一步筛选。

图3 模型组与化湿定痛汤组大鼠血清代谢组 学数据PCA得分图

图4 大鼠血清代谢组学数据PLS-DA得分图

图5 空白组与模型组大鼠血清代谢组学数据 200次置换检验图
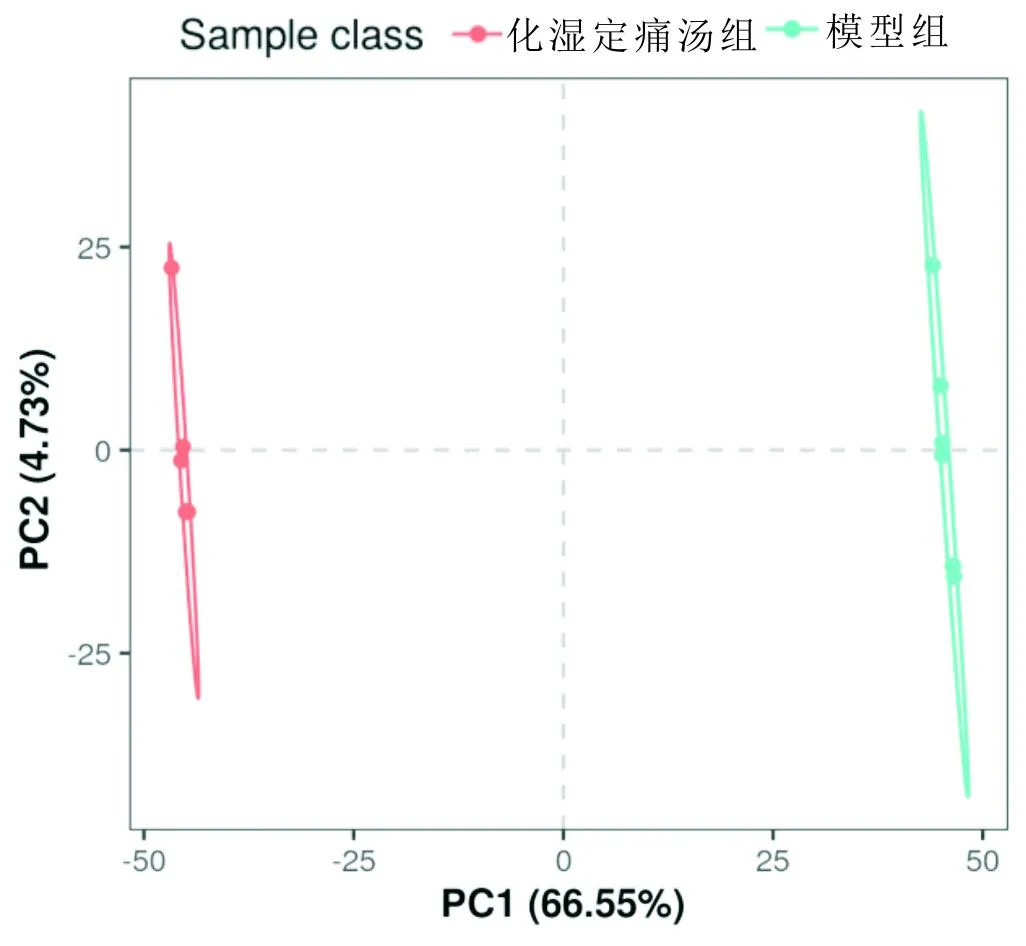
图6 模型组与化湿定痛汤组大鼠血清代谢组 学数据PLS-DA得分图
3.2.3 血清差异代谢物与空白组比较,模型组大鼠血清中筛选出93个差异代谢物,其中60个代谢物上调,33个代谢物下调。这些差异代谢物大致可以分为4类,即脂类及类脂分子(44个代谢物)、有机酸及其衍生物(14个代谢物)、有机杂环化合物(12个代谢物),其他(23个代谢物)。
与模型组比较,化湿定痛汤组大鼠血清中筛选出122个差异代谢物,其中72个代谢物上调,50个代谢物下调。这些差异代谢物大致可分为4类,即脂类及类脂分子(56个代谢物)、有机酸及其衍生物(25个代谢物)、有机杂环化合物(11个代谢物),其他(30个代谢物)。

图7 模型组与化湿定痛汤组大鼠血清代谢组学 数据200次置换检验图
将空白组与模型组、模型组与化湿定痛汤组的差异代谢物进行比对发现,三组共同调控28个差异代谢物,包括熊去氧胆酸、苯甲醇、精氨酸、对甲酚硫酸盐、苯乙酰甘氨酸、尿囊酸、甘氨胆酸钠、川陈皮素、癸二酸、谷氨酰胺、皮质酮、2-哌啶酮、硫酸吲哚酚等,见表1。
3.2.4 血清代谢通路富集分析将空白组与模型组的差异代谢物进行代谢通路分析,并筛选显著性排名前25的通路,包括谷胱甘肽代谢、生物素代谢、类固醇生成、谷氨酸代谢、胆汁酸合成、脂肪酸代谢、酮体代谢、鸟氨酸循环、亚麻酸和亚油酸代谢以及肉碱合成等通路,见图8。

图8 空白组与模型组大鼠血清差异代谢物富集通路分析
将模型组与化湿定痛汤组的差异代谢物进行代谢通路分析,并筛选显著性排名前25的通路,包括类固醇生成、亚麻酸和亚油酸代谢、鸟氨酸循环、天冬氨酸代谢、葡萄糖-丙氨酸循环、谷氨酸代谢、丙氨酸代谢及肉碱合成等通路,见图9。

图9 模型组与化湿定痛汤组大鼠血清差异 代谢物富集通路分析
将空白组与模型组、模型组与化湿定痛汤组的代谢通路进行比对发现,三组共同富集的代谢通路有6条,即类固醇生成、鸟氨酸循环、谷氨酸代谢、丙氨酸代谢、亚麻酸和亚油酸代谢以及肉碱合成通路。
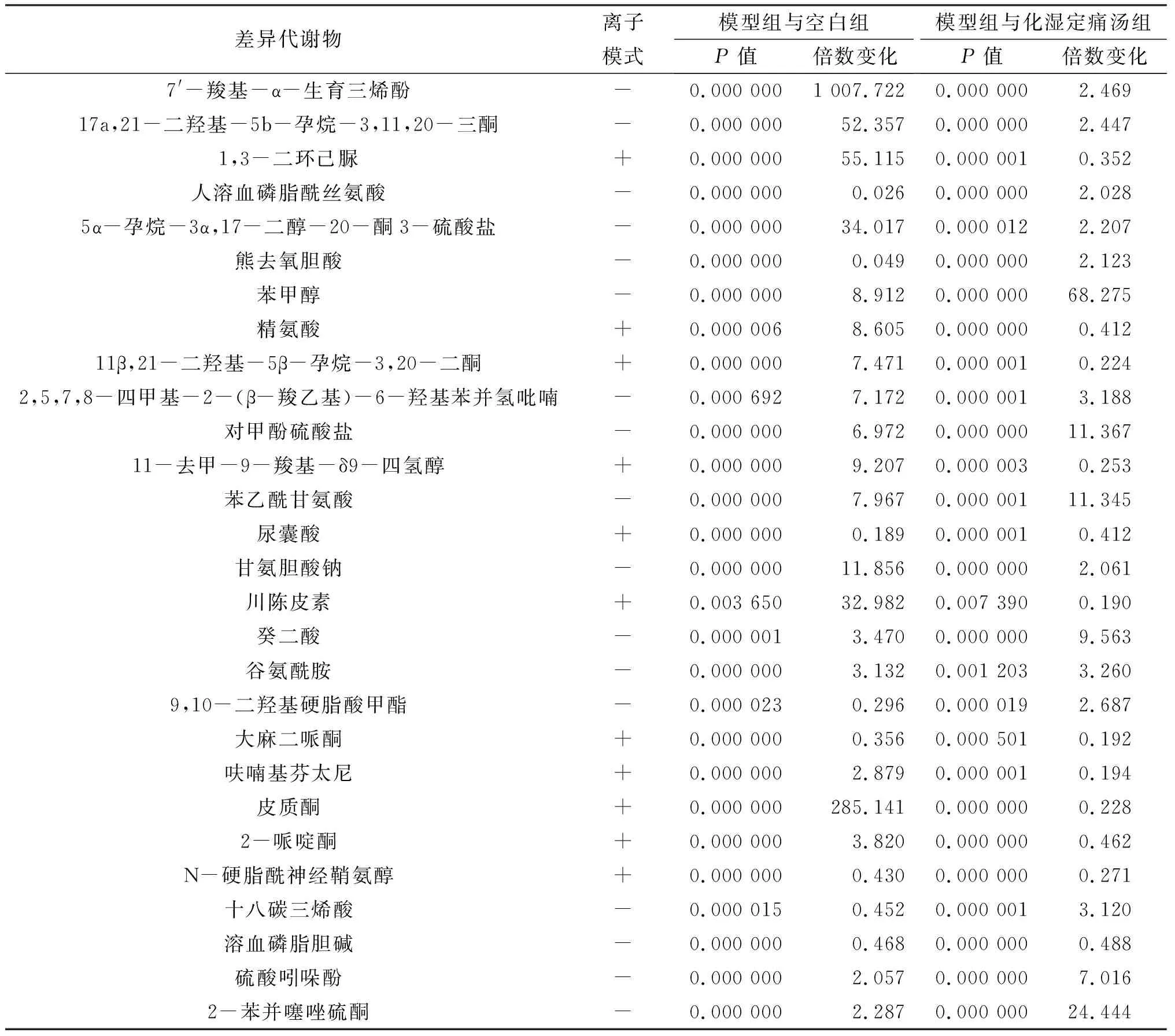
表1 各组大鼠血清差异代谢物鉴定与分析
4 讨论
IL-1β属于白细胞介素-1家族,是一种经典的促炎细胞因子,参与多种自身免疫性炎症反应及细胞生理活动,如细胞增殖、分化和凋亡[10-11]。大量研究证实,IL-1β在髋关节和膝关节骨性关节炎中发挥着重要作用[12-13]。IL-1β对软骨细胞的影响主要表现为上调分解代谢、抑制合成代谢以及诱导炎症因子合成[14]。此外,IL-1β可通过提高Bax和caspase水平诱导软骨细胞凋亡[15]。Wang等[16]研究发现,暴露于IL-1β的软骨细胞表现出显著的死亡或坏死特征。该研究亦证实,IL-1β能显著下调CHON-001细胞中Ⅱ型胶原蛋白和聚集蛋白水平,同时显著上调基质金属蛋白酶13(matrix metalloproteinase 13,MMP-13)水平,从而说明IL-1β可导致软骨细胞基质降解。本研究中,模型组大鼠血清IL-1β浓度显著升高,而化湿定痛汤可显著下调IL-1β浓度,从而延缓软骨退变。
研究发现,化湿定痛汤能够干预类固醇生成途径。类固醇激素是一类重要的调节分子,主要在肾上腺、卵巢和睾丸中合成,他们对类固醇性刺激作出反应,调节生长发育并驱动多种生理过程,如生殖和代谢[17]。自噬可对储存的前体胆固醇及其后续运输过程发挥关键作用,进而调控类固醇生成过程,这表明自噬与胆固醇稳态之间存在联系[18]。作为一种细胞内稳态机制,自噬已成为骨关节炎研究领域的热点。研究表明,软骨细胞可能通过激活自噬程序来抑制细胞凋亡[19-20]。化湿定痛汤可能通过调节类固醇生成途径治疗膝关节骨性关节炎,但其是否通过干预自噬过程参与调节,尚需进一步研究。
皮质酮是由肾上腺皮质分泌的一种激素,本研究发现,模型组大鼠血清皮质酮水平显著升高,而化湿定痛汤的干预起到明显的抑制作用。研究显示,在骨性关节炎中,软骨细胞基质丢失是一个关键的病理变化[21]。皮质酮可以促进糖皮质激素受体易位进入细胞核,并与11β-羟基类固醇脱氢酶2(11β-HSD2)的启动子区域结合,从而影响软骨细胞基质的生成[22]。因此,化湿定痛汤可能通过调节皮质酮水平,发挥其在膝关节骨性关节炎治疗中的作用。
熊去氧胆酸(ursodeoxycholic acid,UDCA)是一种天然存在的二羟基亲水性胆汁酸,目前被广泛用于治疗多种肝脏疾病,包括原发性胆汁性肝硬化[23]。研究显示,UDCA的作用机制涉及免疫调节、抗氧化作用等[24-25]。骨性关节炎的进展与氧化应激、活性氧的产生密切相关[26-27]。研究证实,口服UDCA可减轻骨关节炎动物模型的疼痛症状和软骨丢失情况,并缓解软骨下骨的氧化应激反应[28]。UDCA的软骨保护作用可能是通过抑制促炎细胞因子分泌和减弱软骨细胞的分解代谢活性来实现的。本研究发现,模型组大鼠血清UDCA水平降低,而化湿定痛汤能够回调UDCA水平,说明UDCA可能是化湿定痛汤治疗膝关节骨性关节炎的作用靶点之一。
对甲酚硫酸盐(p-Cresol sulfate,PCS)是一种可与蛋白质结合的尿毒症毒素,由肝脏和肠道菌群通过酪氨酸、苯丙氨酸的代谢产生。PCS因其高白蛋白结合能力,被认为是慢性肾病临床并发症的潜在因素[29-30]。多项研究表明,PCS可导致细胞死亡和功能障碍,其机制主要与氧化应激反应和炎症反应有关。研究显示,在前额叶皮质中,PCS能够增加促炎细胞因子(如IL-1β、JNK、p38、p65、NF-κB和AP-1)的表达和活性,同时降低循环脑源性神经营养因子(brain-derived neutotrophic factor,BDNF)和5-羟色氨水平,增加皮质酮含量[31-32]。本研究发现,化湿定痛汤显著下调大鼠血清PCS水平,这可能是化湿定痛汤组大鼠血清促炎细胞因子水平降低的原因之一。
综上,本研究采用LC-MS/MS非靶向代谢组学技术探讨化湿定痛汤对膝关节骨性关节炎模型大鼠的治疗作用及机制。PCA和PLS-DA结果显示,各组样本的聚类情况良好,但组间代谢轮廓差异较大。通过鉴定与筛选,最终确定了28个显著性差异代谢物;随后,对差异代谢物进行代谢通路分析,结果表明化湿定痛汤可能通过调控这些差异代谢物及干预类固醇生成、鸟氨酸循环、谷氨酸代谢等代谢通路从而发挥治疗膝关节骨性关节炎的作用。本研究为探索化湿定痛汤治疗膝关节骨性关节炎的作用机制提供了新的靶标和思路。

