基于JAK/STAT通路探讨益气温阳护卫法干预支气管哮喘大鼠防御素水平的机制*
曹邦卿,吴支喜,曾丽珍,易卫环
江西中医药大学第二附属医院,江西 南昌 330012
支气管哮喘是一种常见的慢性气道炎症性疾病,其发病受季节变化的影响,主要病变部位位于气道及两侧肺叶。患者表现为喘息、气急和胸闷等症状,病情反复发作,尤其在夜间或清晨发作频率较高。近年来,我国支气管哮喘发病率呈现持续上升态势,该病临床尚无特效治疗方法,严重危害患者健康[1-2]。
目前,支气管哮喘的发病机制尚未完全明确。现有研究认为,多条信号转导通路参与了支气管哮喘的发病过程。其中,Janus激酶(Janus kinase,JAK)/信号转导子和转录激活子(signal transducer and activator of transcription,STAT)通路在细胞免疫、生长和分化等方面发挥重要作用,成为当前研究较为关注的途径[3-4]。防御素是一种阳离子多肽,作为机体免疫系统的关键组成部分,其在功能上与中医理论中的“卫气”表现出显著相似性。益气温阳护卫法由洪广祥教授提出,并在临床广泛应用,研究表明,其可增强呼吸道防御机能和免疫调节能力,同时降低气道反应性。该法在临床防治支气管哮喘方面取得了显著成效,但其与防御素之间的关联研究相对不足[5-6]。因此,本研究旨在基于JAK/STAT信号通路探讨益气温阳护卫法干预支气管大鼠防御素水平的机制。
1 材料
1.1 动物选取SPF级雄性SD大鼠50只,体质量 200~220 g,购自北京维通利华实验动物技术有限公司,动物生产许可证号:SCXK(京)2021-0011。所有大鼠饲养于清洁级动物房内,温度18~25 ℃,相对湿度60%~70%,12 h/12 h明暗交替,动物自由进食和饮水。本实验经江西中医药大学第二附属医院伦理委员会批准,伦理审批号:JXKY2388456。
1.2 药物与试剂卵清蛋白(ovalbumin,OVA)、氢氧化铝(Sigma公司,货号:SLCD9242、239186);白细胞介素-4(interleukin-4,IL-4)酶联免疫试剂盒(联科生物科技有限公司,货号:230430316);干扰素γ(interferon gamma,IFN-γ)酶联免疫试剂盒(武汉华美生物技术有限公司,货号:A30015209);反转录试剂盒(日本TaKaRa公司,货号:RR037A);超纯RNA提取试剂盒(北京康为世纪生物科技有限公司,货号:W0581M)。
1.3 仪器402型超声雾化器(上海鱼跃医疗设备有限公司);Rea1-time PCR仪(美国ABI公司,型号:ABI PRISM7100);高速低温离心机(BECKMAN公司,型号:J-6、J-2);多功能酶标仪(MDC公司,型号:SPECTRAMAX M5);-80 ℃超低温冰箱(美国Forma Scientific公司,型号:8525)。
2 方法
2.1 药物制备益气温阳护卫汤:黄芪200 g,白术、防风、淫羊藿各150 g,桂枝、白芍、生姜、大枣、仙茅各100 g,炙甘草50 g,由江西中医药大学第二附属医院提供。所有药材加入8倍量水浸泡30 min,煎煮 60 min 后过滤药汁;剩余药渣加6倍量水煎煮 40 min,过滤药汁;将两次药汁合并后浓缩,调至生药浓度为2 g·mL-1的溶液,存放于4 ℃冰箱中备用。
2.2 大鼠支气管哮喘模型制备造模第1天,大鼠腹腔注射1 mL抗原液(含10 mg卵清蛋白和100 mg氢氧化铝)致敏,并于造模第2天、第3天、第8天以相同剂量重复注射;第15天将大鼠放在特制的透明玻璃容器中,采用超声雾化器以1% OVA进行雾化吸入激发,每次30 min,每天1次,持续14 d。大鼠弓背蜷缩在雾化箱角落,出现明显烦躁不安,呼吸急促,抓耳挠腮,打喷嚏,躲避远离雾化出气口,口唇发绀等表现,提示支气管哮喘模型复制成功。
2.3 动物分组及给药50只SD大鼠随机分为正常组、模型组及益气温阳护卫汤低剂量组(5 g·kg-1)、中剂量组(10 g·kg-1)、高剂量组(20 g·kg-1),每组10只。正常组:以生理盐水(1 mL)替代抗原液进行腹腔注射,后续不进行雾化激发;模型组和各药物组:采用“2.2”项方法进行造模。造模成功后的第8天开始灌胃,各药物组给予相应剂量的益气温阳护卫汤,正常组和模型组给予等体积生理盐水,每天2次,持续4周。
2.4 样本制备
2.4.1 血清和肺组织制备末次灌胃后2 h采集样本,腹腔注射水合氯醛麻醉大鼠,腹主动脉采血,1 500 r·min-1离心,取上清,保存在-80 ℃冰箱中备用;分离大鼠肺组织,-80 ℃保存备用。
2.4.2 肺泡灌洗液制备腹腔注射水合氯醛麻醉大鼠,将大鼠仰卧位固定于操作台,在颈部正中作 1 cm 切口,钝性分离颈部软组织并充分暴露气管;注射器抽取无菌冰PBS,沿气管缓慢注入肺内,可见胸廓扩张;注射结束开始计时,2 min后将大鼠调整为足高头低位;重复灌洗3次后,用注射器缓慢回抽,收集肺泡灌洗液,4 ℃离心(3 000 r·min-1)10 min,收集上清液,-80 ℃保存备用。
2.5 ELISA检测血清IFN-γ、IL-4水平严格按照试剂盒说明书进行操作,采用酶联免疫吸附实验检测各组大鼠血清IFN-γ、IL-4水平。
2.6 RT-PCR检测肺组织β-防御素(human beta-defensin,HBD-1、HBD-2、HBD-3、HBD-4)mRNA、JAKmRNA、STAT6mRNA表达水平严格按照试剂盒说明书操作,采用Trizol法提取肺组织总RNA,随后反转录合成cDNA,采用SYBR Green进行实时荧光定量PCR检测,实验重复3次。引物通过Bio-Rad CFX Manager软件设计,由上海生工生物技术有限公司合成,内参基因选择GAPDH。目的基因的相对表达水平根据2-△△CT法算出,引物序列见表1。

表1 引物序列
2.7 瑞士染色法检测肺泡灌洗液免疫细胞水平取肺泡灌洗液,在4 ℃条件下离心5 min(2 000 r·min-1),去除上清液,取少许细胞沉淀,使用瑞士染液染色,100×10油镜下计数中性粒细胞、嗜酸性粒细胞、巨噬细胞和淋巴细胞水平。
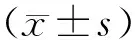
3 结果
3.1 各组大鼠肺组织β-防御素基因表达水平与正常组比较,模型组和各药物组大鼠肺组织β-防御素基因表达水平升高(P<0.05);与模型组比较,各药物组肺组织β-防御素基因表达水平降低(P<0.05);各药物组肺组织β-防御素基因表达水平比较,差异无统计学意义(P>0.05)。见表2。
3.2 各组大鼠血清IFN-γ、IL-4水平比较与正常组比较,模型组和各药物组大鼠血清IFN-γ水平降低(P<0.05);与模型组比较,各药物组血清IFN-γ水平升高(P<0.05)。与正常组比较,模型组和各药物组大鼠血清IL-4水平升高(P<0.05);与模型组比较,各药物组IL-4水平降低(P<0.05)。各药物组血清IFN-γ、IL-4 水平比较,差异无统计学意义(P>0.05)。见表3。

表2 各组大鼠肺组织β-防御素基因表达水平比较

表3 各组大鼠血清IFN-γ、IL-4 水平比较
3.3 各组大鼠肺组织JAKmRNA、STAT6mRNA表达水平比较与正常组比较,模型组和各药物组大鼠肺组织JAKmRNA、STAT6mRNA表达水平升高(P<0.05);与模型组比较,各药物组肺组织JAKmRNA、STAT6mRNA表达水平降低(P<0.05);各药物组肺组织JAKmRNA、STAT6mRNA表达水平比较,差异无统计学意义(P>0.05)。见表4。

表4 各组大鼠肺组织JAK mRNA、STAT6 mRNA 表达水平比较
3.4 各组大鼠肺泡灌洗液免疫细胞水平比较与正常组比较,模型组和各药物组大鼠肺泡灌洗液的中性粒细胞、嗜酸性粒细胞、巨噬细胞和淋巴细胞水平升高(P<0.05);与模型组比较,各药物组肺泡灌洗液的中性粒细胞、嗜酸性粒细胞、巨噬细胞和淋巴细胞水平降低(P<0.05);各药物组肺泡灌洗液中性粒细胞、嗜酸性粒细胞、巨噬细胞和淋巴细胞水平比较,差异无统计学意义(P>0.05)。见表5。
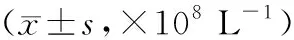
表5 各组大鼠肺泡灌洗液免疫细胞水平比较
4 讨论
中医学并无支气管哮喘这一病名,根据其症状可归属于“喘证”“哮证”等范畴,经过长期探索积累了丰富的临床辨治经验。从中医理论角度分析,本病是由外感寒邪,肺脏功能失调,导致肺气宣降失司,痰饮积聚气道,浊气难以消散而成。气阳虚弱是支气管哮喘发病的关键因素,益气温阳护卫法是基于“气阳虚弱、卫气不固”的理论而设立。该方法着重于调补肾、脾、肺之气阳虚弱,旨在增强呼吸道防御和免疫调节能力。研究表明,益气温阳护卫法治疗支气管哮喘具有显著疗效,但其具体作用机制仍不明确[7-9]。
目前普遍认为,辅助型T细胞1(T helper 1 cell,Th1)/辅助型T细胞2(T helper 2 cell,Th2)失衡,即Th1型免疫反应异常减弱,Th2型免疫反应异常增强,是支气管哮喘发病的重要机制。因此,调节Th1/Th2失衡对于支气管哮喘的防治策略具有重要意义。支气管哮喘的发病机制涉及多条信号转导通路,这些通路分别对炎症因子、细胞因子以及黏液分泌相关因子的产生和活性进行调控。JAK/STAT信号通路在支气管哮喘的发生与发展过程中发挥着关键作用[10-11],该通路包括JAKs家族和STATs家族。其中,JAKs是一种蛋白酪氨酸激酶,在生物体内广泛表达;当任意一个JAKs家族成员被激活,均可引起STAT家族的一个或多个成员发生磷酸化。JAK/STAT通路对支气管哮喘发病机制的影响主要体现在STAT6环节,即STAT6与受体二聚体结合后,经JAK1催化磷酸化激活,形成同源或异源二聚体。在含有核定位信号肽段的小分子蛋白协助下,二聚体转移至细胞核,进而调控基因转录[12-14]。支气管黏膜中Th2型细胞合成的炎症介质能够激活JAK/STAT通路,引发大量黏液分泌,加剧支气管哮喘进展。支气管哮喘是一种气道慢性炎症性疾病,涉及中性粒细胞、嗜酸性粒细胞等多种细胞,上述免疫细胞通过JAK/STAT信号通路传递信息,诱导气道高反应性[15-17]。
防御素是一种抗菌肽,构成了机体抵御外部病原微生物侵袭的第一道化学屏障,具有免疫调节、细胞趋化等作用,是机体免疫系统的重要组成部分[18]。防御素主要分布于脊椎动物的黏膜、皮肤等上皮组织,其中β-防御素作为阳离子性极强的小分子抗菌肽,具有调节免疫、抗病毒活性及广谱抗菌等功能。呼吸道上皮细胞分泌的抗菌肽在防御微生物入侵过程中发挥重要作用,构成了上皮组织的天然防御屏障[19-20]。研究表明,β-防御素可诱导辅助型T淋巴细胞向Th2转化,从而调整Th1/Th2细胞平衡,减少白细胞介素1α(interleukin 1α,IL-1α)等促炎细胞因子分泌,进而增强机体免疫功能[21-22]。另外,作为Th1、Th2的特征性细胞因子,IFN-γ、IL-4水平正常,有助于气道Th1/Th2亚群平衡,从而降低气道炎症反应[23-24]。余建玮等[25]发现,支气管哮喘大鼠肺组织的防御素基因表达水平升高,经益气温阳护卫法治疗后,防御素基因表达水平显著降低,这与本研究的结果一致。因此,益气温阳护卫法可减轻支气管哮喘大鼠的气道炎症,其机制可能与调节防御素表达水平有关。
《素问·痹论》有云:“卫者,水谷之悍气也。”卫气,即运行于脉外皮肤、肌肉之间的气,具有防御外邪侵袭、护卫肌表及温养皮毛、肌肉、脏腑等组织器官的功能[26-27]。β防御素在调节机体炎症反应、介导免疫反应方面具有较强作用,与中医理论中的“卫气”具有相似之处。益气温阳护卫汤通过改善机体卫气不固、阳气虚弱的证候,激发其自我防御机制,增强β防御素表达水平,从而缓解炎症因子对呼吸系统的损伤[28-29]。益气温阳护卫汤中,黄芪补中益气,白术健脾益气,防风疏风解表,淫羊藿、仙茅温补肾阳,桂枝温经通脉、助阳化气,白芍平肝潜阳、养血调经,生姜温中止呕、解表散寒、止咳化痰,大枣益气养血,炙甘草调和诸药,全方共奏益气温阳之效。药理学研究表明,黄芪具有抗炎、增强机体免疫等作用;淫羊藿可增强吞噬细胞功能,发挥显著的抗感染作用;防风具有抗炎、抗菌、解热、提高免疫力等作用。
综上所述,益气温阳护卫法可减轻支气管哮喘大鼠气道炎症反应,降低β-防御素基因表达水平,其机制可能与调节JAK/STAT信号通路有关。

