鱼腥藻响应温度胁迫的形态及生理策略
肖湘玥,韩雯睿,于晓涵,肖艳
(1.中国科学院大学,北京 100049;2.中国科学院 重庆绿色智能技术研究院,重庆 400714)
蓝藻水华事件在世界范围内呈现出大范围、高频次、高生物量等特征,引起水生生态系统结构和功能的失衡进而对人类健康产生直接或间接的影响[1].全球气候变化将进一步加剧淡水系统中有害蓝藻水华暴发的频率和危害性[2].温度升高是气候变化最显著的特征,是影响蓝藻生理、形态和生长的关键因素之一,可直接影响藻细胞内代谢活动的正常进行[3].已有研究表明,温度对蓝藻的光合活性、呼吸速率以及生长速率产生影响[4],同时与参与蓝藻生理活动的重要酶活性、膜流动性密切相关[5];温度对蓝藻的影响还包括藻细胞形态、胞内生物大分子的合成、胞外有机物释放以及信号传导系统等[6].
全球持续升温,导致水生系统中蓝藻优势的增强[7].藻类内部功能特性的调节是蓝藻得以维持优势的重要机制[8].这些功能特性包括形态策略、光合作用、营养吸收、运动性、休眠体等[9].蓝藻应对温度的胁迫并拥有广泛的温度耐受范围,与其独特的生理和形态特性有关[10].鱼腥藻在水生态系统中分布广泛[11-12].有研究报道,鱼腥藻和微囊藻可通过调节自身生理、形态特性以适应温度的变化[4].CHALIFOUR等[6]研究亦发现,随着温度的升高,丝状蓝藻形态对温度变化敏感.目前研究认为,蓝藻改变形态策略的机制主要包括两个方面,一个是细胞分裂生长聚集变大[13],另一个是细胞通过外部多糖包裹而黏附在一起[14].胶被是包裹于蓝藻细胞或藻丝或群体外的黏稠状外层,可作为屏障抵御外界胁迫,是蓝藻适应性策略的重要功能性结构.胶被含有多糖或蛋白质,其含量随温度升高而增加[15].MORENO等[16]研究发现随温度升高,鱼腥藻胶被多糖含量显著升高.AARONSON[17]认为低温能够增加碳水化合物细胞配额,可能导致胶被的多糖含量增加.然而,鱼腥藻如何调节自身的形态及生理特性以支撑其适应温度变化的机制仍未明晰,有待深入探索.基于此背景,本研究选取水华蓝藻常见优势属鱼腥藻为研究对象,探讨不同温度对鱼腥藻的形态、群体大小及其生理特性的影响,为深入了解在全球气候变化背景下,蓝藻在淡水水体中长期占据优势的机理提供依据.
1 材料与方法
1.1 藻种及培养条件
鱼腥藻FACHB-82 (Anabaenasp. FACHB-82)购于中国科学院淡水藻种库(1957年7月18日武昌宝积庵华农场水稻田分离得到).中国主要湖库如太湖、巢湖、滇池和三峡水库,大部分时间水温在35 ℃以下,但部分年份盛夏可超过35 ℃[18-21].本课题组前期研究也发现,鱼腥藻FACHB-82在35 ℃培养时并未有明显的胁迫抑制[22],因此本研究设计了10、25、35、40 ℃的温度梯度进行实验.藻种常规培养以BG11为基础培养基,培养温度(25±1) ℃,光照强度2 000 lx,光暗周期12L∶12D.当鱼腥藻培养至对数期,离心后加入新鲜的培养液转移至250 mL三角瓶中,放在实验设置的温度梯度10、25、35、40 ℃下继续培养,温度25 ℃为对照组.每天将样品手动摇匀4次,分别在0、1、2、3、5、7、9 d的同一时间取样进行后续指标测定.
1.2 叶绿素a和比生长速率测定
取4 mL藻液4 ℃离心(8 000 r/min,5 min),去上清液后加入等体积的体积分数95%乙醇充分重悬,用铝箔纸包裹后在4 ℃避光提取36 h,后离心(8 000 r/min,4 ℃,5 min)取上清液,以体积分数95%乙醇作参比,分别读取649 nm、665 nm波长处的吸光度,根据公式:C叶绿素a=13.7A665-5.76A649计算[23].
比生长速率μ根据指数生长期的叶绿素含量得到,计算公式为[24]:
式中,Nn为对数生长期末期第n天藻液的叶绿素a的质量浓度,μg/mL;N1为对数生长期初始叶绿素a的质量浓度,μg/mL;tn、t1为对数生长期培养时间,d-1.
1.3 藻液干重测定
取对数生长期的藻液10 mL,将藻液用GF/F滤膜(Whatman,UK)抽滤,滤膜提前烘干至恒质量并记录W0(mg),后将滤有藻样的滤膜置于通过冷冻干燥器(Biocool Lab-1A-50E,China)进行冷冻干燥,直至藻粉冷冻干燥至恒质量,记录Wt(mg).生物量为X(g/L)按下面公式进行计算:
1.4 光合活性测定
本实验通过浮游植物荧光分析仪PHYTO-PAM(Walz GmbH,Germany)调制叶绿素荧光测量该参数,将每个平行藻样2 mL置于黑暗条件下暗适应5 min后测定荧光.叶绿素荧光参数Fv/Fm用于表征PS Ⅱ反应中心光能的最大光化学效率,可反映藻细胞光合活性强弱[25].叶绿素荧光参数按下面公式进行计算:
Fv/Fm=(Fm-F0)/Fm,
式中,Fm和F0表示PS Ⅱ适应黑暗阶段的最大和最小荧光值,Fv表示两者之差.
1.5 形态测量和计算

1.6 胶被和溶解态、胞内多糖的测定
取藻液20 mL,10 000 r/min 离心10 min,经0.22 μm醋酸纤维膜过滤,上清液进行胞外溶解态多糖(soluble exopolysaccharide,SL-EPS)的测定.藻细胞沉淀重悬于等体积0.01 mol/L NaOH溶液中,50 ℃水浴加热并不断搅拌10 min,加热结束后放置于室温中冷却,以5 000 r/min在4 ℃下离心10 min,上清液经0.22 μm醋酸纤维膜过滤后进行胶被多糖含量的测定[27],取沉淀物进行胞内多糖含量的测定.采用苯酚-硫酸法测定多糖含量.多糖含量与藻液干质量含量的比值可定义为单位生物量内多糖的含量.
1.7 统计方法
所有实验设置3个平行,数据用平均值±标准偏差表示.采用Origin 2023方差分析(TukeyHSD)和多重比较进行统计分析,P≤0.05为显著性差异,P≤0.01为极显著差异.不同字母表示有显著差异(P≤0.05),相同字母或无上标英文字母表示无显著差异,全文图表同.
2 结 果
2.1 温度对鱼腥藻比生长速率的影响
比生长速率μ值计算的时间t均处在藻的对数生长期(图1).结果表明,10~35 ℃时,随着温度的升高,鱼腥藻的比生长速率增加.与对照组25 ℃相比,鱼腥藻FACHB-82在10 ℃培养时的比生长速率为0.026 d-1,生长受到了显著抑制(P<0.05);而在35 ℃培养时,鱼腥藻FACHB-82的比生长速率最高,为0.149 d-1;40 ℃培养时,鱼腥藻FACHB-82的比生长速率次之,为0.133 d-1.

2.2 不同温度下鱼腥藻的光合活性
在低温10 ℃培养时,鱼腥藻FACHB-82的光合活性在第1天显著降低,随后呈现平稳趋势,Fv/Fm在培养结束时和初始值相比降低了77.98%(图2).与对照组25 ℃相比,鱼腥藻FACHB-82在高温35 ℃和40 ℃培养时,光合活性都显著增加,其Fv/Fm值在培养前后分别增加了21.74%和4.36%.总的来说,随着培养温度的升高,鱼腥藻FACHB-82的光合活性先升高后降低,最佳光合活性温度为35 ℃.
2.3 不同温度下鱼腥藻形态变化
在9 d的不同温度培养后,通过比较鱼腥藻的群体大小近似球型直径(equivalent spherical diameter,ESD)表明:鱼腥藻FACHB-82群体直径中位数初始值为321.48 μm.在10 ℃培养后,鱼腥藻FACHB-82群体直径中位数在培养结束时和初始值相比减少52.97%(图3(a)).在25 ℃条件下处理后,鱼腥藻FACHB-82群体直径中位数在培养前后增加3.33%.在35 ℃条件下处理后,鱼腥藻FACHB-82群体直径中位数在培养前后减少14.85%.在40 ℃条件下处理后,鱼腥藻FACHB-82群体直径中位数在培养前后减少15.05%.如图3(b),不同温度培养9 d后,10 ℃鱼腥藻群体比表面积显著大于25 ℃组(P<0.05),35、40 ℃培养组鱼腥藻比表面积略大于25 ℃组.
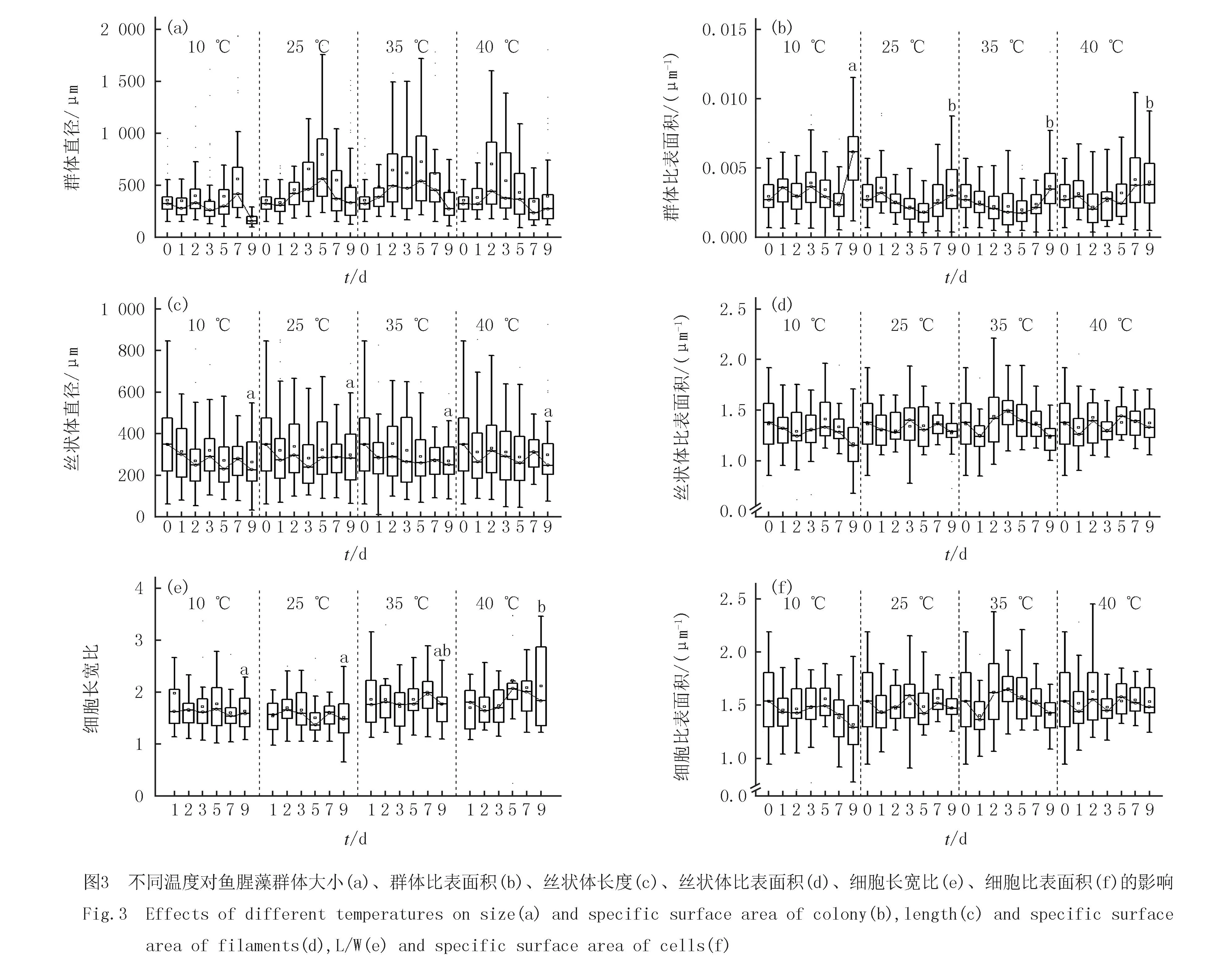
从图3(c)可以看出,鱼腥藻藻丝长度在不同温度组之间不存在显著差异(P>0.05).在培养第9天,25 ℃藻丝长度最长,中位数为282.7 μm.10 ℃藻丝长度最短,中位数为221.88 μm.35 ℃培养时丝状体中位数为251.16 μm.40 ℃培养时丝状体中位数为247.7 μm.在培养第9天,10、25、35和40 ℃的中位数SV-fialments为1.24 μm-1、1.29 μm-1、1.29 μm-1、1.33 μm-1(图3(d)).综上所述,高温(35 ℃、40 ℃)或低温(10 ℃),藻丝长度变短.温度越高,藻丝比表面积倾向于更大.
单细胞长/宽(L/W)是评价温度对单细胞影响的重要形态指标(图3(e)).在培养周期中,发现在35 ℃、40 ℃培养时,L/W显著增加(P<0.05),这表明温度升高在一定程度上缩小单个藻细胞宽度并延长其长度.10 ℃和25 ℃培养时鱼腥藻FACHB-82藻细胞L/W无显著差异(P>0.05).从图3(f)可知,在不同温度下,SV-fialments和SV-cell变化规律相同,在培养第9天,10、25、35和40 ℃的中位数SV-cell为1.29 μm-1、1.47 μm-1、1.43 μm-1、1.48 μm-1.
2.4 不同温度下鱼腥藻溶解态多糖、胶被多糖及胞内多糖变化
培养0~7 d时,各温度培养的鱼腥藻FACHB-82胞内多糖无明显区别(P>0.05);在培养第9天,40 ℃培养时鱼腥藻FACHB-82胞内多糖明显高于其他各培养温度组(P<0.05)(图4(a)).培养0~7 d时,相对于25 ℃处理组,鱼腥藻FACHB-82在10 ℃培养时,分泌更多的胞外多糖(溶解态多糖与胶被多糖之和,extracelluar polysaccharide,EPS)(图4(b)),而在其他高温条件下,鱼腥藻FACHB-82分泌胞外多糖无显著差异.对于SL-EPS,各温度培养下的鱼腥藻FACHB-82在前7 d分泌的SL-EPS无显著性差异(P>0.05),而在实验末期,鱼腥藻FACHB-82在40 ℃培养下的SL-EPS显著高于其他温度组(P<0.05).对于胶被多糖,10 ℃培养时,鱼腥藻FACHB-82胶被多糖含量显著增加,且高于25 ℃组(P<0.05);在实验末期,鱼腥藻FACHB-82在25 ℃培养条件下产生最多的胶被多糖,其次是10 ℃组,而随着温度进一步升高,鱼腥藻FACHB-82产生的胶被多糖含量减少.
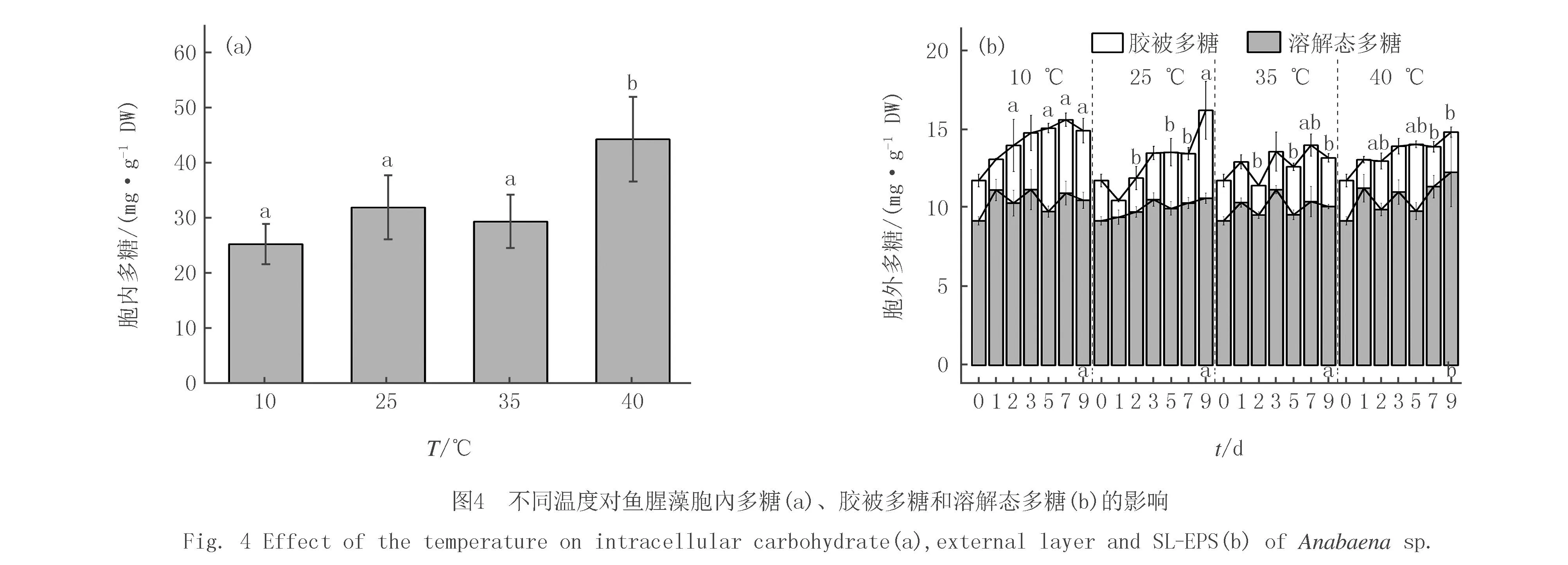
对各组分多糖比值分析发现,40 ℃培养时,鱼腥藻FACHB-82的溶解态多糖/胶被多糖的比值显著大于25 ℃组(P<0.05)(表1).35 ℃培养时,鱼腥藻FACHB-82的溶解态多糖/胶被多糖的比值略大于25 ℃组.表明高温培养时,鱼腥藻FACHB-82合成胞外多糖过程中,倾向于合成更多的SL-EPS以及更少的胶被.在10 ℃培养时,鱼腥藻FACHB-82的SL-EPS/胶被多糖的比值在3~7 d略小于25 ℃组.表明在低温培养时,鱼腥藻FACHB-82在合成胞外多糖过程中,倾向于合成更多的胶被以及更少的SL-EPS.
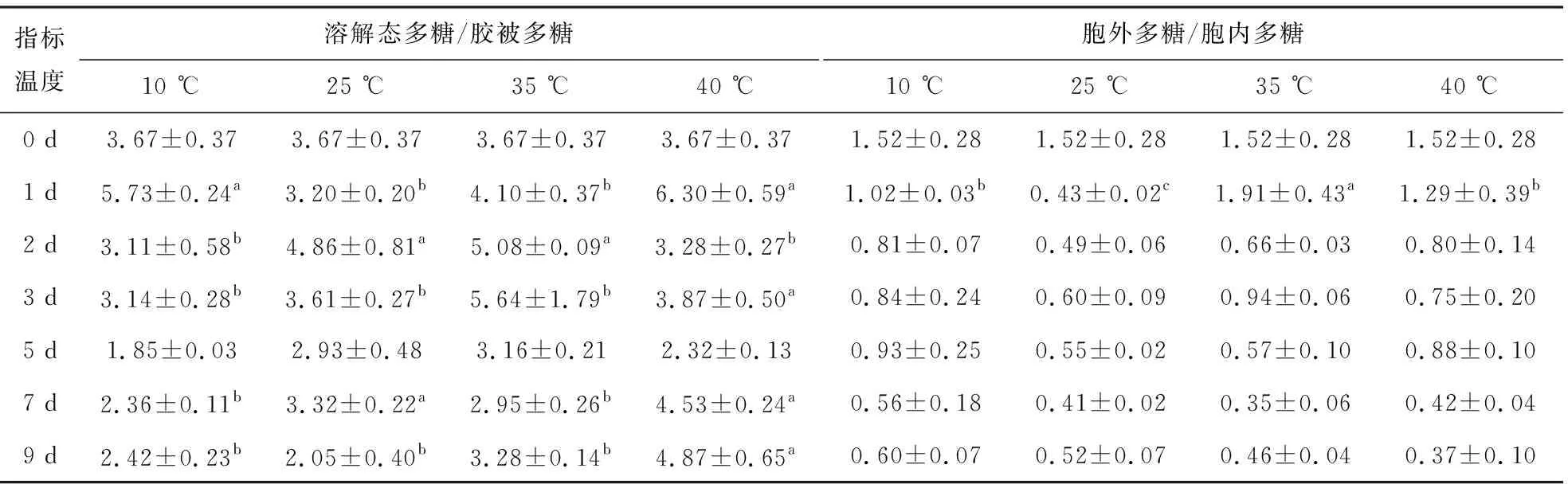
表1 不同温度对鱼腥藻溶解态多糖与胶被多糖比值,胞外多糖与胞内多糖比值的影响Tab. 1 Effect of the temperature on the ratio of SL-EPS and external layers,the ratio of EPS and total intracellular carbohydrate of Anabaena sp. (Mean±SE, n=3)
在培养2~9 d时,在各培养温度下,鱼腥藻FACHB-82胞外多糖与胞内多糖的比值无显著变化(P>0.05)(表1).10 ℃培养时,鱼腥藻FACHB-82胞外多糖与胞内多糖的比值略高于25 ℃组.在35 ℃、40 ℃培养时,在培养1~5 d,鱼腥藻FACHB-82胞外多糖与胞内多糖的比值略高于25 ℃组.在7~9 d,鱼腥藻FACHB-82胞外多糖与胞内多糖的比值略低于25 ℃组.
2.5 鱼腥藻群体形态和胞外多糖之间的关系
将试验周期内不同温度下的鱼腥藻的群体大小和胶被多糖以及溶解态多糖进行线性拟合,可以看出鱼腥藻在不同培养温度下其群体大小,胶被多糖含量差异较为明显.在10 ℃(k=21.15)、25 ℃(k=75.62)、40 ℃(k=36.41)培养时,鱼腥藻分泌的胶被多糖含量越高,群体尺寸越大(图 5a);在10 ℃(k=-4.06)、25 ℃(k=-115.38)、40 ℃(k=-61.94)时,鱼腥藻溶解态多糖含量越高,群体尺寸倾向于减小(图5(b)).而在35 ℃培养条件下,形态和胞外多糖的关系具有与其他温度条件下相反的趋势.

3 讨 论
温度是影响浮游植物生理生化过程的重要环境因子.许多研究发现,春季蓝藻水华的出现及冬季蓝藻水华的消失与蓝藻对温度的响应有关,而夏季和初秋蓝藻水华暴发与蓝藻在高温下具有相对较高的生长速率有关[28].通常认为,在一个物种的热耐受范围内,生理过程和其他参数(如生长)的速率随着温度的升高而增加,直到它们达到最适生长温度,然后迅速下降[29].比生长速率是直观反映藻类生长状况的重要指标.本研究中的鱼腥藻FACHB-82在35 ℃时比生长速率达到最大值,在较低温度(10 ℃)下生长受到明显抑制.(图 1).这也与温度对太湖蓝藻生物量影响的研究结果一致[30].付小丽等[31]的研究也获得了类似的结果.Fv/Fm是PSII的最大光化学量子产率,反映了藻类潜在的最大光合能力,也可以间接反映其生长状态和生存环境[32].本研究发现,鱼腥藻在40 ℃的光合活性并未受到抑制,而在10 ℃下,鱼腥藻光合活性受到显著抑制,这也反映了鱼腥藻在高温下生长速率高,而在低温下生长速率显著降低的原因之一.
鱼腥藻FACHB-82在高温40 ℃时细胞的比表面积较大和藻细胞倾向于更长,低温10 ℃鱼腥藻FACHB-82细胞的比表面积较小和藻细胞倾向于更短(图3(e-f)).虽然鱼腥藻在单细胞形态上没有明显变化,仍然是椭球形,但细胞长度和宽度的调整引起细胞比表面积的变化.Sv-cell增加有利于获取营养[33],形态对养分吸收速率的影响主要体现在Sv-cell上.较高的温度有利于营养物质向藻细胞表面的扩散,促进其生长[34].小细胞的优点之一是促进细胞内运输,可以更有效地进行扩散作用.因此,吸收外部养分能力的提高可能是高温40 ℃促进鱼腥藻FACHB-82的生长的原因之一.在代谢率降低的条件下,例如在低温10 ℃下,较大的细胞将更具有优势,因为它们的光系统不依赖于高代谢率来修复[35].一个藻丝的结构是由单个细胞联结形成的,通过这种方式,整个藻丝被视为一个单元,共同受环境影响.在藻丝水平上,高温和低温,藻丝的平均长度减小,使藻丝分布相对集中(图 3d).本研究发现,高温下鱼腥藻藻丝较短,细胞较小,鱼腥藻保持较高的生长速率.管乐等[4]也发现鱼腥藻可能通过调节藻丝的长度和藻细胞大小来维持高温下较高的生长速率.细胞分裂(主要发生在对数生长期)被报道为蓝藻形态的主要驱动因素[13].高温下鱼腥藻较高的生长速率有利于形成较大的群体形态(图3(b)).
藻细胞连结处主要复合物是肽聚糖和蛋白质[36].因此,鱼腥藻丝状体和细胞的变化可能是营养吸收和生化化合物改变策略的结果.改变生化化合物的分配可能是鱼腥藻适应外界环境变化的一种策略[37].在微生物中,代谢调节网络经常参与对非生物刺激的响应[38].中高温(25 ℃、35 ℃、40 ℃)组光合作用较强,多糖产量提高(图2).随着温度的增加,鱼腥藻的细胞内碳水化合物积累(图4(a)).碳水化合物的增加主要与光合作用有关[39].在野外调查中发现藻类生物量的碳水化合物最高的时期恰好是藻类生长中最旺盛的时期(夏季),这与温度呈正相关.积累的多糖在冬季被消耗,以维持正常的生长发育、脂质和蛋白质积累[40].细胞分裂的速度取决于蛋白质和核酸的可用性,25 ℃、35 ℃下,由于藻类具有更快的生长速率,多糖被分解产生高生长速率所需的蛋白质和核酸.当应激水平过高时,藻类体内相应的能量短缺会导致固有的碳水化合物途径增强,并诱导糖酵解等替代途径为关键代谢过程提供能量和相关的碳骨架[38].低温10 ℃培养时,溶解态多糖与胶被多糖的比值减小,表明鱼腥藻FACHB-82在较低的光合作用提供能量时,优先合成对自身生存有利的胶被(图4(b)).本课题组前期研究发现蓝藻胶被的缓冲作用在温度波动时可稳定细胞活性,从而改善光合作用和呼吸效率[41].葛红梅等[37]的研究同样发现在能量受限时,优先合成胶被.蓝藻合成胶被有利于保护藻细胞,随着温度的增加,鱼腥藻FACHB-82溶解态多糖与胶被多糖的比值增加(表1),鱼腥藻EPS结构更松散.SL-EPS与胶被的比值在一定程度上可以反映蓝藻群体大小和紧密程度[43].高温40 ℃培养时,过量的SL-EPS会削弱细胞附着结构,导致细胞松散.本课题组前期研究也发现胶被越松散,包裹范围大,可能会影响水体与藻细胞间的热量交换,减缓温度对藻细胞的冲击过程[22].此外,鱼腥藻分泌胶被多糖越多,群体尺寸越大(图5).LI等[43]人发现在野外群体大小与胶被水平有关.SATO等[44]也发现在实验室培养中添加胶被成分会诱导群体形成,而添加SL-EPS不会诱导群体形成.ALLEN等[45]发现Thauerasp.聚集与EPS中的多糖密切相关.这些结果进一步表明蓝藻细胞糖分配模式对抵御温度冲击有重要作用,且胶被是调节鱼腥藻形态策略的关键结构.
本研究从藻类生理和形态角度探讨了温度变化与鱼腥藻生长的关系,对了解鱼腥藻在不同温度下的适应性策略提供新的视角.当面对温度胁迫时,鱼腥藻减小藻丝和藻细胞的比表面积,以及分泌更多的胶被多糖来抵抗低温;而在高温胁迫下,鱼腥藻倾向积累更多的胞内多糖和分泌溶解态多糖来抵抗高温.
4 结 论
(1)温度升高显著增加鱼腥藻(FACHB-82)的光合活性,促进其生长.
(2)高温促进鱼腥藻(FACHB-82)群体尺寸变大,藻丝变短,具有更大的藻丝和细胞比表面积,低温条件下变化趋势相反,且鱼腥藻形态调节更多的是依赖胶被物质而不是胞外溶解性多糖.
(3)鱼腥藻(FACHB-82)倾向于累积胶被多糖以抵抗低温胁迫,而在高温条件下鱼腥藻主要以加快生长的方式使群体尺寸变大,且胶被结构变得松散进而可能影响热传导以适应高温环境.

