FSTL3在不同诱因所致的小鼠急性肺损伤中的表达
黄丽丹,王博
(武汉大学人民医院:1麻醉科,2胸外科,武汉 430060)
急性肺损伤是一种常见的危重症,病死率极高[1]。临床上,急性肺损伤患者主要表现为呼吸急促、紫绀、肺顺应性降低及肺水肿,病理特征主要以大量炎症细胞浸润,肺泡上皮和血管内皮屏障损伤为主[2]。根据病理进展,急性肺损伤被分为4个时期,包括早期渗出期、晚期渗出或增殖期、扁平上皮化生期以及晚期增殖期[3]。引起急性肺损伤常见原因包括肺炎、肺栓塞以及肺移植后缺血再灌注或肺叶切除,间接原因为脓毒血症和创伤[4]。目前临床针对急性肺损伤的治疗除对症支持外,尚无特殊治疗及预防手段[5]。此外,不同病因所致的急性肺损伤,分子作用机制也有所差异。因此,进一步加深对不同病因所致急性肺损伤发病机制的认识,解析其发生发展过程中的关键靶点,对急性肺损伤的干预具有重要意义。
人卵泡抑素样蛋白3(follistatin-like protein 3,FSTL3)是Hayette等[6]于1998年在慢性淋巴细胞白血病患者B细胞中发现的一种新型分泌蛋白。近年来,越来越多的研究发现FSTL3参与调节多种生物过程,包括细胞分化、衰老、炎症、氧化应激、代谢、免疫、动脉硬化和肿瘤进展[7-9]。有研究发现,FSTL3可通过诱导脂质沉积和巨噬细胞炎症反应加速动脉粥样硬化发生发展[10]。此外,FSTL3在超重或肥胖个体的脂肪组织中高表达,并与机体炎症反应呈正相关[11]。哮喘患者支气管上皮细胞中FSTL3的低表达水平与肺成纤维细胞的活力降低存在显著相关性[12]。上述研究均提示,FSTL3在炎症疾病中发挥重要作用,但FSTL3在急性肺损伤中的表达及作用目前尚未有研究报道。本研究通过构建脓毒血症肺损伤及肺缺血再灌注(ischemia reperfusion,IR)损伤两种急性肺损伤模型,观察FSTL3在肺损伤发生发展过程中的表达,同时使用FSTL3中和抗体(follistatin-like protein 3-neutra-lizing antibody,FSTL3-NA)或FSTL3基因敲除小鼠评估FSTL3抑制对急性肺损伤的影响。
1 材料与方法
1.1 材料与试剂
脂多糖(lipopolysaccharide,LPS)纯度为97.53%,购自上海源叶生物科技有限公司;肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)、FSTL3、单核细胞趋化蛋白-1(monocyte chemoattractant protein-1,MCP-1)、超氧化物歧化酶(superoxide dismutase,SOD)1、SOD2、甘油醛-3-磷酸脱氢酶(glyceraldehyde-3-phosphate dehydrogenase, GAPDH),均购自美国Abcam公司;FSTL3中和抗体(follistatin-like 3-neutralizing antibody,FSTL3-NA),购自北京热景生物技术有限公司。
1.2 实验小鼠及急性肺损伤模型的构建
SPF级野生型(wild type,WT)雄性C57 BL/6小鼠体质量20~24g,周龄8~10周,购自于湖北省实验动物研究中心。FSTL3基因敲除雄性小鼠体质量20~24g,周龄8~10周,购自于赛业生物科技有限公司。
根据随机数表法,将30只SPF级WT雄性C57 BL/6小鼠随机分为5组,依次为LPS注射0h组、6h组、12h组、18h组和24h组,每组各6只,进行脓毒血症肺损伤造模。脓毒血症肺损伤模型具体构建过程:参考既往文献[6]报道的方式,小鼠腹腔单次注射LPS 10mg/kg,分别在LPS注射0、6、12、18及24h后,腹腔注射50mg/kg的2%戊巴比妥钠溶液对小鼠进行麻醉。随后,使用眼科剪逐层剪开小鼠胸部皮肤并剪断肋骨,打开胸膜充分暴露肺及心脏。使用1ml注射器,于心脏中抽取血液0.6~0.8ml。同时留取小鼠左肺组织,将左上肺组织置于10%中性福尔马林溶液,左下肺组织剪碎后置于冻存管中,放置于-80℃冰箱。为进一步探讨FSTL3-NA干预对脓毒血症肺损伤的作用,另选取18只SPF级WT雄性C57 BL/6小鼠,根据随机数表法,依次将其分为对照组、LPS组及治疗组(LPS+FSTL3-NA组),每组各6只。LPS组及LPS+FSTL3-NA组小鼠接受腹腔单次注射LPS10mg/kg。LPS+FSTL3-NA组小鼠在LPS腹腔注射前2d给予尾静脉注射FSTL3-NA 80μg/d,其余步骤同上。
根据随机数表法,另将30只SPF级WT雄性C57 BL/ 6小鼠随机分为5组,依次为再灌注0h组、2h组、4h组、6h组、8h组,每组各6只,进行肺IR造模。肺IR模型具体构建过程:参考既往文献[7]报道的方式,腹腔注射50mg/kg的2%戊巴比妥钠溶液对小鼠进行麻醉。随后,将小鼠仰卧位固定于保温板上,左侧进胸后使用显微血管钳夹闭左肺门2h,松夹后分别再灌注0、2、4、6及8h。再灌注结束后使用1ml注射器,于心脏中抽取血液0.6~0.8ml。同时留取小鼠左肺组织,将左上肺组织置于10%中性福尔马林溶液,左下肺组织剪碎后置于冻存管中,放置于-80℃冰箱。
根据随机数表法,另将12只SPF级WT雄性C57 BL/ 6小鼠随机分为假手术(Sham)-WT组6只和IR-WT组6只,将12只FSTL3基因敲除(FSTL3 KO)小鼠随机分为Sham-FSTL3 KO组6只和IR-FSTL3 KO组6只,进行肺IR造模,IR组造模方法同上。
1.3 小鼠血清中FSTL3及TNF-α水平的检测
将各组小鼠全血样品在室温放置2h后于4℃下以3000转/min的速度进行离心20min,上清液即为血清层。使用FSTL3 酶联免疫吸附检测(enzyme-linked immunosorbent assay,ELISA)试剂盒(批号:CT66668,上海初态生物科技有限公司)和TNF-α ELISA试剂盒(批号:CT66709,上海初态生物科技有限公司)对各组血清样本中的FSTL3和TNF-α含量进行检测,在450nm波长下对各孔的吸光度进行读取并计算FSTL3和TNF-α的相对含量。
1.4 免疫印迹
用于4℃温度保存的磷酸盐缓冲液对小鼠肺组织充分洗涤后提取肺组织中总蛋白。通过十二烷基硫酸钠聚丙烯酰胺凝胶电泳检测各组小鼠肺组织中相关蛋白的表达水平。一抗稀释倍数如下:TNF-α(1∶1000)、FSTL3(1∶500)、MCP-1 (1∶1000)、SOD1(1∶1000)、SOD2(1∶500)、GAPDH(1∶2000)。
1.5 转录实时定量聚合酶链反应
使用Trizol试剂盒(批号:abs60154,上海爱必信生物科技有限公司)对各组小鼠肺组织中的总RNA进行抽提。使用紫外分光光度计对RNA纯度和浓度进行测定,样本在260nm和280nm的吸光度比值为1.9~2.1时则认为其质量合格。随后,使用互补DNA逆转录试剂盒将RNA逆转录为互补DNA。使用实时荧光定量聚合酶链反应(polymerase chain reaction,PCR)仪进行PCR 扩增,检测相应目的基因的循环阈值(cycle threshold,Ct)。最后,以2-△△Ct法计算本研究中各目的基因的相对信使RNA(message RNA, mRNA)表达水平。
1.6 HE 染色
将各组小鼠的左上肺组织固定并包埋后切成4μm的组织切片。使用苏木素和伊红对肺组织切片进行HE染色。光镜下观察染色结果并对各组小鼠肺损伤程度进行评分。评分指标包括炎症细胞浸润、组织水肿和肺泡间隔增厚的程度[5]。各指标评分细则如下:肺组织正常为0分;损伤程度<25%为1分;25%≤损伤程度<50%为2分;50%≤损伤程度<75%为3分;75%≤损伤程度为4分。3项指标评分总和即为最终的肺损伤评分。
1.7 统计学处理
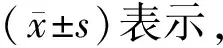
2 结 果
2.1 FSTL3在两种急性肺损伤小鼠血清中的表达
在LPS诱导的脓毒血症肺损伤模型中,LPS腹腔注射6h后,血清中TNF-α的蛋白表达水平显著升高,12h后达到峰值,24h后水平仍显著高于0h(P<0.05;图1A);血清中FSTL3的蛋白表达水平在12h显著升高,18h达到峰值,后趋于稳定,均显著高于0h(P<0.05;图1A)。在IR诱导的急性肺损伤模型中,缺血2h,再灌注2h后,小鼠血清中TNF-α和FSTL3的蛋白表达水平均显著升高,6h后达到峰值,8h后水平仍显著高于0h(P<0.05;图1B)。

图1 FSTL3和TNF-α在两种急性肺损伤小鼠模型血清中的表达Figure 1 Expression of FSTL3 and TNF-α in serum of two acute lung injury mice models (n=6, A: changes of serum TNF-α and FSTL3 protein levels in mice after intraperitoneal injection of LPS; B: changes of serum TNF-α and FSTL3 protein levels in reperfusion mice after 2 hours of ischemia. FSTL3: follistatin-like protein 3; TNF-α: tumor necrosis factor-α; LPS: lipopolysaccharide. Compared with 0 h, *P<0.05.
2.2 FSTL3在脓毒血症肺损伤小鼠肺组织中的表达
在LPS诱导的脓毒血症肺损伤模型中,LPS腹腔注射6h后,小鼠肺组织中TNF-α的蛋白和mRNA表达水平显著升高;12h后,TNF-α的mRNA表达水平达到峰值;18h后,TNF-α的蛋白表达水平达到峰值(均P<0.05)。LPS腹腔注射6h后,小鼠肺组织中FSTL3的mRNA表达水平显著升高;12h后,FSTL3的蛋白表达水平著升高;18h后,FSTL3的蛋白和mRNA表达水平均达到峰值(均P<0.05;表1,图2)。
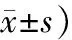
表1 LPS腹腔注射后不同时间小鼠肺组织中TNF-α和FSTL3的蛋白及mRNA的相对表达量
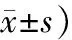
表2 缺血再灌注不同时间小鼠肺组织TNF-α和FSTL3的蛋白及mRNA的相对表达量

表3 FSTL3-NA对脓毒血症小鼠肺组织中TNF-α, MCP-1,SOD1和SOD2蛋白表达的影响
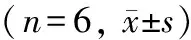
表4 FSTL3基因敲除对IR小鼠肺组织中TNF-α, MCP-1, SOD1和SOD2蛋白表达的影响

图2 LPS腹腔注射后不同时间小鼠肺组织中TNF-α和FSTL3蛋白表达的Western blotting检测Figure 2 Western blotting of TNF-α and FSTL3 protein expression in lung tissue of mice at different time points after intraperitoneal injection of LPS (n=6, LPS: lipopolysaccharide; TNF-α: tumor necrosis factor-α; FSTL3: follistatin-like protein 3; GAPDH: glyceraldehyde-3-phosphate dehydrogenase.

图3 缺血再灌注不同时间小鼠肺组织中TNF-α和FSTL3蛋白表达的Western blotting检测Figure 3 Western blotting of TNF-α and FSTL3 protein expression in lung tissue of mice at different time points of ischemia-reperfusion (n=6, TNF-α: tumor necrosis factor-α; FSTL3: follistatin-like protein 3; GAPDH: glyceraldehyde-3-phosphate dehydrogenase.
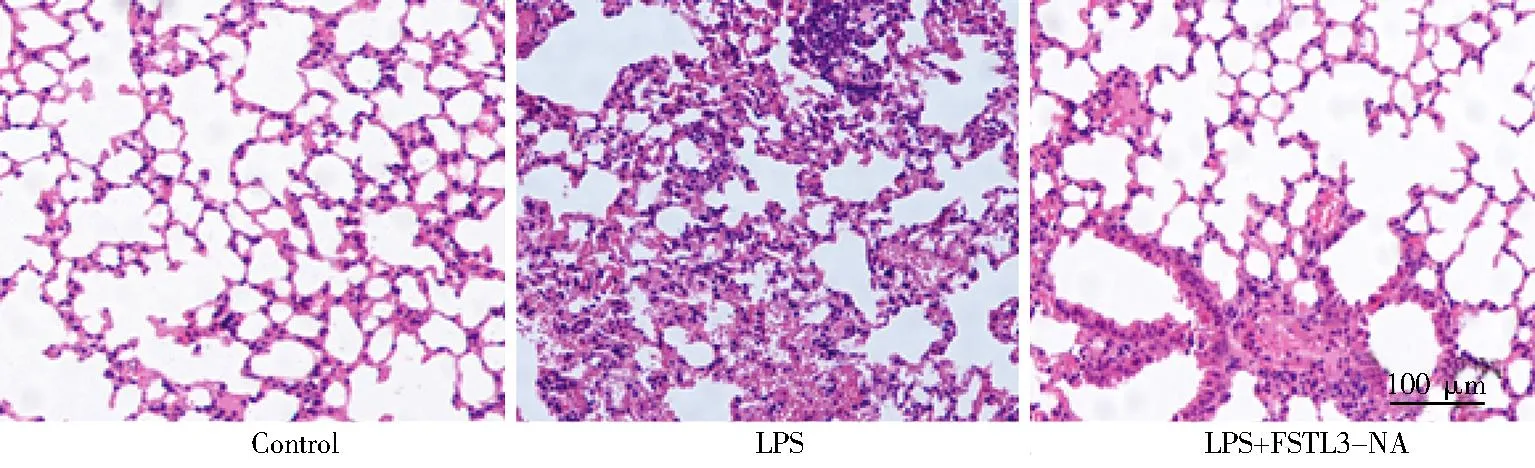
图4 FSTL3-NA对脓毒血症小鼠肺病理损伤的影响Figure 4 Effects of FSTL3-NA on lung pathological injury in septic miceFSTL3-NA: follistatin-like protein 3-neutralizing antibody; LPS: lipopolysaccharide.
2.3 FSTL3在肺IR损伤小鼠肺组织中的表达
在肺IR损伤小鼠模型中,缺血2h,再灌注2h后,小鼠肺组织中TNF-α的蛋白和mRNA表达水平显著升高;再灌注4h后,TNF-α的蛋白表达水平达到峰值;再灌注6h后,mRNA表达水平均达到峰值(均P<0.05)。缺血2h,再灌注2h后,小鼠肺组织中FSTL3的蛋白和mRNA表达水平显著升高;再灌注4h后,FSTL3的蛋白和mRNA表达水平均达到峰值(均P<0.05;表2,图3)。
2.4 FSTL3-NA对脓毒血症小鼠肺病理损伤的影响
HE染色结果表明,LPS刺激12h后,与对照组相比,LPS组小鼠肺组织出现了明显的炎症细胞浸润、组织水肿和肺泡间隔增厚,肺损伤评分明显增加[(8.15±2.54)和(1.04±0.15)分;P<0.05]。与LPS组相比,LPS+FSTL3-NA组小鼠肺炎症细胞浸润、组织水肿和肺泡间隔增厚均明显减轻,肺损伤评分明显降低[(4.14±1.32)和(8.15±2.54)分;P<0.05;图4)]。
Western blotting结果表明,与对照组相比,LPS刺激可明显上调小鼠肺组织中TNF-α和MCP-1的蛋白表达水平(P<0.05),同时下调SOD1和SOD2的蛋白表达水平(P<0.05)。与LPS组相比,FSTL3-NA预处理可明显下调脓毒血症小鼠肺组织中TNF-α和MCP-1的蛋白表达水平(P<0.05),同时上调SOD1和SOD2的蛋白表达水平(P<0.05;表3,图5)。

图5 FSTL3-NA对脓毒血症小鼠肺组织炎症及氧化应激的影响Figure 5 Effects of FSTL3-NA on lung inflammation and oxidative stress in septic miceA: protein expression of TNF-α and MCP-1 by western blotting; B: protein expression of SOD1 and SOD2 by western blotting. FSTL3-NA: follistatin-like protein 3-neutralizing antibody; TNF-α: tumor necrosis factor-α; MCP-1: monocyte chemoattractant protein-1; GAPDH: glyceraldehyde-3-phosphate dehydrogenase; SOD1: superoxide dimutase 1; SOD2: superoxide dimutase 2; LPS: lipopolysaccharide.
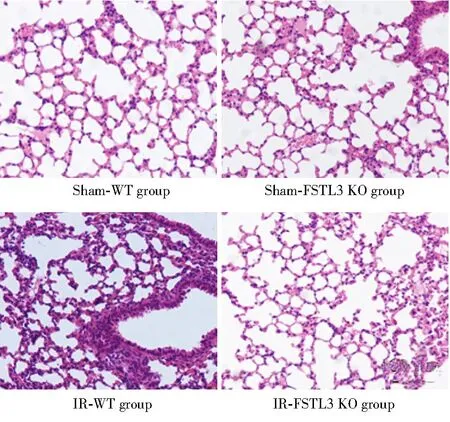
图6 FSTL3基因敲除对IR小鼠肺病理损伤的影响Figure 6 Effects of FSTL3 gene knockout on lung pathological injury in IR miceFSTL3: follistatin-like 3; IR: ischemia reperfusion; WT: wild type; KO: knockout.
2.5 FSTL3敲除对IR小鼠肺病理损伤的影响
HE染色结果表明,与Sham-WT组相比,IR-WT组小鼠肺损伤评分明显增加[(7.66±1.43)分和(1.21±0.31)分;P<0.05]。与IR-WT组相比,IR-FSTL3 KO组小鼠肺病理损伤明显减轻,且肺损伤评分明显降低[(2.34±0.23)和(7.66±1.43)]分;P<0.05;图6]。
Western blotting结果表明,与Sham-WT组相比,缺血2h再灌注4h可明显上调野生型小鼠肺组织中TNF-α和MCP-1的蛋白表达水平(P<0.05),同时下调SOD1和SOD2的蛋白表达水平(P<0.05)。与IR-WT组相比,FSTL3敲除可明显下调IR小鼠肺组织中TNF-α和MCP-1的蛋白表达水平(P<0.05),同时上调SOD1和SOD2的蛋白表达水平(P<0.05;表4,图7)。

图7 FSTL3基因敲除对IR小鼠肺组织炎症及氧化应激的影响Figure 7 Effects of FSTL3 gene knockout on lung inflammation and oxidative stress in IR miceA: protein expression of TNF-α and MCP-1 by western blotting; B: protein expression of SOD1 and SOD2 by western blotting. FSTL3: follistatin-like 3; IR: ischemia reperfusion; TNF-α: tumor necrosis factor-α; MCP-1: monocyte chemoattractant protein-1; GAPDH: glyceraldehyde-3-phosphate dehydrogenase; SOD1: superoxide dimutase 1; SOD2: superoxide dimutase 2; WT: wild type; KO: knockout.
3 讨 论
急性肺损伤是一种由多种致病因素引起的临床综合征,包括急性肺炎、脓毒血症、外伤、肺IR、严重外伤及急性胰腺炎等[1,3,4]。急性肺损伤以肺部剧烈炎症反应和肺上皮及血管内皮屏障受损为主要特征,若不及时控制,最终可发展为急性呼吸窘迫综合征(acute respiratory distress syndrome, ARDS)甚至引起死亡[13]。尽管机械通气可显著改善ARDS的症状,但ARDS所致的死亡率仍然高达35%~55%[14]。LPS是革兰氏阴性细菌细胞壁的主要成分,进入血液循环后可被天然免疫细胞识别并启动炎性介质的大量分泌,该过程会导致肺泡上皮和内皮屏障的破坏,损害宿主的正常呼吸功能,最终诱发急性肺损伤甚至ARDS[15]。IR损伤通常是由器官或组织床血流中断一段时间后血供突然恢复所诱发。在肺中,IR损伤既可单独发生也可与其他损伤过程伴随发生,包括感染、缺氧、肺不张、机械通气损伤钝性(非穿透性)肺挫伤[16]。既往研究表明,不论是LPS诱导的脓毒血症肺损伤还是IR诱导的肺损伤,肺组织中均出现了过度激活的炎症反应和氧化应激[17,18]。因此,进一步探寻可减轻肺损伤期间炎症及氧化应激的药物或分子靶点,对于临床急性肺损伤的防治具有重要意义。
FSTL3是一种富含酸性半胱氨酸的分泌糖蛋白,广泛分布于哺乳动物睾丸、肾上腺、脂肪、肺、胎儿心脏以及胎盘。FSTL3基因定位于人类染色体19p13[19]。FSTL3与转化生长因子-β家族配体(如激活素、骨形态发生蛋白和肌肉生长抑制素)通过不可逆地结合,使其生物活性降低。其中,FSTL3对激活素的抑制作用最强,其次是肌肉生长抑制素,对骨形态发生蛋白的抑制作用最弱。同时,FSTL3与上述配体结合后也易被细胞内吞降解[8]。既往研究显示,FSTL3在能量代谢、骨骼形成与强化、造血细胞黏附与造血、多能干细胞分化、生殖发育等生理过程中发挥关键作用。例如,啮齿动物中FSTL3的抑制可导致内脏脂肪量减少,并增加小鼠胰岛素敏感性[20]。此外,FSTL3敲除可明显改善主动脉缩窄术诱发的小鼠心脏功能与心室肥厚,其机制可能与FSTL3敲低后激活素A上调介导的抗凋亡蛋白Bcl-2过表达有关[21]。然而FSTL3是否在脓毒血症肺损伤及肺IR损伤中发挥作用,目前尚不清楚。本研究结果显示,FSTL3蛋白在LPS诱导的脓毒血症肺损伤模型和IR诱导的肺损伤模型小鼠血清中表达均明显升高,且FSTL3蛋白表达水平与炎症标志物TNF-α的蛋白变化趋势一致,表明FSTL3可能与两种诱因所致的小鼠急性肺损伤存在潜在相关性。特别地,我们发现在LPS刺激12h后,血清中TNF-α的蛋白水平到达峰值,18h后,肺组织中TNF-α的蛋白水平达到峰值,表明LPS刺激12h后全身炎症反应最激烈,18h后肺内炎症最激烈。有趣的是,肺组织中FSTL3和TNF-α的蛋白变化水平趋势基本一致,提示LPS刺激后,肺组织中FSTL3与炎症存在明显的交互作用。在IR模型中,血清中TNF-α和FSTL3的变化水平趋势基本完全一致,但肺组织中,FSTL3蛋白较TNF-α蛋白水平提前达到峰值。我们推测这种差异可能与两种模型中炎症类型差异有关。LPS诱导的是一种有菌性的全身性炎症[22],而IR诱导的损伤则为一种局部的无菌性炎症[23]。全身性炎症可能对炎症具有放大效应,而IR诱导炎症则对肺组织的局部效应更为明显。
此外,本研究还发现,使用中和抗体抑制小鼠体内FSLT3后可明显减轻脓毒血症小鼠肺病理损伤,炎症反应及氧化应激。在小鼠IR损伤模型中,FSLT3基因敲除也可明显减轻脓毒血症小鼠肺病理损伤、炎症反应及氧化应激。结合两种肺损伤模型,抑制FSLT3水平均可发挥明显的肺保护作用。尽管如此,本研究仍旧存在以下不足之处:(1)本研究只在动物层面探索了FSLT3对肺损伤表型的影响,未在细胞层面对FSLT3的作用加以验证;(2)本研究未对FSLT3通过何种靶点调控炎症和氧化应激进行探索。
综上,FSLT3在不同病因诱导的肺损伤模型中表达均发生改变,且在肺损伤发生发展中呈现动态改变,提示FSLT3参与急性肺损伤的病理发展。此外,靶向抑制FSTL3可显著减轻脓毒血症或IR所致的急性肺损伤,基于FSTL3的分子靶点可能为今后急性肺损伤的防治提供新方向。

