miR-152-3p表达下调降低紫杉醇耐药人卵巢癌细胞A2780T对紫杉醇的耐药性
张洋,赵辰戈,程荔春,吕慧怡,3,吴迪
(1.大连医科大学附属第二医院药学部,辽宁大连 116023;2.大连医科大学药学院,辽宁大连 116044;3.大连科翔生物科技有限公司,辽宁大连 116085)
卵巢癌是女性生殖系统最常见的恶性肿瘤之一,长期以来其死亡率位居妇科肿瘤首位[1]。化学疗法是治疗卵巢癌的首选手段,而化疗耐药是导致治疗失败的主要原因[2]。紫杉醇作为治疗卵巢癌的一线药物,发挥着不可或缺的作用,而耐药性的产生限制了其临床应用,其机制尚不明确[3]。
微RNA(microRNA,miRNA)是一组长度为21~25 个核苷酸的非编码RNA,通过与互补靶向信使RNA 结合而抑制或降解信使RNA 翻译[4],在细胞分化、增殖和凋亡中发挥重要作用。研究报道,卵巢癌的发生发展与miRNA表达密切相关,miRNA可通过调控不同靶基因发挥抑癌或促癌作用[5-6]。例如,miR-212 和miR-31 在卵巢癌中低表达,可作为卵巢癌的标志基因[7-8];miR-142-5p,miR-203 和miR-373通过靶基因影响卵巢癌细胞增殖、凋亡、迁移和侵袭以及耐药性[9-11]。
近几年,miR-152 被较多关注,其与miR-148a和miR-148b共同构成miR-148/52家族[12]。miR-152功能复杂多样,与多种癌症的发生发展有关。据报道,胃癌中miR-152过表达可明显抑制癌细胞增殖并诱导其凋亡,抑制胃癌的发生发展[13]。miR-152-3p与卵巢癌发生亦密切相关。Li等[14]报道,miR-152-3p通过抑制酪氨酸激酶受体的编码基因人表皮生长因子受体3(ERBB3)表达参与卵巢癌细胞增殖和转移。He等[15]报道,早期生长反应因子1通过与自噬相关基因14(autophagy-related gene 14,ATG14)相互作用上调miR-152-3p 转录。ATG14是miR-152-3p调节自噬的功能靶基因,可抑制卵巢癌细胞增殖,并降低癌细胞对顺铂的耐药性。然而,miR-152-3p 对紫杉醇卵巢癌耐药细胞的影响尚未见报道。本研究探讨miR-152-3p对紫杉醇耐药卵巢癌细胞A2780T 耐药性的影响,以期为卵巢癌的治疗提供新思路。
1 材料与方法
1.1 细胞、试剂和主要仪器
人卵巢癌A2780和A2780T细胞购自上海美轩生物科技有限公司。总RNA 提取试剂Trizol、逆转录试剂盒和实时荧光定量PCR(real-time quantitative PCR,RT-qPCR)试剂盒(中国TransGen Biotech公司);MTT 试剂盒(武汉伊莱瑞特生物科技公司);Annexin Ⅴ/PI细胞凋亡检测试剂盒(江苏凯基生物技术股份有限公司);miR-152-3p抑制物(上海吉玛制药有限公司);兔抗人P 糖蛋白(P-glycoprotein,P-gp)抗体、兔抗人多药耐药相关蛋白1(multidrug resistance associated protein 1,MRP1)、兔抗人三磷酸腺苷结合盒转运蛋白G2(ATP-binding cassette G2,ABCG2)、兔抗人BCL2关联X蛋白(Bax)、兔抗人Bcl-2、兔抗人磷酸酯酶张力蛋白同源物(phosphatase and tensin homolog,PTEN)、鼠抗人GAPDH单克隆抗体(一抗)(美国Abcam公司);脂质体Lipo2000、胎牛血清、RPMI 1640 和辣根过氧化物酶(HRP)标记山羊抗兔或鼠IgG 抗体(二抗)及miR-152-3p,U6,PTEN和GAPDH引物(表1)(美国Invitrogen 公司)。165-8001 电泳仪(美国BIO-RAD公司)和Countess®ⅡFL全自动细胞计数仪(美国Llfe Technologles 公司);NanoDrop 2000超微量分光光度计(美国Thermo Scientific 公司);Odyssey Dlx 双色红外激光扫描成像系统(美国LICOR公司)。

Tab.1 Primer sequences for real-time quantitative PCR(RT-qPCR)
1.2 细胞培养
A2780 和A2780T 细胞用RPMI 1640 培养基(含10%胎牛血清和1%青霉素和链霉素)于37 ℃,5% CO2和饱和湿度培养。A2780T 细胞用浓度为200 μg·L-1的紫杉醇培养以维持耐药性。实验前,A2780T 细胞弃药培养7 d,以避免药物毒性对实验结果的干扰,取对数生长期细胞进行实验。
1.3 MTT法检测细胞存活率
取对数生长期的A2780和A2780T细胞接种于96 孔板,每孔1×104细胞,加入不同浓度紫杉醇(1.875,3.75,7.5,17 和23 μmol·L-1),同时设空白对照组(无细胞)和细胞对照组(无药物),每组设3复孔。孵育48 h后加入MTT(5 g·L-1)50 μL继续孵育4 h,每孔加入二甲亚砜150 μL,于570 nm 处测定吸光度值(A570nm)。细胞存活率(%)=(实验组A570nm-空白对照组A570nm)/(细胞对照组A570nm-空白对照组A570nm)×100%。采用Graphpad Prism 8.2.1 软件计算IC50值,并计算耐药指数(resistance index,RI)。RI=A2780T细胞IC50/A2780细胞IC50。
1.4 miR-152-3p抑制物和PTEN siRNA转染A2780T细胞
用Lipo2000 对对数生长期的A2780T 进行瞬时转染,miR-152-3p 抑制物、PTEN siRNA 及其相应阴性对照序列见表2。细胞转染前1 d,细胞聚合度达90%,进行六孔板铺板。将A2780T 细胞以3.0×108·L-1均匀铺于六孔板,细胞聚合度达60%~70%时进行转染。首先,每孔用PBS 1 mL 清洗2 次,加入无双抗培养基1.5 mL。将miR-152-3p抑制物或PTEN siRNA 10 μL 及其相应阴性对照分别溶于250 μL无血清培养基中混匀,室温静置5 min;同时将Lipo2000 5 μL 溶于250 μL 无血清培养基中混匀,室温静置5 min。将2 种液体混匀,室温放置20 min;随后将混合液加入6 孔板中混匀,6 h 后将培养液换成含10%血清的完全培养基继续培养24 h 进行蛋白质提取、RNA 提取和流式细胞术测定。

Tab.2 Primer sequences of microRNA and small interfering RNA(siRNA)
1.5 Western 印迹法检测A2780T 和A2780 细胞多药耐药蛋白P-gp,MRP1 和ABCG2 表达水平及A2780T细胞凋亡蛋白Bax和Bcl-2表达水平
A2780、A2780T 和转染miR-152-3p 抑制物或PTEN siRNA 的A2780T 细胞培养24 h,弃培养液,用RIPA 裂解液和PMSF 于冰上充分裂解细胞,收集并离心获得细胞总蛋白。BCA 法测定蛋白质浓度并定量后予以蛋白变性,随后进行SDS-PAGE分离、湿法转膜、5%脱脂牛奶封闭(室温1 h)和一抗(抗P-gp,MRP1 和ABCG2 抗体:1∶5000;抗Bax和Bcl-2 抗体:1∶1000;抗PTEN 抗体:1∶2000;抗GAPDH 抗体:1∶10 000)4 ℃孵育过夜,次日用二抗(HRP 标记山羊抗兔或鼠IgG 抗体:1∶10 000)室温避光孵育1 h,Odyssey®Dlx 双色红外激光成像系统显影获取蛋白条带。采用Image J 软件对蛋白条带进行积分吸光度分析,以待测蛋白与内参蛋白GAPDH 条带的积分吸光度比值表示待测蛋白相对表达水平。
1.6 RT-qPCR检测A2780和A2780T细胞miR-152-3p和PTEN mRNA表达水平
待A2780和A2780T细胞聚合度>90%,Trizol法提取细胞总RNA,逆转录为cDNA进行RT-qPCR,检测miR-152-3p 和PTENmRNA 水平。反应体系:cDNA 0.4 μL(2 μg),PCR 上下游引物各0.4 μL,SYBR GreenⅠ荧光染料混合物10.0 μL 和DEPC水8.8 μL。反应条件:95 ℃30 s;95℃5 s,60 ℃30 s,40 个循环。GAPDH或U6作为内参基因,待测基因表达水平用2-△△Ct表示。
1.7 划痕实验检测细胞迁移能力
培养转染miR-152-3p 的A2780T 细胞,待细胞贴壁时用200 μL 的无菌枪头在细胞贴壁部分划出一个“十”字型,PBS 洗掉脱落的细胞,倒置显微镜下拍照记录0 h细胞划痕宽度。继续培养24和48 h后,用PBS 洗掉漂浮的细胞,倒置显微镜下分别拍照,记录培养24 和48 h 细胞划痕宽度,计算细胞迁移面积。
1.8 流式细胞术检测A2780T细胞凋亡
转染miR-152-3p 抑制物的A2780T 细胞经不含EDTA 的胰蛋白酶消化后,用预冷PBS 洗涤2 次并重悬于500 μL预冷的结合缓冲液中,按细胞凋亡检测试剂盒说明书进行Annexin V-FITC 和碘化丙啶(PI)染色,通过流式细胞术分析细胞凋亡率(含早期和晚期凋亡率)。
1.9 在线数据库预测miR-152-3p的靶基因
利用基因数据库miRDB(V6.0,http://www.mirdb.org),Targetscan(V7.2,http://www.targetscan.org),miRWalk(V3.0,http://mirwalk.umm.uni-heidelberg.de)和Starbase(V3.0,http://starbase.sysu.edu.cn)4 个在线预测工具,以“hsamiR-152-3p”为搜索词进行检索并进行数据处理,分别获取各软件预测到的靶基因;利用在线集合统计软件VENNY2.1(http://bioinfogp.cnb.csic.es/tools/venny/index.html),取4 个预测软件预测得到的靶基因的交集。
1.10 统计学方法
2 结果
2.1 A2780T细胞紫杉醇耐药性的鉴定
MTT 法检测结果(图1A)表明,紫杉醇处理后A2780T 细胞存活率明显高于A2780 细胞(P<0.01);A2780T 细胞的IC50值为(3.4±0.6)mg·L-1,A2780细胞为(1.20±0.04)mg·L-1(P<0.01);A2780T细胞的耐药指数为2.8。Western 印迹法检测结果(图1B)表明,A2780T 细胞多药耐药蛋白P-gp,MDR1 和ABCG2 表达明显高于A2780 细胞(P<0.01);表明A2780T细胞对紫杉醇具有耐药性。
2.2 转染miR-152-3p抑制物对A2780T细胞增殖、迁移、凋亡及紫杉醇耐药的影响
RT-qPCR 检测结果表明,A2780T 细胞中miR-152-3p表达水平比A2780细胞高(43.0±6.3)倍(P<0.01,图2A)。转染miR-152-3p 抑制物后,A2780T中miR-152-3p表达抑制率达97%(P<0.01,图2B)。
划痕实验结果表明,转染miR-152-3p抑制物组A2780T 细胞培养24 和48 h 细胞迁移面积明显小于转染miR-152-3p 阴性对照组(P<0.05,图2C),表明miR-152-3p 低表达可抑制A2780T 细胞的迁移能力。
MTT 法结果表明,转染miR-152-3p 抑制物组A2780T 细胞与紫杉醇1.875,3.75,7.5,17 和23 μmol·L-1孵育48 h,细胞存活率(P<0.05,P<0.01,图2D1)和IC50值(P<0.05,图2D2)均明显低于转染miR-152-3p 阴性对照组,表明抑制miR-152-3p表达可降低A2780T细胞对紫杉醇的耐药性。
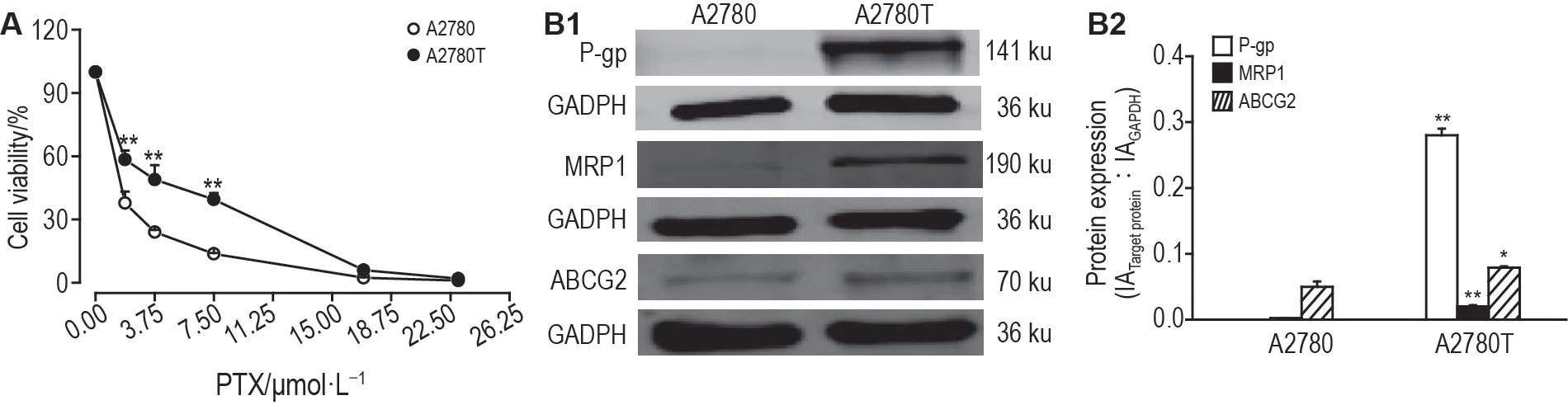
Fig.1 ldentification of paclitaxel(PTX)resistant cells A2780T.A:A2780 and A2780T cells were incubated with PTX 1.875,3.75,7.5,17 or 23 μmol·L-1 for 48 h.The cell viability was detected by MTT assay.Cell viability(%)=(A570 nm of experimental group-A570 nm of blank control group)/(A570 nm of cell control group-A570 nm of blank control group)×100%.B:the protein expressions of P-glycoprotein(P-gp),multidrug resistance gene 1(MDR1)and ATP-binding cassette G2(ABCG2)measured by Western blotting,B2 was the semi-quantitative result of B1.IA:integrated absorbance.±s,n=3.*P<0.05,**P<0.01,compared with A2780 cells.
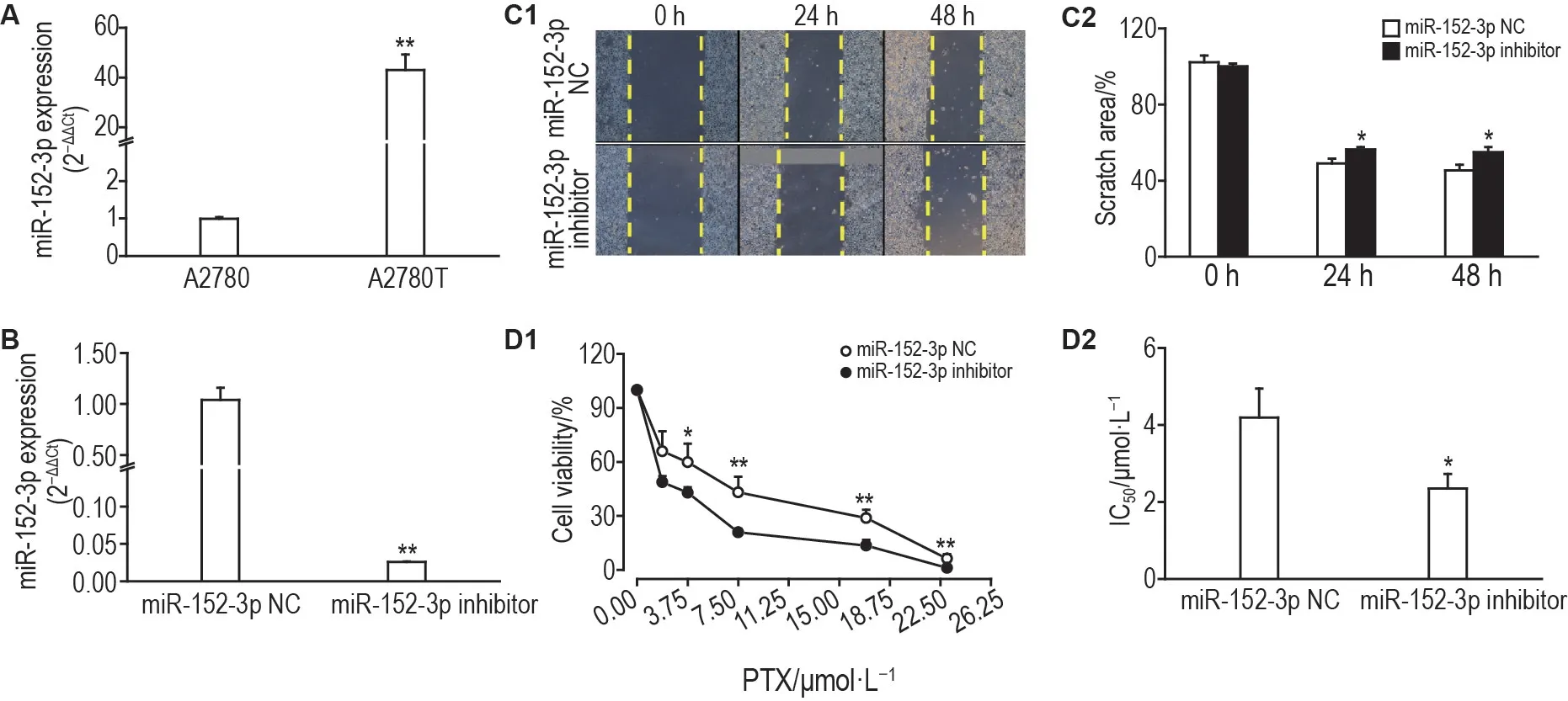
Fig.2 Effect of transfecting miR-152-3p inhibitor on proliferation,migration and drug resistance in A2780T cells.A:expression level of miR-152-3p in A2780 and A2780T cells detected by RT-qPCR.±s,n=3.**P<0.01,compared with A2780 cells.B:verification of knockdown efficiency of miR-152-3p in A2780T cells using RT-qPCR after transfecting miR-152-3p inhibitor for 24 h.The miR-152-3p inhibitor was transfected using a lipid-mediated transient transfection technique,while miR-152-3p negative control(miR-152-3p NC)group was simultaneously established.±s,n=3.**P<0.01,compared with miR-152-3p NC group.C:the migration ability of A2780T cells detected by scratch after transfecting for 24 h,C2 was the quantitative result of C1.±s,n=3.*P<0.05,compared with miR-152-3p NC group at the same time.D:the cell viability(D1)and IC50(D2)of transfected A2780T cells incubated with PTX for 48 h detected by MTT assay.±s,n=3.*P<0.05,**P<0.01,compared with miR-152-3p NC group.
流式细胞术检测结果显示,转染miR-152-3p 抑制物组A2780T细胞凋亡率明显高于转染miR-152-3p 阴性对照组(P<0.05,图3A)。Western 印迹法结果表明,与转染miR-152-3p阴性对照组相比,转染miR-152-3p 抑制物组凋亡蛋白Bax 表达升高(P<0.01),Bcl-2 表达降低(P<0.05,图3B);提示miR-152-3p低表达可促进A2780T细胞凋亡。

Fig.3 Effect of transfecting miR-152-3p inhibitor on apoptosis of A2780T cells.See Fig.2B for transfecting miR-152-3p inhibitor.A:apoptosis rate detected by flow cytometry,A2 was the quantitative result of A1.B:protein expressions of Bax and Bcl-2 measured by Western blotting,B2 was the semiquantitative result of B1.±s,n=3.*P<0.05,**P<0.01,compared with miR-152-3p NC group.
2.3 miR-152-3p 调控PTEN 参与A2780T 细胞对紫杉醇的耐药性
2.3.1 生物信息学预测miR-152-3p的靶向基因
利用基因数据库miRDB,Targetscan,miRWalk和Starbase 等4 个在线预测工具预测miR-152-3p的靶基因,共筛选出308 个基因(图4A)。结合PubMed 文献查阅,最终得到与卵巢癌相关的靶向基因PTEN。数据库分析显示,在卵巢癌中miR-152-3p 与PTEN的关系呈正相关(图4B),并且PTEN与miR-152-3p 有多个不同结合位点(图4C)。
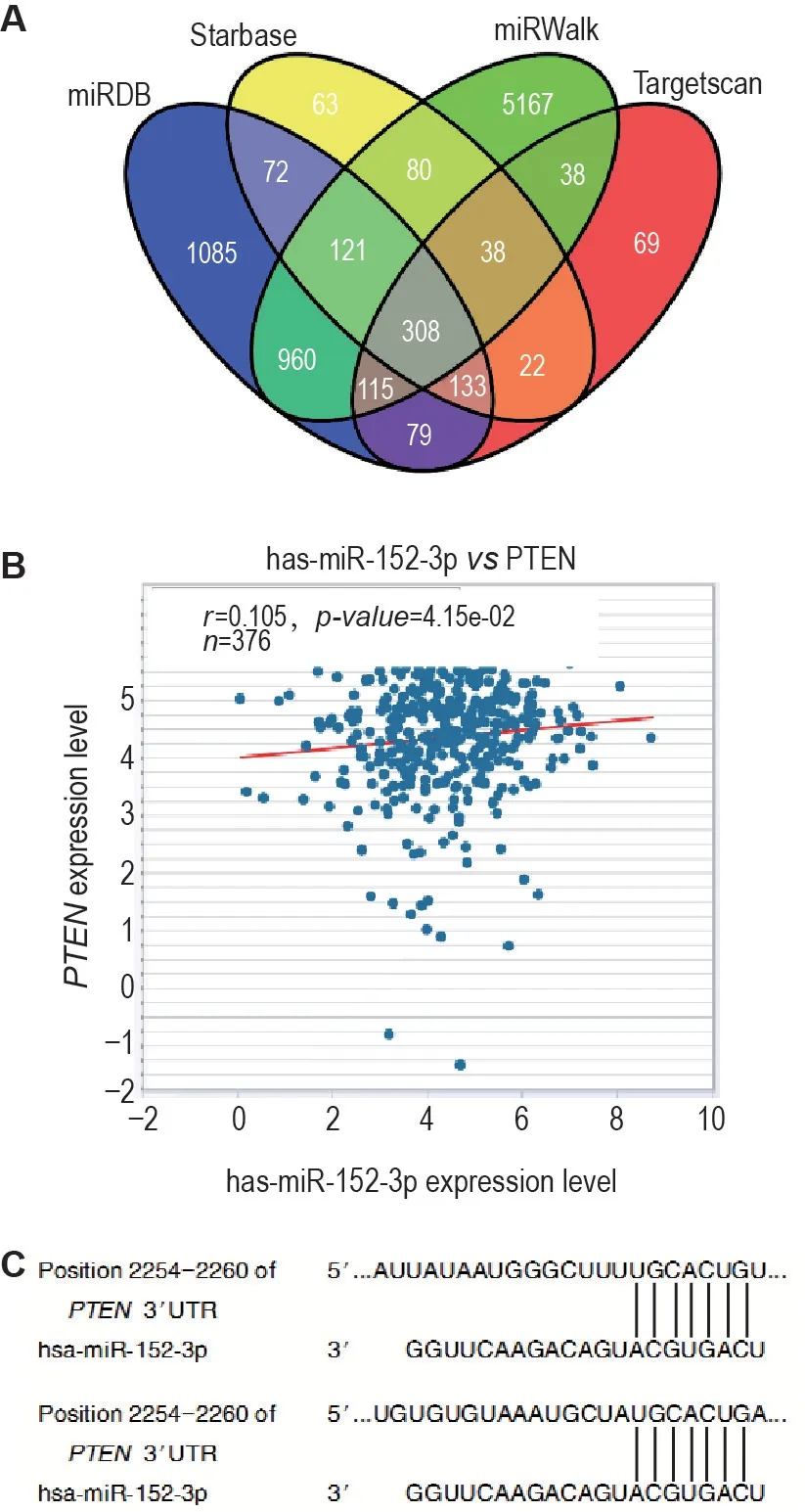
Fig.4 Targeted genes for miR-152-3p predicted by bioinformatics.A:venn diagram intersection of prediction results of miR-152-3p in TargetScan,miRDB,miRWalk,and Starbase databases;B:PTEN was positively correlated with miR-152-3p showed by StarBase database;C:displayed consequential pairing of target region(top)and miRNA(bottom)and the binding site of the target sequence displayed through the TargetScan database.
2.3.2 miR-152-3p靶基因的验证
Western 印迹法进一步验证结果显示,转染miR-152-3p 抑制物后,与其阴性对照组相比,A2780T 细胞PTEN 表达显著降低(P<0.05,图5A),表明A2780T细胞miR-152-3p表达下调的同时,PTEN 蛋白表达亦显著降低。用RT-qPCR 检测PTENmRNA 在A2780 和A2780T 细胞中的表达。结果显示,A2780T 细胞中PTENmRNA 表达亦明显高于A2780细胞(P<0.01,图5B)。
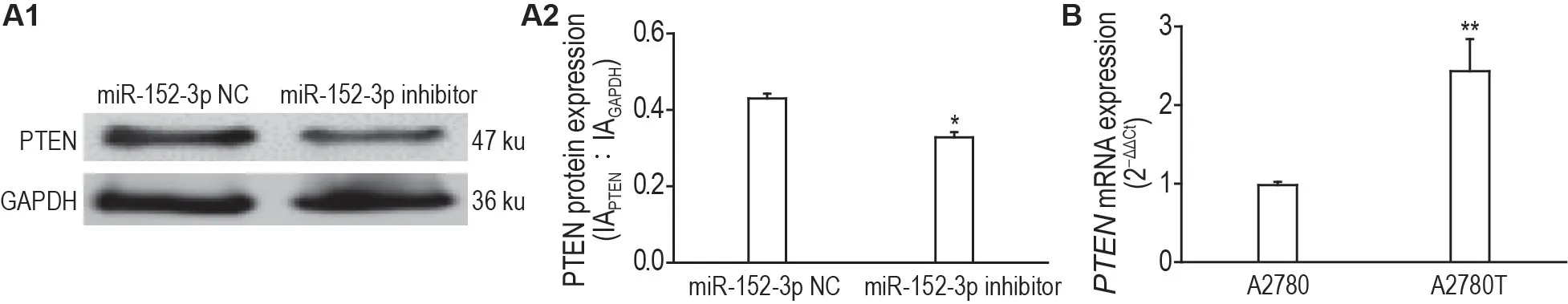
Fig.5 Verification of target gene of miR-152-3p.A:the expression level of PTEN protein in transfected A2780T cells by Western blotting.See Fig.2B for transfecting miR-152-3p inhibitor.A2 was the semi-quantitative result of A1.±s,n=3.*P<0.05,compared with miR-152-3p NC group.B:the expression level of PTEN mRNA in A2780 and A2780T cells detected by RT-qPCR.±s,n=3.**P<0.01,compared with A2780 cells.
2.3.3 下调PTEN 表达降低A2780T 细胞对紫杉醇的耐药性
通过脂质体转染技术转染PTEN siRNA,沉默A2780T细胞中PTEN表达。结果显示,与转染siRNA阴性对照组相比,转染PTEN siRNA 组A2780T 细胞PTENmRNA 降低60%(P<0.05,图6A)。MTT结果显示,转染PTEN siRNA组A2780T细胞存活率(P<0.05,P<0.01,图6B1)和IC50值(P<0.01,图6B2)均降低。Western 印迹法检测结果显示,与转染siRNA阴性对照组相比,转染PTEN siRNA组A2780T细胞P-gp,MRP1 和ABCG2 蛋白表达水平均降低(P<0.05,P<0.01,图6C)。由此表明,下调PTEN表达可降低A2780T细胞对紫杉醇的耐药性。
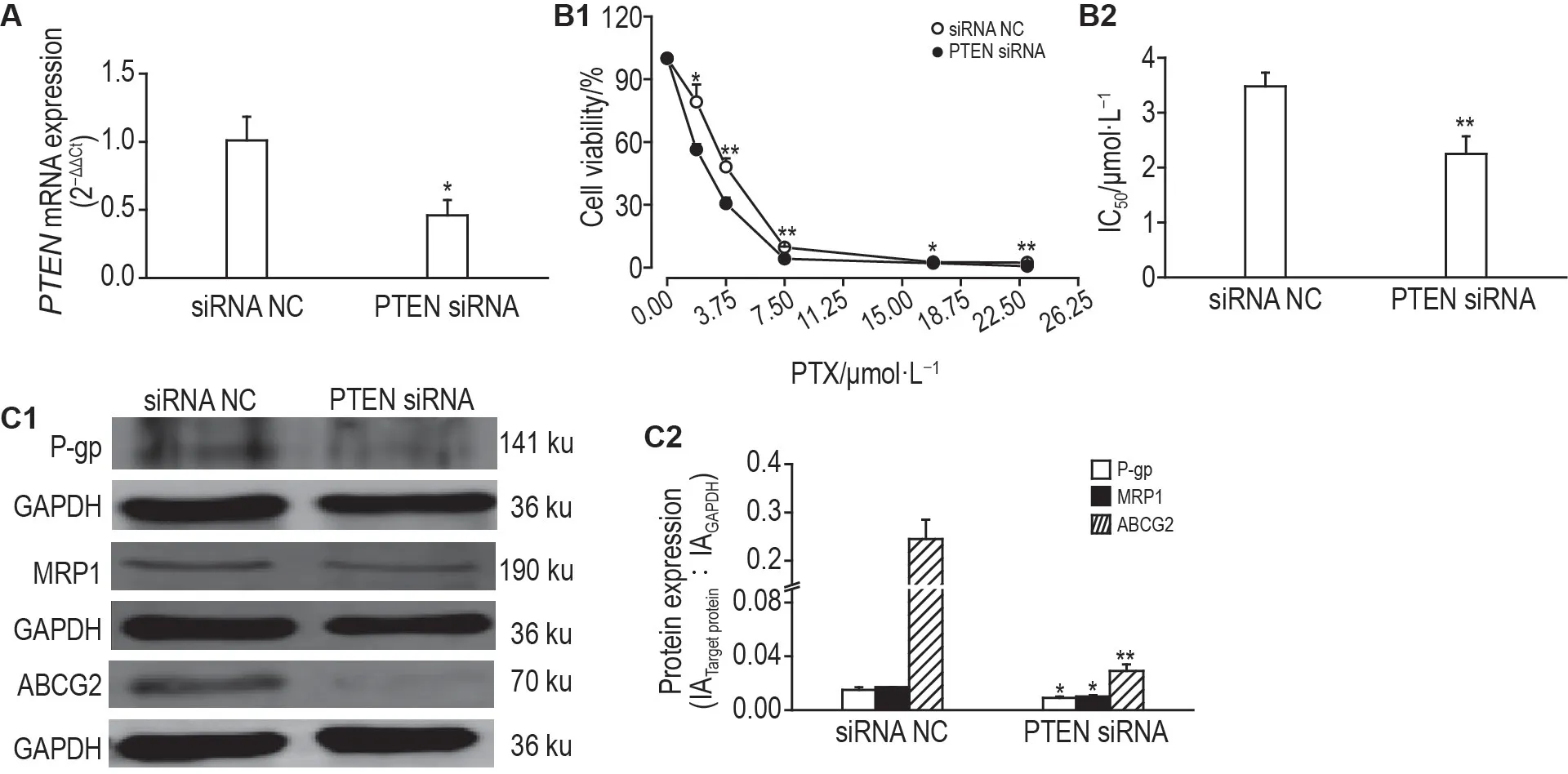
Fig.6 Effect of transfecting PTEN siRNA on proliferation and drug resistance in A2780T cells.See Fig.2B for transfecting PTEN siRNA.A:transfection efficiency assessed using RT-qPCR after transfecting A2780T cells with PTEN siRNA for 24 h.B:the cell viability(B1)and IC50(B2)of transfected A2780T cells incubated with PTX for 48 h detected by MTT assay.C:protein expressions of P-gp,MRP1 and ABCG2 measured by Western blotting,C2 was the semi-quantitative result of C1.±s,n=3.*P<0.05,**P<0.01,compared with siRNA NC group.
3 讨论
卵巢癌是预后最为不良的妇科肿瘤,高死亡率是卵巢癌的标志性特征,主要原因是疾病复发和化疗耐药[16]。已有大量研究表明,miRNA是卵巢癌的标志性分子,可以通过调节多种信号通路影响卵巢癌细胞增殖、凋亡、迁移及耐药[17],如miR-136 与人上皮卵巢癌的原发性顺铂耐药相关,miR-200c 和miR-141也被证实为卵巢癌的潜在诊断和预后生物标志物[18-20]。然而,miR-152-3p在紫杉醇耐药卵巢癌中的生物学功能和分子机制仍不清楚。
本研究观察了miR-152-3p 对A2780T 细胞紫杉醇耐药的作用。首先对A2780T细胞的紫杉醇耐药性进行了验证。结果表明,A2780T细胞耐药指数为2.8;且P-gp,MRP1和ABCG2蛋白表达均高于紫杉醇敏感细胞A2780,表明A2780T细胞对紫杉醇具有耐药性。随后用RT-qPCR 法检测了miR-152-3p在A2780T 和A2780 细胞中的表达。结果表明,A2780T细胞中miR-152-3p表达明显高于A2780 细胞,提示miR-152-3p 对A2780T 细胞耐药发挥作用。用脂质体瞬时转染技术转染miR-152-3p 抑制物降低A2780T 细胞中miR-152-3p 表达,结果发现,与转染miR-152-3p 阴性对照组比较,转染miR-152-3p抑制物后A2780T细胞存活率和细胞迁移能力明显降低,细胞凋亡率升高,且Bax 蛋白表达增加,Bcl-2 蛋白表达降低。上述结果表明,抑制miR-152-3p表达可抑制A2780T细胞增殖和迁移,促进细胞凋亡,降低A2780T细胞对紫杉醇的耐药性。
已有研究表明,miRNA 可与目的蛋白信使RNA 的3′UTR 端结合,导致目的基因信使RNA 裂解或降解,从而对目的基因进行转录后调控,抑制其表达[21]。虽然miRNA 被广泛认为负向调控下游靶基因,但也有来自体外实验的证据表明,miRNA也可以激活基因表达,如miR-93-5p 正向调控丝裂原活化蛋白激酶激酶激酶2(MAP3K2)水平抑制肝癌细胞增殖、侵袭和迁移[22];以鸟嘌呤序列结合因子1 介导的miR-G-10 正向调控磷脂酰肌醇-3-激酶调控亚基3水平激活蛋白激酶B/NF-κB信号通路抑制宫颈癌细胞迁移和侵袭[23]。据报道,心脏疾病、糖尿病和非小细胞肺癌等miR-152-3p 与PTEN 呈负向调控关系[24-26]。然而,在紫杉醇耐药卵巢癌细胞中miR-152-3p 与PTEN 的靶向关系未见报道。本研究用miRDB,Targetscan,miRWalk 和Starbase数据库预测miR-152-3p的靶基因。结果表明,PTEN是miR-152-3p的一个靶基因。用Western印迹法检测转染miR-152-3p 抑制物后A2780T 细胞PTEN 蛋白表达的变化及RT-PCR 检测A2780 和A2780T 细胞PTENmRNA 表达水平予以验证。结果表明,转染miR-152-3p 抑制物后A2780T 细胞PTEN 蛋白表达低于转染miR-152-3p阴性对照组,且A2780T细胞PTENmRNA表达水平高于A2780细胞。为此,用脂质体瞬时转染技术转染PTEN siRNA沉默A2780T细胞中PTEN表达。结果表明,与转染siRNA 阴性对照组相比,转染PTEN siRNA沉默PTEN表达后A2780T 细胞存活率和IC50值显著减低,P-gp,MRP1 和ABCG2 蛋白表达降低。由此提示,PTEN作为miR-152-3p 的靶基因,可能受miR-152-3p的正向调控,影响A2780T 细胞对紫杉醇的耐药性,其潜在机制还需进一步研究。
本研究的局限性在于仅用A2780T 细胞进行了相关的实验,若进一步探讨具体的分子机制,尚需用其他卵巢癌紫杉醇耐药细胞如紫杉醇耐药细胞SKOV-3/Taxol等进行深入研究。
综上所述,miR-152-3p 在A2780T 细胞中高表达,其表达下调可抑制A2780T 细胞增殖和迁移,促进细胞凋亡,降低A2780T 细胞对紫杉醇的耐药性,该作用可能是通过降低其靶基因PTEN表达发挥的。本研究或将为寻找并分析卵巢癌紫杉醇耐药的治疗靶点提供新方向,并为临床逆转卵巢癌耐药、提高卵巢癌治疗效果提供参考。
- 中国药理学与毒理学杂志的其它文章
- Element profiles of benzo[a]pyrene malignantly transformed 16HBE cells and joint effects of copper with cisplatin or vinorelbine on cell proliferation
- 基于细胞代谢组学的柴胡皂苷b2对皮质酮诱导PC12细胞损伤的保护作用研究
- 铅对大鼠皮质神经元γ-氨基丁酸A型受体介导电流及GABA能突触传递的抑制作用
- α-鹅膏蕈碱在大鼠体内的毒代动力学与组织分布特征
- 环状RNA在大脑功能调控及药物成瘾中的作用研究进展
- PD-1/PD-L1单抗药物抗肿瘤免疫治疗相关不良反应及超进展疾病研究进展

