PD-1/PD-L1单抗药物抗肿瘤免疫治疗相关不良反应及超进展疾病研究进展
王鹏焱,林子又,朱凯,张小雷
(1.长春中医药大学药学院,吉林长春 130117;2.中山大学药学院,广东广州 510006)
程序性死亡受体1(programmed death-1,PD-1)及其配体1(programmed death-ligand 1,PD-L1)是一对负性免疫共刺激分子,主要在抗肿瘤免疫应答的晚期阶段起作用。PD-1/PD-L1 途径通过抑制T 细胞受体信号传导通路和效应T 淋巴细胞活化进一步影响肿瘤微环境,最终产生肿瘤免疫逃逸[1]。区别于传统化疗,免疫检查点抑制剂(immune checkpoint inhibitors,ICI),如PD-1/PD-L1 单克隆抗体(单抗)利用患者自身免疫系统来消灭肿瘤细胞,目前已应用于治疗多种癌症,包括黑色素瘤、非小细胞肺癌(non-small cell lung cancer,NSCLC)和淋巴瘤等[2]。但当免疫系统错误地靶向患者的健康细胞时,就会对患者产生免疫相关不良反应(immune-related adverse reactions,irAE)[3],部分患者在使用ICI(如PD-1/PD-L1 单抗药物)治疗后出现病情加速恶化现象,即超进展疾病(hyperprogressive disease,HPD)[4]。
1 免疫检查点抑制剂临床应用及作用机制
继放疗、化疗和靶向药物治疗之后,ICI 的出现迅速改变了多种类型癌症的治疗范式。自2011年细胞毒性T 淋巴细胞抗原4(cytotoxic T lymphocyte-associated antigen-4,CTLA-4)抑制剂最初批准用于转移性黑色素瘤,目前PD-1/PD-L1 阻断疗法已成为治疗20 多种适应证的常规方法[5]。例如,在PD-1/PD-L1 阻断应用于肺癌的第一阶段研究中,6 例NSCLC 患者中,仅1 例有显著的病灶或混合肿瘤消退[6],而如今几乎所有被诊断患有转移性肺癌的患者均将PD-1/PD-L1 阻断作为治疗方式之一。目前,许多PD-1/PD-L1 单抗药物被应用于临床治疗NSCLC、黑色素瘤和肾癌[7-9],如纳武利尤单抗(nivolumab)、帕博利珠单抗(pembrolizumab)和阿替利珠单抗(atezolizumab)等。总之,ICI的开发与应用极大促进了全球癌症免疫治疗的进展。
免疫检查点是在免疫系统中限制免疫反应的调节分子,可通过“关闭”细胞毒性T 细胞实现自我耐受[10]。在正常情况下,免疫检查点可抑制T 细胞活化从而避免正常组织的损伤。同样,一些癌细胞也能利用这些检查点与细胞毒性T细胞上的受体相互作用,从而逃避宿主免疫反应。因此,免疫检查点既是癌细胞逃避免疫监视的一种机制,也是一个有前途的肿瘤治疗靶点[11]。目前,针对免疫检查点开发出了多种ICI,通过破坏使免疫效应细胞失活的抑制信号起作用。ICI 可通过破坏免疫检查点和癌细胞之间的相互作用,使T 细胞保持激活并靶向这些细胞(图1)。目前,ICI表面受体和配体靶标包括CTLA-4,PD-1和PD-L1等,这些受体和配体在某些肿瘤微环境中过表达,在癌症治疗中有重要的作用和功效[12]。
2 PD-1/PD-L1单抗药物常见的免疫相关不良反应
相比传统化疗或其他临床抗肿瘤药物,ICI治疗的不良反应轻微,其irAE 等级一般在1~2 级(发生率为90%),如及时发现处理,患者可继续使用ICI进行治疗。≥3 级的irAE 发生率偏低,为15%~42%,但有致命危险[13]。irAE 通常在治疗开始后的最初几周到几个月内发生,也可随时发生(包括ICI治疗停止后),并且可能随时间的推移而变化。下面介绍PD-1/PD-L1 单抗药物对皮肤、胃肠道、肝、肾和肺等的irAE 和临床症状(图2)、可能的发生机制及潜在的治疗方法。
2.1 皮肤不良反应
皮肤不良反应在PD-1/PD-L1 单抗药物治疗中最为常见,如纳武利尤单抗和阿替利珠单抗等皮肤不良反应总的发生率为34%[14],主要临床表现为斑丘疹、瘙痒、苔藓样皮炎和白癜风等。临床试验中,大多数皮肤不良反应为非特异性皮疹,主要在四肢及躯干呈现网状分布,伴随红斑、水肿和斑丘疹等[15]。
应用PD-1/PD-L1 单抗药物治疗黑色素瘤时,可引发患者皮肤不良反应为白癜风,发生率为11%[16],主要的临床表现为点状脱色斑,睫毛、眉毛或头发也可能脱色[17-18]。经研究表明,PD-1/PD-L1单抗药物治疗后出现白癜风的患者只需避光保护,不需额外治疗。目前尚未明确皮肤相关不良反应的发病机制,可能与嗜酸性粒细胞、白细胞介素6(interlukin-6,IL-6)、IL-10 和分泌型免疫球蛋白增高有关[19]。
此外,口服抗组胺药物、外用润肤霜或外敷金银花水均可以有效缓解PD-1单抗药物引起的<2级的irAE,且症状好转后可继续接受PD-1 单抗药物或其他免疫疗法治疗。而出现≥3 级的皮肤不良反应时,应及时中断或永久停用所有有关ICI 治疗,并开始使用全身性皮质类固醇治疗[20]。
2.2 胃肠道不良反应
胃肠道不良反应是仅次于皮肤不良反应的第二高发irAE,患者通常因出现腹泻、恶心和呕吐等反应而中断PD-1/PD-L1单抗药物的治疗[21]。PD-1单抗药物本身导致胃肠道irAE 的发生率为6%~16%,以轻中度的腹泻和结肠炎为主[22]。但当PD-1单抗与CTLA-4 单抗联合使用时,胃肠道irAE 的发生率大幅提高至44%,并伴随病情加重,发生重度腹泻[23]。
有研究表明,对肠道菌群的监控能有效降低PD-1/PD-L1 单抗药物治疗所引起的胃肠道不良反应[24]。在对黑色素瘤患者进行抗PD-1 免疫治疗的研究中,分别对PD-1 单抗治疗有应答与无应答患者肠道微生物进行了宏基因组分析。结果表明,在有应答和无应答患者之间,肠道微生物组的多样性和组成有显著差异,有应答患者肠道菌群更丰富,通过增加抗原呈递、改善外周及肿瘤微环境中的效应T 细胞功能,进一步增强抗肿瘤免疫反应[25],表明在进行抗PD-1 治疗时,可对肠道菌群进行有效调控,以提高治疗效果,降低不良反应。
经结肠镜诊断irAE<2 级的胃肠道不良反应患者,应避免食用高纤维和高乳糖食物,同时可使用胃肠动力抑制剂和补液等方式进行治疗[26]。若患者持续出现2 级或≥3 级irAE,需立即终止或永久停用PD-1/PD-L1 单抗药物的治疗,并大量使用糖皮质激素;若3 d 后无明显改善,推荐使用英夫利昔单抗(infliximab)进行治疗。若出现胃穿孔等突发性症状,则应立即进行手术治疗[27]。
2.3 肝毒性
PD-1/PD-L1 单抗药物引起的免疫介导性肝炎也称自身免疫性肝毒性。ICI 有关的免疫性肝毒性的总体发生率在5%~10%,irAE≥3 级的肝炎发生率仅为1%~2%。当使用PD-1 单抗与CTLA-4 单抗(如纳武利尤单抗与伊匹单抗)联合治疗时,irAE≥3级的肝炎发生率将提高至59%[28]。
目前关于肝毒性通过免疫介导所引起的irAE的发生机制尚未明确。免疫检查点分子在肿瘤细胞中存在的同时也在T 细胞中表达,靶向分子的单抗可能直接通过对T 淋巴细胞作用引起自身免疫,从而导致损伤的发生。如果自身免疫与PD-1 不耐受,靶向分子治疗肿瘤时可能会打破自身耐受,引起肝或其他器官自身免疫性损伤。而肿瘤免疫治疗导致肝毒性的可能机制可能类似于自身免疫性肝炎,主要是T 淋巴细胞起作用。两者的不同点在于,特发性的自身免疫性肝炎的损伤是永久性存在的,而免疫治疗所引起的肝毒性在取消药物治疗时可消失[29]。
使用PD-1/PD-L1 单抗药物治疗期间可通过临床检验分析谷丙转氨酶、谷草转氨酶或总胆红素等指标来诊断肝毒性。转氨酶水平为正常上限的3~5,5~20 和20 倍时,分别归类为2,3 和4 级。同样,总胆红素浓度为正常上限的1.5~3,3~10 和10 倍时,分别归为2,3 和4 级[30]。PD-1/PD-L1 单抗药物引起的相关肝毒性是一种严重的免疫相关不良事件,应及早发现并积极治疗。在进行PD-1/PD-L1 单抗药物治疗时,应定期对患者进行肝功能检查。晚期肝毒性的应对对策包括停止治疗和立即使用全身性皮质类固醇。在难治性病例中,需要使用其他免疫抑制剂。许多患者在7周内逐量减少口服全身性皮质类固醇对肝毒性有疗效。当肝毒性患者出现对类固醇耐药时,可用环孢菌素进行辅助治疗[31]。
2.4 肾毒性
相对来说,irAE 中肾毒性的发生率不高。使用帕博利珠单抗或纳武利尤单抗治疗的患者出现肾毒性或肾功能衰竭的发生率为1%[32]。PD-1/PDL1单抗药物表现的症状主要有肾炎、肾功能衰竭和狼疮性肾炎等。临床试验中,应用PD-1 单抗的患者中13%~22%出现急性肾功能恶化,0.4%~0.9%发生肾炎[33]。
肾毒性与免疫治疗明显相关,但其机制尚未完全阐明。研究表明,CTLA-4 单抗伊匹单抗可能会耗尽过度表达CTLA-4 的调节性T 细胞(regular T cells,Treg)。不同IgG类别之间的糖基化模式也不同,这会影响肾对药物的清除率[34]。PD-1 在免疫细胞中的表达模式与CTLA-4 有一些相似之处,但也有一些重要区别。PD-1在T细胞上表达,在静息幼稚T 细胞和记忆T 细胞上诱导表达。T 细胞受体参与触发时间密集型转录程序的激活,导致PD-1的产生并插入质膜。一旦在T 细胞受体结合的T 细胞表面表达,PD-1 即可与PD-L1 或PD-L2 配体结合,从而抑制T 细胞受体并增强组织中T 细胞的迁移。因此,同种药物的修饰可能会影响肾毒性的发生率和严重程度。患者在接受免疫性治疗时,应定期在治疗前进行血清学检查(包括电解质和肾功能等)。若发现肾功能指标检测异常,需立即停止使用PD-1/PD-L1 单抗药物,严重者需要进行肾穿刺活检。
2.5 免疫相关性肺炎
据报道,在PD-1/PD-L1 单抗单独给药时,免疫性治疗引起免疫相关肺炎的发生率<5%,而进行PD-1/PD-L1单抗联合治疗后该发生率反而提高,中位发病时间为10~12 周,其初始症状可能是非特异性的。不同类型的肿瘤中免疫性相关肺炎的发生率不同,NSCLC 和黑色素瘤患者≥3 级irAE 的发生率较高[35]。
PD-1/PD-L1 单抗引起相关肺炎的确切机制尚不清楚。有报道认为,T 淋巴细胞可在急性感染期间调节树突状细胞和巨噬细胞功能。此外,PD-1可诱导负反馈减弱先天性Toll样受体和细胞因子信号传导引起的免疫炎症反应和组织损伤[36-38]。PD-1单抗引起肺部不良反应的主要症状有呼吸困难、肺炎、急性纤维蛋白机化性肺炎、机化性肺炎、嗜酸性粒细胞性肺炎、成人呼吸窘迫综合征和肺空洞等。应定期监测患者肺功能和连续脉搏血氧饱和度,并适当补充氧气。出现3级或4级irAE 相关性肺炎的患者应入院,接受专家会诊,并接受大剂量全身性皮质类固醇治疗[39]。如果在3~6 h的初始观察期内症状出现进展,具有2 级irAE 相关性肺炎的患者也应接受全身性皮质类固醇治疗和住院治疗。免疫相关性肺炎一旦发生,发病速度极快。因此,对接受PD-1/PD-L1 单抗药物治疗的癌症患者进行及时和高效地检测能明显降低其发病率和死亡率[40]。
2.6 风湿性免疫疾病
在ICI治疗期间约15%的患者报告了风湿性关节痛和几种风湿病并发症,包括关节痛、炎性关节炎、类风湿性关节炎样疾病、炎性肌病、硬皮病和血管炎等。这些并发症在作用于PD-1 轴的ICI 治疗中更为常见,且往往比大多数其他irAE 发生较晚[41-42]。类似类风湿性关节炎和血清阴性脊柱关节病的综合征中的一小部分患者伴有类风湿因子或抗环瓜氨酸肽抗体滴度升高,这类患者通常可使用泼尼松进行治疗,但对于类固醇耐药患者应使用改善疾病的抗风湿药物或肿瘤坏死因子α 抑制剂(如英夫利昔单抗)进行治疗,且根据患者状态可适当延长治疗时间甚至长期治疗[43]。
3 PD-1/PD-L1单抗药物引起免疫相关不良反应的可能机制
目前,关于PD-1/PD-L1 单抗药物引起irAE 的机制尚不明确,大多认为可能与细胞因子释放综合征(cytokine-release syndrome,CRS)有关。CRS是一种不受控制的全身性炎症反应,可能危及生命。患者通常在免疫治疗1 周内或注射派姆单抗(lambrolizumab)1 d 后出现CRS,常伴随特征性发热、全身不适、肌痛和其他类似流感的症状。不同患者的症状在范围、严重程度和持续时间上有很大差异。严重情况下,患者可能会出现低血压、毛细血管渗漏、缺氧、肺水肿、多器官功能衰竭,甚至可能死亡[44]。最近批准的几种新型免疫治疗药物如派姆单抗和德瓦鲁单抗(durvalumab)等的使用与CRS的高风险相关[45]。
有研究表明,CRS 可能是由肿瘤和免疫效应细胞之间的相互作用导致大量细胞因子释放所致。细胞因子的初始来源可以是靶细胞本身,也可以是已募集到肿瘤部位的免疫细胞。这些“连锁反应”导致免疫细胞过度激活,如巨噬细胞在正反馈回路中进一步诱导IL-1、IL-6、IL-8、IL-10 和单核细胞趋化蛋白1 等炎症反应细胞因子的释放,最终导致细胞因子风暴(图3)[46]。其中,IL-6 有助于宿主防御感染和组织损伤。高水平的IL-6 可以激活凝血途径和血管内皮细胞,抑制心肌功能,但在对抗环境压力的同时IL-6 的过量分泌会导致细胞因子风暴的产生[47]。据报道,使用PD-1/PD-L1 单抗治疗黑色素瘤、肾细胞癌和结直肠癌等时引起的自身免疫内分泌疾病与免疫耐受的破坏相关,如甲状腺功能障碍患者的自身甲状腺抗体增加[48]和糖尿病患者特异性CD8+T细胞抗原增加[49]。
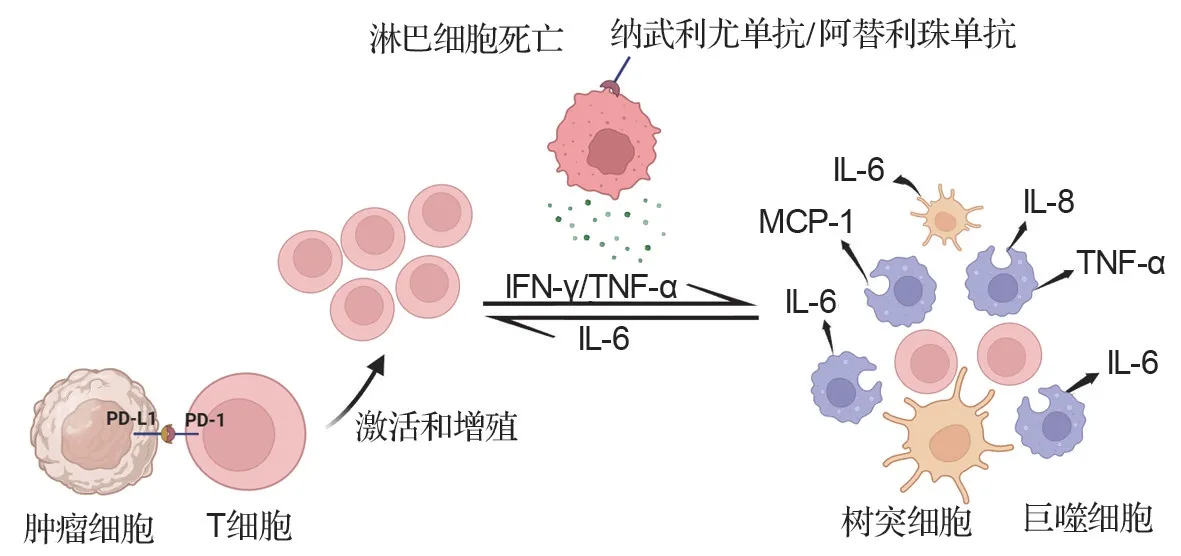
图3 PD-1/PD-L1 单抗药物导致细胞因子释放综合征发病机制.IFN-γ:干扰素γ;TNF-α:肿瘤坏死因子α;IL-6:白细胞介素6;MCP-1:单核细胞趋化蛋白1.
临床上大多是CTLA-4 单抗与PD-1/PD-L1 单抗联合使用。免疫检查点分子CTLA-4 和PD-1/PD-L1 存在于T 细胞表面,并与位于抗原呈递细胞或靶细胞表面的受体结合。PD-1 在免疫细胞中的表达模式与CTLA-4 有一些相似之处。CTLA-4 的作用在于T 细胞受体识别抗原后,通过T 细胞上的CD28和抗原呈递细胞上的CD80/86相互作用介导的共刺激。此外,CTLA-4在活化的T细胞、CD25+、CD4+和Treg 细胞亚群上被诱导表达[50]。由于CTLA-4 与CD28 的同源性约为30%,CTLA-4 以较高的亲和力结合CD80/86,并干扰CD28 与CD80/86 的结合,通过降低IL-2 和IL-2 受体的表达导致T细胞介导的免疫应答下降。此外,CTLA-4 在Treg细胞上的表达也会产生免疫抑制作用。在肿瘤微环境中,抗CTLA-4 治疗可干扰T 细胞分化,并在周围清除Treg细胞[51]。
另外,PD-1 是免疫球蛋白表基因家族成员,作为一种抑制性受体,在活化的T 细胞和B 细胞表面表达,以维持外周耐受[52]。PD-1 可与PD-L1 和PD-L2 相互作用,这2 种配体不仅在抗原递呈细胞上表达,而且在外周血组织中也有表达。抗原递呈细胞在干扰素γ(interferon-γ,IFN-γ)或IL-17A 刺激下强表达PD-L1,而PD-L2 的表达受IL-4 刺激的驱动[53]。此外,在Th1介导的接触超敏反应、Th2介导的特应性皮炎样皮肤炎症反应、Th17介导的银屑病样皮炎小鼠模型中实验表明,PD-L1 敲除小鼠中Th1 和Th17 型免疫模型均被加速,而PD-L2 敲除小鼠中Th2 型免疫模型的表型加重[54]。综上所述,PD-L1 在Th1 和Th17 型免疫中起主导作用,而PD-L2 参与Th2 型免疫。上述结果表明,抑制PD-1信号通路可诱导多种类型的irAE,然而阻断PD-L1与PD-1 的结合可能只能诱导Th1 和Th17 介导的irAE。
4 PD-1/PD-L1单抗药物其他罕见免疫相关不良反应
4.1 心脏毒性
由于PD-1 和PD-L1 均在人心肌细胞中表达,肿瘤浸润性淋巴细胞在肿瘤抗原长期刺激下高表达PD-1。PD-L1与PD-1结合后可诱导T细胞凋亡、失能和耗竭,进而抑制抗肿瘤功能。当PD-1/PD-L1作为淋巴瘤的治疗靶点时,易引发心脏毒性不良反应。ICI 相关的心脏毒性很少见,且诊断复杂,但死亡率高达27%~50%。据统计,约0.9‰接受ICI 治疗的患者会产生心脏毒性,与单药治疗相比,联合使用ICI 治疗相关心脏毒性的风险会提高5 倍[55]。其主要的临床症状有心脏骤停、心力衰竭、心肌梗死、心肌炎、心包炎、心肌病、心包填塞、心脏传导阻滞和心肌纤维化等。心脏毒性的中位发病时间为治疗开始后的第17~34 天,但也可能发生在治疗后6周或更长时间[56-58]。
临床上通常使用心脏生物标志物血清肌钙蛋白对免疫相关心脏毒性进行诊断,同时应密切监测患者其他并发症,包括心律失常和心力衰竭等,并咨询心脏病专家进行管理。此外,如若患者有心包积液伴填塞生理的症状需要及时进行心包引流[59];同时考虑到心源性猝死的可能性,应立即停用ICI治疗并开始全身性大剂量皮质类固醇治疗。
4.2 眼毒性
眼部毒性在单用PD-1 抑制剂或联合治疗中均有报道。最常见的眼部irAE 是干眼症,此外也包括葡萄膜炎、溃疡性角膜炎、脉络膜新生血管和眼眶炎症等几种眼部疾病。眼部irAE 程度应由眼科专家进行评估,轻度irAE 可用眼部润滑剂和外用皮质类固醇治疗,而严重炎症或对局部治疗无反应的患者应使用全身性皮质类固醇[60]。
4.3 神经系统毒性
PD-1/PD-L1 单抗联合CTLA-4 单抗治疗肺癌时发现免疫介导性脑炎等神经系统毒性。经ICI 治疗患者中,神经系统irAE 发生率为6%~12%,并且通常属于轻度级别。轻度神经系统irAE 包括头痛、头晕和感觉障碍等非特异性症状。重度神经系统irAE 很少见,发病率<1%[61],症状包括脑膜炎、脑炎、贝尔麻痹、格林巴利综合征、中枢神经系统脱髓鞘和重症肌无力等[62]。神经系统irAE 诊断困难,应根据需要通过中枢神经系统影像学检查和脑脊液分析进行评估。当神经系统irAE 确诊后,应中断相应ICI 治疗并开始全身性皮质类固醇治疗。而对皮质类固醇和静脉注射免疫球蛋白无反应的ICI 相关脑炎病例,可使用利妥昔单抗(rituximab)进行治疗,但现有文献仅限于病例报告[63]。
5 几种PD-1/PD-L1单抗药物的免疫相关不良反应
5.1 PD-1单抗
5.1.1 纳武利尤单抗
纳武利尤单抗已被批准用于治疗转移性NSCLC。临床试验表明,与细胞毒性药物化疗相比,纳武利尤单抗可有效延长患者的生存期[64]。该单抗在NSCLC 患者群体中有比较良好的耐受性,在129例NSCLC 患者中仅有14%出现反复发作的3 级irAE 或严重4 级irAE。此外,大量纳武利尤单抗Ⅰ期临床试验数据表明,用药患者主要产生3 级或4 级irAE,主要的irAE 表现为消化系统紊乱和内分泌失调,此时应永久性停用纳武利单抗[65]。
5.1.2 帕博利珠单抗
帕博利珠单抗是一种人源化单克隆IgG4κ 抗PD-1单抗,其与PD-1结合而不与Fc受体结合或激活补体,因此无细胞毒性。
由于最佳治疗时间未确定,帕博利珠单抗可给予2年治疗时间,其irAE 可发生在治疗后期甚至停止治疗后。目前的数据表明,帕博利珠单抗治疗后会出现罕见的危及生命或致命的irAE 病例,包括严重的皮肤反应和暴发性1 型糖尿病[66]。1~2 级irAE通常可以对症处理,如高达20%患者出现的疲劳症状。对于内分泌型的irAE 可能需要特殊治疗,如激素替代疗法(甲状腺功能减退和糖尿病),其中甲状腺功能减退可能是轻微的,在甲状腺素实际下降之前,促甲状腺激素会无症状地增加,因此接受帕博利珠单抗治疗的患者应定期监测甲状腺功能。对于肺炎,这是相对少见且更严重的irAE(1~4 级:4%~6%;3~4 级:0%~2%),可能引起更高的发病率甚至死亡率,临床表现从肺部浸润到严重肺炎。在已有肺部疾病的患者中,病情可能会迅速恶化。因此,需要及时识别肺炎等级并进行相应治疗。1 级肺炎(有临床症状但无影像学改变)通常需要密切的临床和放射学监测。对于2 级irAE 相关性肺炎,皮质类固醇治疗是必要的;3 级和4 级irAE 相关性肺炎需要大剂量皮质类固醇治疗或永久停止免疫治疗[67]。
5.2 PD-L1单抗
5.2.1 阿替利珠单抗
阿替利珠单抗是一种人源化单抗,作为PD-L1阻断剂选择性靶向PD-L1 以防止与受体PD-1 和B7-1(一种共刺激细胞表面蛋白)相互作用,逆转T细胞抑制。2016年,单药阿替利珠单抗被美国食品药品监督管理局(FDA)批准用于治疗转移性尿路上皮癌和NSCLC[68]。阿替利珠单抗也被证明在其他实体瘤患者中具有良好的安全性和临床疗效。在Ⅰ期临床中其主要有乏力、低热和恶心等轻度不良反应,安全性较好,很少发生严重不良反应。
5.2.2 德瓦鲁单抗
德瓦鲁单抗是2017年获得美国FDA 批准上市的PD-L1 单抗。临床数据表明,其安全性较好,目前尚未发现会引发很严重的不良反应发生,如肺炎、爆发性高血糖和结肠炎等[69]。
5.2.3 阿维鲁单抗
阿维鲁单抗(avelumab)是一种完全人IgG1单抗,通过免疫检查点抑制和抗体依赖细胞介导的细胞毒性杀死癌细胞。在一项包含3935 例癌症患者的临床疗效和不良反应试验中发现,与常规治疗相比,阿维鲁单抗可治疗多种肿瘤且可降低irAE 的发生率,其综合客观有效率为14.18%。与PD-L1 阴性患者相比,PD-L1 阳性患者对阿维鲁单抗单药治疗响应率高。使用阿维鲁单抗后的治疗相关不良事件(treatment-related adverse event,TRAE)的总发生率为73.78%,高级别TRAE 的总发生率为14.44%,严重TRAE 的总发生率为6.07%,致命TRA 的总发生率为0.44%,免疫相关TRA 的总发生率为17.86%,高级别TRAE 的总发生率为3.22%[70]。
6 PD-1/PD-L1单抗药物免疫治疗后的超进展疾病现象
ICI 如PD-1/PD-L1 单抗和CTLA-4 单抗对多种癌症患者均有效,然而其引发的另一严重不良反应——HPD 目前逐渐受到关注。HPD 是抗PD-1/PD-L1 治疗癌症患者出现的一种新的进展模式,其发生发展十分迅速,患者的生存率低,这也限制了ICI的临床应用。因此,提前预测HPD 风险、提出有效的治疗方案非常必要[71]。
6.1 超进展疾病定义和评价
ICI 因其在不同肿瘤类型中具有持久而显著的作用,并大大延长患者生存时间。因此,ICI 正逐渐取代化疗成为晚期恶性肿瘤治疗的基石。然而,并非所有患者都能对ICI 产生反应,甚至在许多临床研究中观察到ICI 治疗后肿瘤快速生长,包括肿瘤细胞加速增殖和疾病快速进展。这种快速进展现象称为HPD[72]。作为一种新型的肿瘤反应,HPD的特点是肿瘤以意想不到的速度快速进展。目前临床上通常以治疗失败时间(time to treatment failure,TTF)、肿瘤体积增长速度(tumor growth rate,TGR)以及肿瘤生长动力学(tumor growth kinetics,TGK)来衡量是否属于HPD,包括TTF≤2 个月、TGR≥2以及TGK≥2[73]。
黑色素瘤、肺癌、肾癌、结直肠癌和尿路上皮癌等患者,使用PD-1/PD-L1 抑制剂治疗的HPD(12/131)的发病率相比于化疗组患者增加9%,这也表明HPD 发病不限于特定的肿瘤。此外,基于多种癌症的Ⅰ期治疗中的TGR 标准,182 例使用ICI 患者HPD的发病率为7%[74]。
6.2 超进展疾病的生物标志物
HPD 已在多种癌症中发现,包括NSCLC、头颈部鳞癌、黑色素瘤、淋巴瘤以及结直肠癌、尿路上皮癌、胆道癌和卵巢癌等。此外,未发现HPD 与其他临床特征之间存在关联,包括血液成分、基线治疗时使用皮质类固醇的情况(由RECIST 估计)、全身系统治疗、常规评估的生化参数(如淋巴细胞计数和细胞群)、PD-1/PD-L1 表达和RMH 评分等。为避免ICI 治疗引起的损伤,开发肿瘤细胞生物标志物和肿瘤微环境生物标志物用于HPD 预测非常必要。
Treg 细胞是CD4+细胞的一个亚群,可特异性表达叉头盒蛋白P3(FoxP3),在调节肿瘤微环境中的抗肿瘤T细胞反应中发挥关键作用。PD-1/PD-L1在Treg 细胞上表达,因此Treg 细胞的活性可能受到PD-1/PD-L1 阻断的影响。据报道,人类和小鼠中PD-1 的阻断或缺乏均会增强Treg 细胞活化[75-76]。PD-1 阻断治疗增加Treg 细胞中的T 细胞受体和CD28 信号,从而增强CD4+T 和CD8+T 细胞的增殖和抑制活性,进一步引起强烈免疫抑制从而阻碍效应T细胞的功能。其次,PD-1阻断治疗通过限制抗原呈递细胞的激活和CD8+T 细胞的进入(共刺激分子CD80/CD86 的下调),使具有高表达CTLA-4的活化PD-1+Treg细胞募集更多的Treg细胞。IL-2 被激活的PD-1+Treg 细胞迅速吸收,并在肿瘤反应中远离效应T 细胞。在PD-1/PD-L1 单抗药物治疗后,腺苷和吲哚胺2,3-双加氧酶均被上调,以促进Treg 细胞的扩增和诱导。Treg 细胞通过抑制免疫效应细胞的细胞毒活性来抑制IFN-γ。一般来说,PD-1 阻断治疗的抗肿瘤功效可能受PD-1+Treg 细胞和效应T 细胞的调节。而在HPD中,由于PD1+Treg 细胞的优势状态和效应T 细胞从杀伤中逃逸,肿瘤细胞会不受控制地生长[77-78]。
T 细胞功能障碍定义为T 细胞衰竭,抑制性受体的种类和数量显著增加。抑制性受体包括有PD-1、淋巴细胞活化基因3(lymphocyte activation gene-3,LAG-3)、T 细胞免疫球蛋白和ITIM 结构域(T cell immunoresceptor with immunoglobulin and ITIM domains)和T 细胞免疫球蛋白黏蛋白3(T cell immunoglobulin and mucin domain-containing protein 3,TIM3)。此外,T 细胞的功能障碍包括细胞因子产生减少、杀伤效果受损和增殖不足。在经ICI治疗后,代偿性免疫检查点可能过度表达,从而调节局部免疫抑制和逃逸。研究发现,在2例NSCLC患者和肺腺癌小鼠模型中使用ICI 发生肿瘤进展时,其肿瘤浸润性CD8+T 细胞中均发现了TIM3 过表达[79]。同样,在卵巢癌小鼠模型中,PD-1 阻断导致细胞毒性CD8+T 细胞上的CTLA-4 和LAG3 上调[80]。随着上述代偿性受体的表达,CD8+T细胞在产生细胞因子、增殖和迁移等方面表现出严重的功能障碍。由于高浓度的新抗原,HPD 患者衰竭的T细胞会被再次衰竭,无法重新成为清除旧抗原的记忆T细胞。此外,在ICI治疗期间,PD-1/PD-L2抑制性信号通路的组合可抑制T 细胞,PD-1 或CD80 通常不与T 细胞表面PD-L2 结合而是在内皮细胞、巨噬细胞和树突状细胞上表达[81]。
M1和M2肿瘤相关巨噬细胞(tumor-associated macrophages,TAM)是参与免疫治疗反应的TAM的亚型。M2 巨噬细胞与促肿瘤特性有关,而M1 巨噬细胞则促进抗肿瘤免疫。临床研究发现,M2 巨噬细胞的存在与多种肿瘤的不良预后相关[82]。在小鼠肺腺癌模型中,TAM 的消耗可能会抑制肿瘤的生长,由于趋化因子C-C 基序受体2(recombinant chemokine C-C-motif receptor 2)激活和趋化因子C-C 基序配体2(chemokine C-C motif ligand 2)信号传导的破坏导致M2巨噬细胞募集减少[83]。已有研究表明,巨噬细胞能直接抑制T细胞的反应,阻断巨噬细胞集落刺激生长因子与受体如集落刺激因子1 受体(colony-stimulating factor 1 receptor,CSF-1R)的结合可能导致肿瘤排斥。在胰腺癌模型中,增加IFN-γ 产生和降低M2 巨噬细胞均有助于克服潜在耐药性。此外,联合使用PD-1 或CTLA-4 单抗阻断CSF-1R,可加强肿瘤消退。据报道,用PD-1 单抗治疗后,M2 巨噬细胞(M2 样CD163+CD33+PD-L1+簇状上皮样巨噬细胞)浸润增加,加速肿瘤进展,这可能是由于Fc 受体与PD-1/PD-L1 单抗特异性免疫表型之间的结合会引发M2巨噬细胞的聚集,导致M2 巨噬细胞的功能重编程为更具侵袭性的促肿瘤表型。因此,HPD 倾向于在具有特定遗传和免疫特征的患者中诱发[84]。综上,PD-1/PD-L1 单抗药物治疗中,Treg 细胞可能存在的HPD的生物标志物见图4。
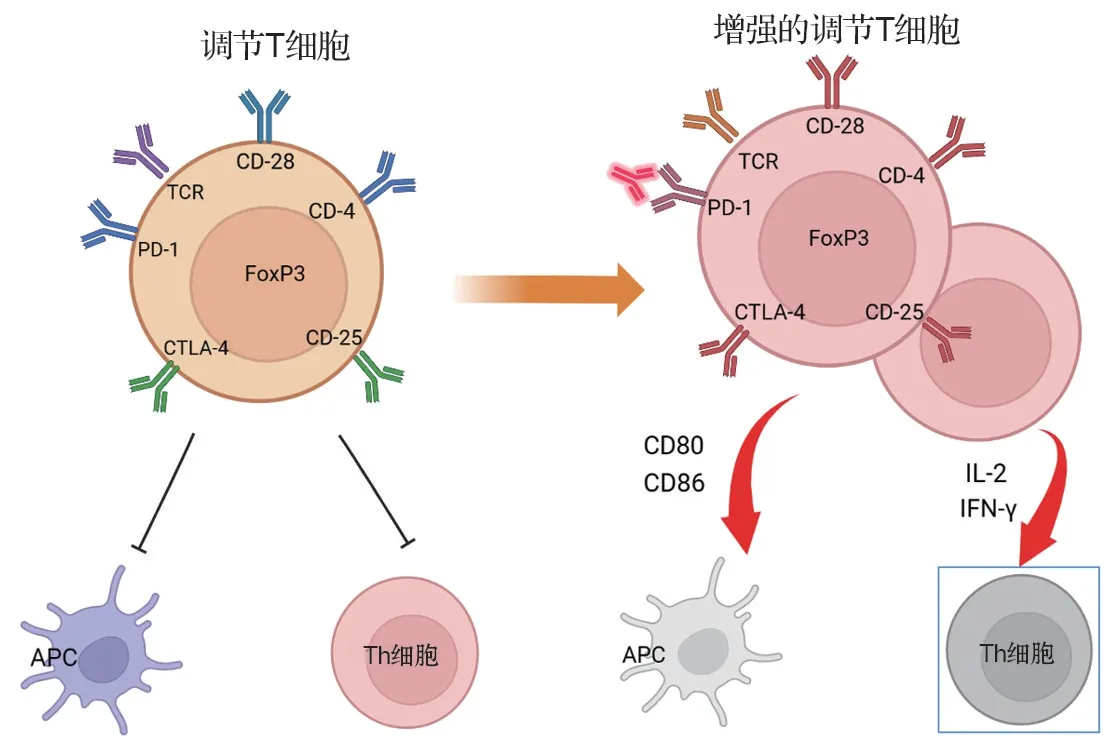
图4 PD-1/PD-L1 单抗药物治疗中发生超进展疾病可能存在的生物标志物.APC:抗原呈递细胞;FoxP3:叉头盒蛋白P3;TCR:T细胞(抗原)受体.
6.3 超进展疾病可能的发生机制
肿瘤细胞的内在机制和外在机制共同驱动了对抗癌免疫疗法的初步耐药性。肿瘤细胞的内在机制包括肿瘤细胞中肿瘤抗原表达和抗原呈递的缺失,其主要是通过人白细胞抗原表达的缺失或抗原处理机制的改变以及肿瘤细胞内分泌失调导致的。编码PD-L1基因的固有表达,或由于IFN-γ 信号通路突变,特别是非受体酪氨酸激酶1/2 突变,均能导致肿瘤细胞对T细胞不敏感[85-86]。肿瘤细胞的外在机制包括替代性免疫检查点(如LAG-3 或TIM3)的表达使T 细胞衰竭;肿瘤浸润免疫抑制细胞如Treg 细胞、M2(CD68+CD163+)巨噬细胞或骨髓来源抑制性细胞浸润;参与免疫抑制代谢途径相关酶如吲哚胺2,3-二氧化酶1 或精氨酸酶1/2 的过度表达,以及向肿瘤微环境释放免疫抑制细胞因子(如IL-10 或TGF-β)或代谢产物(如ATP、ADP 或腺苷)。此外,PD-1/PD-L1单抗治疗中HPD的发生还可能是由免疫相关因子的多效效应和免疫信号通路的冗余(redundancy)等多种生理机制引起的(图5)。
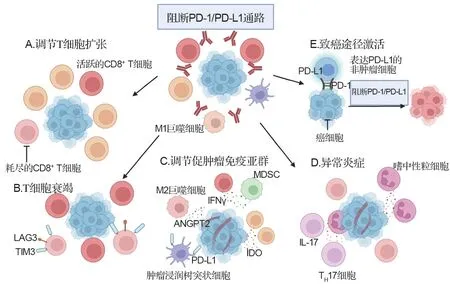
图5 阻断PD-1/PD-L1通路造成超进展疾病可能的机制.A:PD-1/PD-L1轴的阻断可能在功能上促进调节性T(Treg)细胞,导致免疫抑制肿瘤微环境;B:PD-1/PD-L1 被阻断后可能导致T 细胞耗竭增加;C:PD-1/PDL1 抑制可能会影响免疫抑制细胞亚群极化,如M2 巨噬细胞、树突状细胞(DC)或髓源性抑制细胞(MDSC),导致免疫抑制细胞因子或可溶性介质分泌;D:PD-1/PD-L1 阻断可能触发由辅助T 细胞1(Th1)和Th17 细胞介导的不受控制的炎症反应;E:PD-1/PD-L1阻断可能通过激活致癌信号通路直接影响肿瘤细胞.LAG3:淋巴细胞活化基因3;IDO:吲哚胺2,3-双加氧酶;MDSC:骨髓来源抑制性细胞;TIM3:T 细胞免疫球蛋白及粘蛋白结构域分子3;ANGPT2:血管生成素2.
尽管对HPD 发生机制有一定的了解,但HPD分子和免疫学基础研究仍不能满足临床医学需求,ICI 的耐药性与肿瘤生长之间的相互作用关系仍需进一步探索。目前进行的大多数非临床研究均集中在免疫检查点在驱动肿瘤和促进免疫抑制中的作用[87],但ICI 或其他分子也可能有助于癌症免疫编辑(cancer immunoediting)[88]。总之,为更好地监测患者病程并为患者选择最佳的治疗方法,在临床使用ICI 药物时免疫检查点是需要重点关注的因素。
6.4 超进展疾病风险预警和预案策略
目前尚无评估HPD风险的统一标准,临床上应探索治疗HPD 患者的有效策略。表现出HPD 临床特征的患者应暂停进一步的ICI 治疗,临床状况良好的患者应及早重新评估并改用另一种可能有效的治疗方法,如化疗。然而,HPD 的快速恶化限制了对患者进行其他治疗的机会。由于缺乏相关文献报道,化疗是否影响HPD患者的总生存期尚不清楚。已有研究报道,免疫治疗进展后患者对化疗的反应并不理想[89-90]。关于肿瘤免疫微环境的研究将有助于识别特定的免疫抑制细胞亚群和替代性免疫检查点,这为进一步探索免疫调节剂提供了思路。总之,应尝试评估ICI使用时HPD状态,并预先与患者沟通HPD 风险,充分告知利弊及HPD 可能;再优化当前免疫疗效评价体系,从而获得最佳管理,使患者从替代疗法中更多获益。
7 结语
免疫检查点阻断是一种越来越重要的癌症治疗方法。ICI治疗较化疗具有更好的安全性,且大多数不良反应可逆。尽管在免疫治疗后会普遍发生irAE 且症状较轻,但其发展为≥3 级后致死率非常高。另外,心肌炎、肺炎、结肠炎和神经系统等不良反应一旦发生也会直接导致患者死亡。中度至重度irAE 的管理通常包括停止ICI 治疗和开始使用免疫抑制剂如皮质类固醇。此外,免疫治疗出现HPD也逐渐引起人们的关注。有数据表明,9%~23%患者在PD-1/PD-L1 单抗药物治疗期间发生了肿瘤的快速生长。当然,特定抗肿瘤疗法可能刺激肿瘤进展的观点仍存在争议。免疫治疗出现HPD 的原因很多,目前还无法通过单一的治疗方法克服,需进一步评估患者对ICI 治疗的反应,进行多维研究,整合最佳方法,以识别和管理HPD 患者,得到治疗最大获益。综上所述,目前PD-1/PD-L1 单抗药物irAE的机制研究和生物标志物的筛选可能是未来研究的热点,相信其可以给癌症患者带来更大的获益。
- 中国药理学与毒理学杂志的其它文章
- Element profiles of benzo[a]pyrene malignantly transformed 16HBE cells and joint effects of copper with cisplatin or vinorelbine on cell proliferation
- 基于细胞代谢组学的柴胡皂苷b2对皮质酮诱导PC12细胞损伤的保护作用研究
- miR-152-3p表达下调降低紫杉醇耐药人卵巢癌细胞A2780T对紫杉醇的耐药性
- 铅对大鼠皮质神经元γ-氨基丁酸A型受体介导电流及GABA能突触传递的抑制作用
- α-鹅膏蕈碱在大鼠体内的毒代动力学与组织分布特征
- 环状RNA在大脑功能调控及药物成瘾中的作用研究进展

