α-鹅膏蕈碱在大鼠体内的毒代动力学与组织分布特征
卢玉梅,付旭宪,罗芳,朱恩槿,熊根,赵金阳,付廷昊,聂胜洁,王蕊,李树华
(昆明医科大学1.法医学院,3.基础医学院,云南昆明 650500;2.昆明市公安局刑侦支队刑科所,云南昆明 650500)
毒蘑菇因其种类繁多,分布广泛,且外观与可食用蘑菇极其相似[1],误食导致中毒事件在世界范围内频发,引起严重的全球性公共卫生问题。在蘑菇中毒事件中,90%由含鹅膏肽类毒素的剧毒鹅膏引起[2]。鹅膏毒肽是鹅膏肽类毒素中的一类,是具有双环的八肽,易溶于水、甲醇、乙醇和吡啶等溶剂[3],化学性质稳定,耐热,一般的烹调加工不会破坏其毒性。鹅膏毒肽主要包括α-鹅膏蕈碱(α-amanitin)、β-鹅膏毒肽和γ-鹅膏毒肽等,其中α-鹅膏蕈碱是剧毒鹅膏中最主要的毒性成分[4]。α-鹅膏蕈碱主要通过抑制真核细胞RNA 聚合酶Ⅱ影响mRNA转录和蛋白质的合成[5],进而导致肝、肾及多器官功能衰竭[6-8]。针对误食剧毒鹅膏引发的中毒事件及产生的社会影响,有研究建立了酶联免疫吸附测定法[9]、气相色谱-质谱联用法[10]、液相色谱法[11-12]、液相色谱-串联质谱(LC-MS/MS)法[13-14]和毛细管电泳法[15]等多种检测鹅膏毒肽的方法,但α-鹅膏蕈碱的体内代谢动力学研究只有少量文献[16-19]报道。本研究采用大鼠单次ip 给予α-鹅膏蕈碱,测定血液和组织中的α-鹅膏蕈碱浓度,研究α-鹅膏蕈碱在大鼠体内的毒代动力学与组织分布特点,为剧毒鹅膏中毒的分析检测、临床药物研发、临床诊疗与法医学鉴定提供实验资料和科学依据。
1 材料与方法
1.1 动物、试剂和仪器
SPF 级SD 雄性大鼠,购自昆明医科大学实验动物中心,生产许可证号:SCXK(滇)LA2020361,体重180~220 g,6~8 周龄,在通风、恒温的鼠笼中适应性喂养4 d,自由饮食饮水。动物实验经昆明医科大学动物实验伦理审查委员会批准,编号:kmmu20221744。
α-鹅膏蕈碱标准品(含量≥90%,批号:03232123),德国DE 公司;色谱纯甲醇、乙腈和乙酸铵,均为美国Sigma公司;其余试剂均为市售分析纯。
Agilent 1290高效液相色谱仪、Agilent 6470三重四级杆串联质谱仪和ZORBAX RRHD Eclipse-Plus C18 色谱柱,美国Agilent 公司;高速离心机(Beckman Coulter AllegraTM),中国贝克曼库尔特商贸有限公司;电子天平,美国METTLER TOLEDO公司;Oasis HLB固相萃取柱,中国云南百生科技有限公司;有机微孔滤膜(0.22 μm),中国云南树森生物科技有限公司。
1.2 α-鹅膏蕈碱标准溶液配制
准确称取α-鹅膏蕈碱标准品1 mg,加入10%甲醇水溶液1 mL,充分混匀后得到α-鹅膏蕈碱标准储备液(1 g·L-1),4 ℃保存。取适量α-鹅膏蕈碱标准储备液,经10%甲醇水溶液梯度稀释得到1,10 和100 mg·L-1系列标准应用液,用于配制定性定量检测使用的标准系列溶液和质控溶液。
1.3 样品的LC-MS/MS分析条件
液相条件:ZORBAX RRHD EclipsePlus C18色谱柱(2.1 mm×50 mm,1.8 μm);柱温:30 ℃;流动相A:2 mmol·L-1乙酸铵水溶液,流动相B:乙腈;梯度洗脱程序:0~1.5 min,10% B;1.5~3 min,30% B;3~6 min,10% B。进样量:2 μL;流速:0.2 mL·min-1;质谱条件:采用电喷雾离子化正离子模式,多反应监测模式;干燥气温度300 ℃,干燥气流速5 L·min-1;鞘气温度250 ℃,鞘气流速11 L·min-1;毛细管电压3500 V,喷嘴电压500 V;喷雾器压力为45 psi。根据以上条件优化质谱参数,得到α-鹅膏蕈碱的质谱检测参数(表1)。
1.4 样品处理
1.4.1 血液样品
全血200 μL于1.5 mL离心管,加入1 mL甲醇,震荡1 min,超声提取15 min,5000×g离心10 min,取上清液过Oasia HLB 固相萃取柱,分别加入2%甲酸甲醇溶液1 mL、甲醇0.5 mL、2%氨水甲醇溶液1 mL洗脱。收集洗脱液于45 ℃氮气吹干,残渣用10%甲醇水溶液200 μL定容。振荡3 min,充分混匀后经有机微孔滤膜(0.22 μm)过滤,滤液置-20 ℃保存,备测。
1.4.2 组织样品
准确称取大鼠心、肝、脾、肺、肾、全脑、小肠、胃壁和睾丸组织各0.5 g,加入1 mL蒸馏水充分匀浆,再加入1 mL 甲醇,震荡1 min,超声提取15 min,5000×g离心10 min,取上清液,按1.4.1 过Oasia HLB 固相萃取柱,洗脱,吹干,定容和过滤,滤液置-20 ℃保存,备测。利用Excel 软件制作组织分布图。
1.5 分析方法学验证
专属性:检测空白基质(尾静脉血、肾、肝和小肠等)、空白基质添加α-鹅膏蕈碱(500 μg·L-1)及α-鹅膏蕈碱1.5 mg·kg-1单剂量ip 给予大鼠30 min后上述组织和血液样品中α-鹅膏蕈碱浓度,验证方法的专属性。
令Bk表示第k个发送线圈在节点S处产生的磁通密度,θk表示S与xyz轴的极角。当距离d远大于4倍的线圈半径时,S处的磁通密度为
线性及灵敏度:取α-鹅膏蕈碱1,10和100 mg·L-1标准应用液,分别添加于空白血样和空白组织基质(1.4)中,配制浓度为1,2,5,10,20,100,200,500和1000 μg·L-1的校准系列样品(每个浓度配制2 个平行样),在1.3 分析条件下检测,以定量离子对的峰面积(A)平均值为纵坐标,浓度(c,μg·L-1)为横坐标进行线性回归,得到各组织和血液基质中α-鹅膏蕈碱的线性方程。取线性最低点逐级稀释后测定,以信噪比(S/N)>3 作为检出限(limit of detection,LOD),以S/N>10 作为最低定量限(limit of quantitation,LOQ),考察方法的灵敏度。
基质效应:在1.4制备的9种空白组织样和空白血样基质中各添加适量α-鹅膏蕈碱标准应用液,分别配制成15,450 和750 μg·L-1空白组织和空白血添加样品(每个浓度配制5 份),同时配制α-鹅膏蕈碱15,450 和750 μg·L-1标准工作液。分别测得空白组织添加样和空白血添加样中目标物定量离子对峰面积B,标准工作液中对应浓度目标物的峰面积A,基质效应(%)=(B/A-1)×100%。
回收率、精密度和准确度:取200 μL 空白血液,添加适量的α-鹅膏蕈碱标准应用液,配制成15,50和750 μg·L-1的空白血添加样品(每个浓度配制5 份),按1.4.1 进行萃取,得到空白血液添加样(基质前)。经LC-MS/MS 分析后,分别计算对应浓度的空白血添加样(基质前)中α-鹅膏蕈碱的定量离子峰面积和空白血添加样的定量离子峰面积的比值,得到空白血液中α-鹅膏蕈碱的回收率。连续3 d 测定前述样品,每日早、中、晚各测定1 次,采用相对标准偏差(relative standard deviation,RSD)来评估日内和日间精密度。将LC-MS/MS 法检测得到的15,450 和750 μg·L-1的空白血添加样(基质前)的定量离子峰面积,经校准曲线计算得到实际浓度值,以实际浓度平均值与真实浓度的百分比表示准确度。
稳定性:取200 μL 空白血液,加入不同浓度的α-鹅膏蕈碱标准应用液,配制得到15,450 和750 μg·L-1浓度的空白血液添加样,分别放置24 h(室温)、7 d(-20℃)、3 次冻融循环(-20 ℃~室温)后,按1.4.1 处理,在1.3 分析条件下检测,每个浓度平行配制5份,计算偏倚值(以测定平均值和参考值的差值与参考值的百分比表示),考察方法的稳定性。
1.6 毒代动力学测定
8 只雄性SD 大鼠,单次ip 给予α-鹅膏蕈碱1.5 mg·kg-1,在给药前和给药后5,10,20,30 和45 min及1,1.5,2.5,4和8 h采集尾静脉血于EDTA抗凝试管中,混匀,置于-20 ℃保存。
按1.4.1 处理血液样品,1.3 分析血药浓度。采用DAS 2.0 药动学软件对测得的血药浓度进行处理,以非房室模型法计算统计矩参数,绘制浓度-时间曲线,拟合毒代动力学参数:全血峰浓度(Cmax),消除半衰期(T1/2),达峰时间(Tmax),体内总清除率(CLz),曲线下面积(AUC0-t),平均滞留时间(MRT0-t),表观分布容积(Vz)。
1.7 组织分布测定
24只雄性SD大鼠,随机分为4组(15和40 min组及2.5 h 组和空白对照组),前3 组大鼠ip 给予α-鹅膏蕈碱1.5 mg·kg-1,空白组ip 给予同体积蒸馏水,分别于给药后15 和40 min 及2.5 h 将大鼠安乐死,采集心、肝、脾、肺、肾、全脑、小肠、胃壁和睾丸9 种组织和左心室动脉血。蒸馏水冲洗脏器,去除杂质及血液,滤纸吸干水分,置于-20 ℃保存。按1.4 处理,按1.3 分析组织药物浓度,左心室动脉血药物浓度参考血药浓度分析方法测定。
1.8 统计学分析
2 结果
2.1 样品分析方法学验证
专属性:在1.3 分析条件下,检测空白基质(尾静脉血、肾、肝和小肠等)、空白基质添加α-鹅膏蕈碱及α-鹅膏蕈碱1.5 mg·kg-1单剂量ip给药大鼠30 min后上述组织及血样的色谱图见图1,表明空白基质对α-鹅膏蕈碱的检测无干扰,方法专属性良好。
线性及灵敏度:不同基质中α-鹅膏蕈碱质量浓度在10~1000 μg·L-1范围内线性关系良好,R2>0.9914。α-鹅膏蕈碱在大鼠尾静脉血、左心室动脉血及各组织脏器中的检出限和定量限较低(表2),方法灵敏度高。
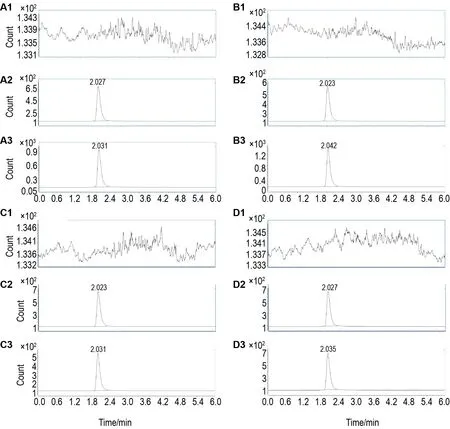
Fig.1 Representative multiple reaction monitoring ion mass specrometry of tail vein blood(A),kidney(B),liver(C)and small intestine(D)samples of rats.1:blank matrix;2:blank matrix spiked with alpha-amanitin at a concentration of 500 μg·L-1;3:samples of rats 30 min after single-dose intraperitoneal injection of alpha-amanitin(1.5 mg·kg-1).
基质效应:α-鹅膏蕈碱在9 种组织及血液基质中的基质效应为-13.93%~8.62%,RSD<13%,说明9种组织及血液基质对α-鹅膏蕈碱的定性定量测定结果的影响均较小。
精密度、准确度与回收率:血液基质中α-鹅膏蕈碱的回收率为90.26%~102.59%,日内和日间精密度均在8.0% 以内,准确度为85.21%~110.83%,表明方法的提取回收率高,精密度好、准确度高,能满足生物样品中α-鹅膏蕈碱的检测要求。
稳定性:α-鹅膏蕈碱在血液中的偏倚值为-13.82%~7.37%,在规范要求的15%以内,说明在前述3种环境下,α-鹅膏蕈碱稳定性良好。
2.2 单剂量ip 给予α-鹅膏蕈碱在大鼠体内的毒代动力学参数
采用DAS 2.0 软件计算α-鹅膏蕈碱的主要毒代动力学参数并绘制浓度-时间曲线(图2 和表3)。α-鹅膏蕈碱在大鼠体内吸收消除均较快,给药5 min 后血液中即可检测出α-鹅膏蕈碱,在(0.52±0.16)h 达峰,约4 h 后无法检出。α-鹅膏蕈碱的T1/2为(0.72±0.37)h,CLz为(1.62±0.26)L·h·kg-1,AUC0-t为(946±183)μg·h·L-1,MRT0-t为(1.18±0.17)h,Vz为(1.65±0.86)L·kg-1。
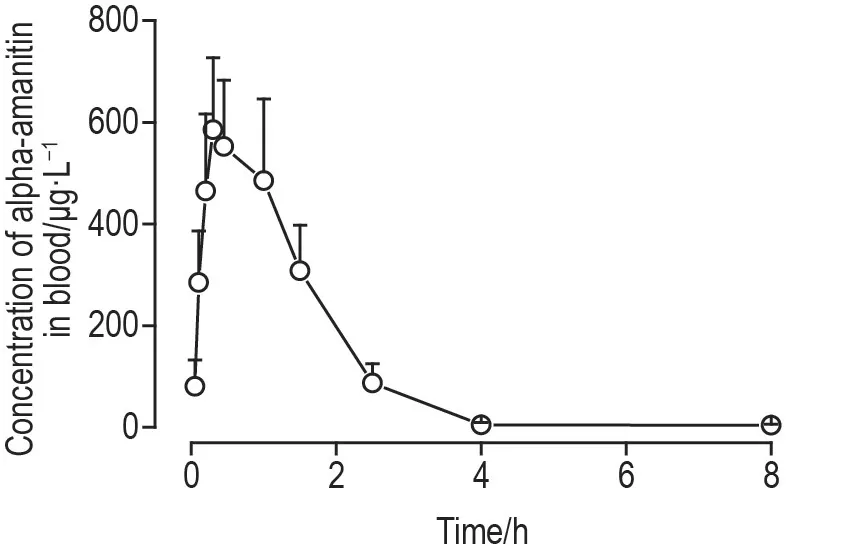
Fig.2 Blood concentration-time curve of alpha-amanitin in male SD rats after single intraperitoneal injection.Before and after SD rats were intraperitoneally injected with alpha-amanitin 1.5 mg·kg-1,the tail venous blood was collected and detected by liquid chromatography-tandem mass spectrometry(LC-MS/MS).±s,n=8.
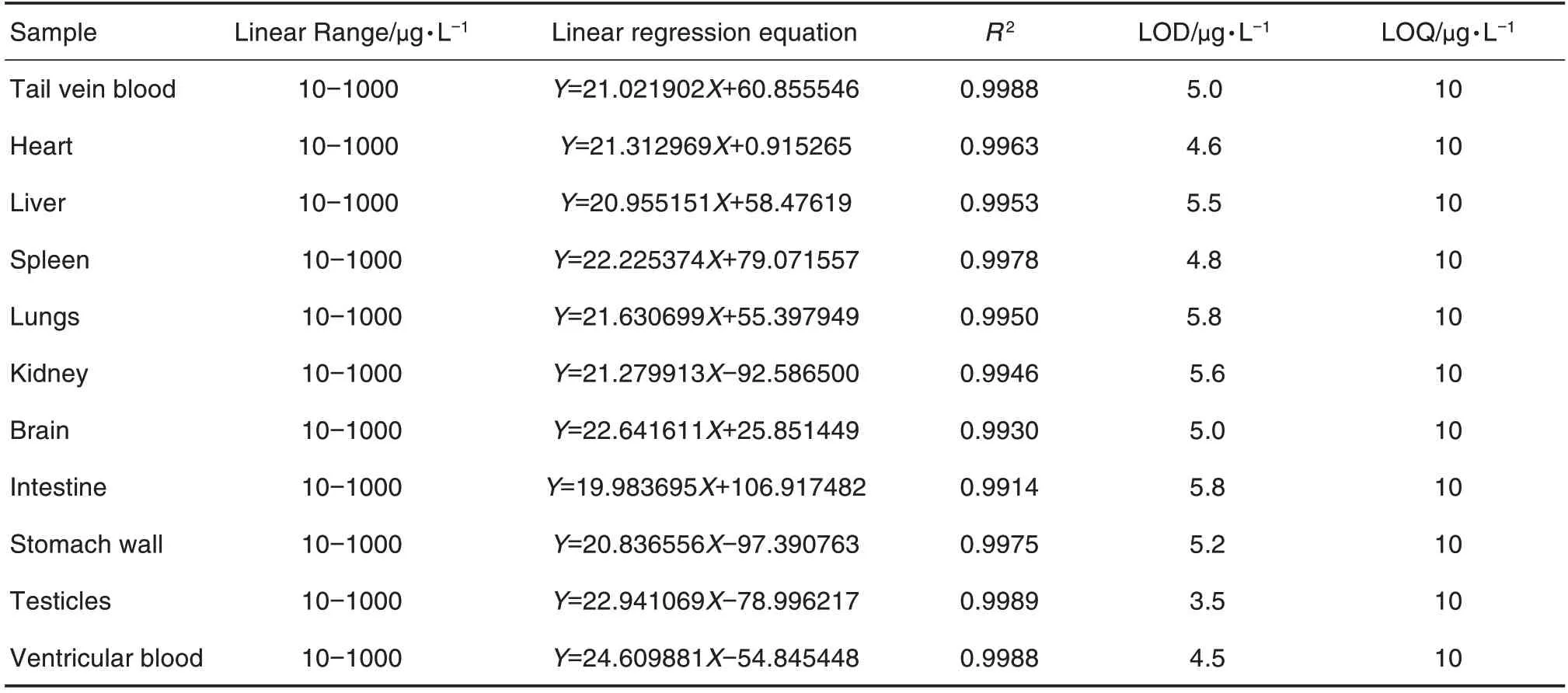
Tab.2 Linear range of alpha-amanitin in tissues of rats
2.3 单剂量ip给予α-鹅膏蕈碱在大鼠体内组织分布
SD 大鼠ip给予α-鹅膏蕈碱后,不同时间点各组织和左心室动脉血中分布见图3。结果显示,α-鹅膏蕈碱在各组织脏器中吸收消除快,在给药15 min 即可检出,均约在40 min 达峰,2.5 h 浓度降至最低。α-鹅膏蕈碱在肾中的浓度最高,在心、脾、睾丸等组织含量较低,在脑中含量极低。在给药后15 min,α-鹅膏蕈碱在各组织和左心室动脉血中的浓度顺序为肾>肺>小肠>胃壁>肝>心>脾>睾丸>左心室动脉血>脑;给药后40 min,肾>肺>小肠>胃壁>脾>左心室动脉血>肝>心>睾丸>脑;给药后2.5 h,肾>左心室动脉血>肝>睾丸>胃壁>肺>脾>脑>小肠>心。
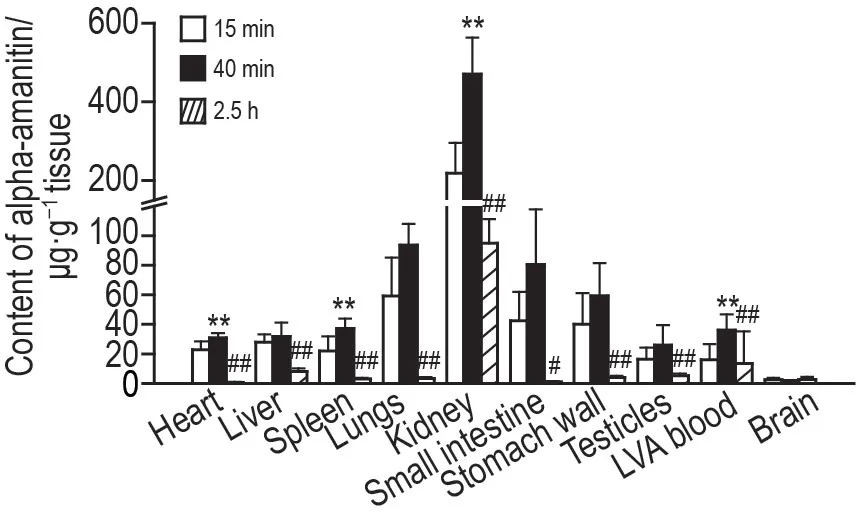
Fig.3 Tissue distribution of alpha-amanitin in SD rats after intraperitoneal injection.SD rats were intraperitoneally injected with alpha-amanitin 1.5 mg·kg-1.The different tissue samples and left ventricular arterial(LVA)blood were respectively collected after intraperitoneal injection of 15 min,40 min and 2.5 h.The concentration of alpha-amanitin was detected by LC-MS/MS.±s,n=6.*P<0.05,**P<0.01,compared with 15 min group;#P<0.05,##P<0.01,compared with 40 min group.

Tab.3 Toxicokinetic parameters of alpha-amanitin in rats after single intraperitoneal injection
3 讨论
α-鹅膏蕈碱等蘑菇毒素相对分子质量大,水溶性强,LC-MS/MS 法是目前检测鹅膏毒素较适宜的方法。以往研究建立的检测方法主要是针对血浆中α-鹅膏蕈碱的检测[18],然而在实际毒蘑菇中毒死亡相关案例鉴定中,血液检材/样本大多为溶血或腐败的全血,基质干扰较大。故本研究对大鼠全血样品的前处理方法进行了优化,首先采用甲醇沉淀蛋白后经Oasia HLB 固相柱萃取,并结合α-鹅膏蕈碱的溶解性采用不同极性的洗脱剂洗脱,提高了萃取效率,降低了基质效应。建立的9 种大鼠组织和血液基质中α-鹅膏蕈碱的液相色谱串联质谱法萃取效率高、基质效应小、精密度好、灵敏度和准确度高,确保α-鹅膏蕈碱的体内代谢规律研究结果的科学可靠。
本研究毒代动力学结果显示,ip 给予α-鹅膏蕈碱后,α-鹅膏蕈碱在SD 大鼠体内吸收消除较快,给药后约31 min达全血浓度峰值,4 h后未检出,该结果与文献报道[18-20]基本相符。依据毒代动力学结果,研究了α-鹅膏蕈碱在吸收相(15 min)、分布相(40 min)、代谢相(2.5 h)3 个时间点的组织分布特点。结果表明,3 个时间点α-鹅膏蕈碱在肾分布浓度均明显高于其他组织,其次分布于血流丰富的组织及代谢器官,如肺、小肠、胃壁和肝等,在心、脾和睾丸等组织及左心室动脉血中分布较少,在脑中的分布极少;各组织和左心室动脉血α-鹅膏蕈碱浓度均在40 min 达最高,2.5 h 浓度明显下降,提示α-鹅膏蕈碱的组织分布广泛,肾可能为α-鹅膏蕈碱毒性作用的靶器官,α-鹅膏蕈碱不易透过血脑屏障。Garcia 等[21]建立了串联二极管阵列和电化学高效液相色谱方法,分别测定了单次ip给予α-鹅膏蕈碱(10和21.4 mg·kg-1)2 和4 h 后Wistar 大鼠血浆、肝和肾组织中的α-鹅膏蕈碱浓度,发现在2 和4 h 肾中药物浓度均明显高于肝,且2 h 肝中未检出,4 h 检出微量α-鹅膏蕈碱;2 和4 h 的血浆中均未检出,该结果与本研究结果基本符合。虽然染毒方式相同,但本研究建立的样品前处理方法和检测方法的回收率和灵敏度更高,检出限低,且采样时间点多,采集样本类型丰富,更系统完整地研究了α-鹅膏蕈碱在大鼠体内多组织脏器中的代谢分布规律。
本研究建立的固相萃取-LC-MS/MS 检测方法,具有回收率高、基质效应小,灵敏度和准确度高等特点,为α-鹅膏蕈碱的毒代动力学及组织分布研究提供了技术手段,此方法也可推广应用于毒蘑菇中毒案件的法医学鉴定。同时,本研究结果提示,涉及蘑菇毒素中毒的案件,应尽早采集血液检材,重点采集肾、肝、肺和胃肠等脏器检材进行检测分析,明确中毒目标物,为临床诊疗、案件侦破提供方向。
- 中国药理学与毒理学杂志的其它文章
- Element profiles of benzo[a]pyrene malignantly transformed 16HBE cells and joint effects of copper with cisplatin or vinorelbine on cell proliferation
- 基于细胞代谢组学的柴胡皂苷b2对皮质酮诱导PC12细胞损伤的保护作用研究
- miR-152-3p表达下调降低紫杉醇耐药人卵巢癌细胞A2780T对紫杉醇的耐药性
- 铅对大鼠皮质神经元γ-氨基丁酸A型受体介导电流及GABA能突触传递的抑制作用
- 环状RNA在大脑功能调控及药物成瘾中的作用研究进展
- PD-1/PD-L1单抗药物抗肿瘤免疫治疗相关不良反应及超进展疾病研究进展

