N-乙酰半胱氨酸联合缺血后处理减轻糖尿病小鼠心肌缺血再灌注后肺损伤的作用研究
李爱梅, 吴建江, 姜巧巧, 戴晓雯
(新疆医科大学第一附属医院麻醉科, 乌鲁木齐 830054)
心脏手术不仅可引起心肌缺血/再灌注(Ischemia/reperfusion,I/R)损伤,还可促进远端器官的损伤,包括肺、脑、肾等[1-2]。糖尿病患者在发生心脏疾病时易引发严重的呼吸系统疾病,糖尿病患者心肌I/R引起的急性肺损伤(Acute lung injury,ALI)要重于非糖尿病患者[3-4]。
缺氧诱导因子-1α (Hypoxia-inducible factors-1α,HIF-1α)是一种氧依赖性转化激活剂,已被证实在ALI中发挥重要作用,可作为ALI潜在的治疗靶点。HIF-1α-血管内皮生长因子(Vascular endothelial growth factor,VEGF)通路已被证实可通过调节血管重构以及血管舒缩反应参与血管生成、红细胞生成、能量代谢、细胞增殖和存活,并且能够使缺氧组织和细胞维持氧稳态以耐受缺血缺氧[5-6]。
缺血后处理(Ischemic postconditioning,IPostC)已被证实对心脏、大脑、肝脏、肾脏和脊髓的I/R损伤有保护作用,其机制与内源性保护机制中多个相互作用的成分有关,但在糖尿病状态下,其保护作用缺失[7]。N-乙酰半胱氨酸(N-acetylcysteine,NAC)是一种临床常用的巯基递质,是一种强抗氧化剂,可通过其硫醇基团直接清除活性氧(Reactive oxygen species,ROS),增加细胞内谷胱甘肽水平[8]。Guo等[9]研究表明,NAC可显著减轻器官缺血再灌注损伤,并且可对远端器官发挥至关重要的保护效应。本研究旨在探讨NAC联合IPostC对糖尿病小鼠心肌缺血再灌注后肺损伤的作用及机制,以期为临床上制定科学的围术期肺保护策略提供理论依据。
1 材料与方法
1.1 动物选择及分组选取30只15周龄雄性dbdb糖尿病小鼠,体重50~60 g,测得每只小鼠随机血糖均≥16.7 mmol /L,并伴有糖尿病症状(多饮、多食、多尿)。实验动物生产许可证号:SCXK(京)2016-0010,购于北京维通利华实验动物技术有限公司。所有动物均在新疆医科大学SPF级动物实验室饲养,室温20~25℃,湿度55%,给予糖尿病鼠高糖高脂饮食。本实验经新疆医科大学第一附属医院动物伦理委员会批准(IACUC-20220620-02)。将30只糖尿病鼠随机分为3组, 假手术组(D-SO组,n=10)、心肌缺血/再灌注组(D-I/R组,n=10)和NAC联合缺血后处理组(D-NAC+IPostC组,n=10)。
1.2 心肌缺血再灌注模型的制备所有dbdb糖尿病小鼠在实验前均禁食, 麻醉采用氯胺酮(100 mg/kg)腹腔注射,麻醉后进行气管插管人工呼吸,呼吸量为1.5 mL/100 g,呼吸频率为60次/min。糖尿病小鼠取仰卧位,胸部剃毛,在胸骨左侧约2 mm处,行左侧开胸术,切开第四和第五肋骨。肝素钠(500 IU/kg)通过尾静脉注射给药。采用冠状动脉前降支闭塞60 min后再灌注15 min的方法建立心肌缺血再灌注(I/R)损伤模型。D-SO组仅在麻醉下开胸,采用相同的手术方法,不结扎冠状动脉前降支。D-I/R组模型建立以缺血区变色、心电图肢体导联II-ST段升高证实造模成功。IPostC诱导方法为再灌注15 min前,进行3个周期再灌注(10 s)和再闭塞(10 s)。NAC给药方法为夹闭冠状动脉左前降支前30 min,按照150 mg/kg剂量腹腔注射。D-NAC+IPostC组I/R前给予NAC(sigma,1009005),后进行心肌缺血60 min,于再灌注前进行3个循环IPostC,后再灌注15 min。在再灌注结束时,进行血液和组织样本的采集,并进一步分析。
1.3 肺部组织病理学观察取右肺中叶最上段的肺样本,浸泡在4%甲醛中,石蜡包埋,切片,苏木精伊红染色。采用盲法对肺组织切片进行检查和评分。
根据光学镜下观察到的肺损伤的异常情况,即肺泡充血、出血、炎症细胞浸润、细胞坏死及水肿情况,对肺损伤程度进行评分。在肺组织学切片,损伤严重程度采用5分制分级:显微镜下异常视野若小于1/4、1/4~1/2、1/2~3/4或≥3/4部分,则评分分别为0、1、2、3和4。每张切片均检查5个或5个以上的区域,以尽量减少区域间差异[4]。
1.4 肺湿干重比(W/D)用干湿肺重(W/D)比作为肺水肿指标。切除左下肺并立即称量(湿重),然后将肺组织在60℃的烤箱中干燥48 h,并称重(干重),计算两者的比值。
1.5 血清炎性因子的测定再灌注2 h后,采集颈动脉血液样本,然后离心分离血清,检测C反应蛋白(CRP)、肿瘤坏死因子-α(TNF-α)、单核细胞趋化蛋白-1的水平。
1.6 肺通透性指数的测定取支气管肺泡灌洗液,离心,取上清置于冰箱。血清和肺泡灌洗液中蛋白浓度是采用二辛可宁酸法(Bicinchoninic acid,BCA)法进行检测,肺通透性指数为两者的比值。
1.7 血清中氧化应激相关因子的测定再灌注2 h后,采集颈动脉血液样本,然后离心分离血清,采用ELISA试剂盒(南京建成)检测丙二醛(Malondialdehyde,MDA)、超氧化物歧化酶(Superoxide dismutase,SOD)、谷胱甘肽(Glutathione,GSH)的水平。
1.8 肺组织HIF-1α、VEGF蛋白表达的测定取肺组织,用电动匀浆机在裂解缓冲液中匀浆,然后在4℃下,12 000 r/min,离心15min。用BCA蛋白测定试剂盒测定后,上清作为蛋白样品。取等量的样品,使用10% SDS-聚丙烯酰胺凝胶分离,然后将蛋白质转移到聚偏二氟乙烯(PVDF)膜上,5%脱脂奶粉封闭1 h,漂洗。分别加入一抗HIF-1α(Abcam,ab179483)、血管内皮生长因子(Vascular endothelial growth factor,VEGF)(Abcam,ab214424),将PDVF膜与之在4℃下孵育过夜,漂洗后加入山羊抗兔IgG H&L(Abcam,ab205718),显色后采用软件分析蛋白吸光度值。
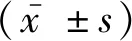
2 结果
2.1 小鼠肺组织光学镜下病理改变情况本研究结果显示,心肌I/R可引起糖尿病小鼠肺脏的病理学形态学改变。D-SO组为正常肺组织结构,未见损伤性改变。D-I/R组镜下可见肺水肿、出血及弥漫性白细胞浸润,肺损伤评分升高。D-NAC+IPostC组镜下肺组织损伤明显减轻,可见散在的白细胞及少量红细胞浸润。与D-I/R组比较,D-NAC+IPostC组小鼠肺损伤评分降低(图1、表1)。
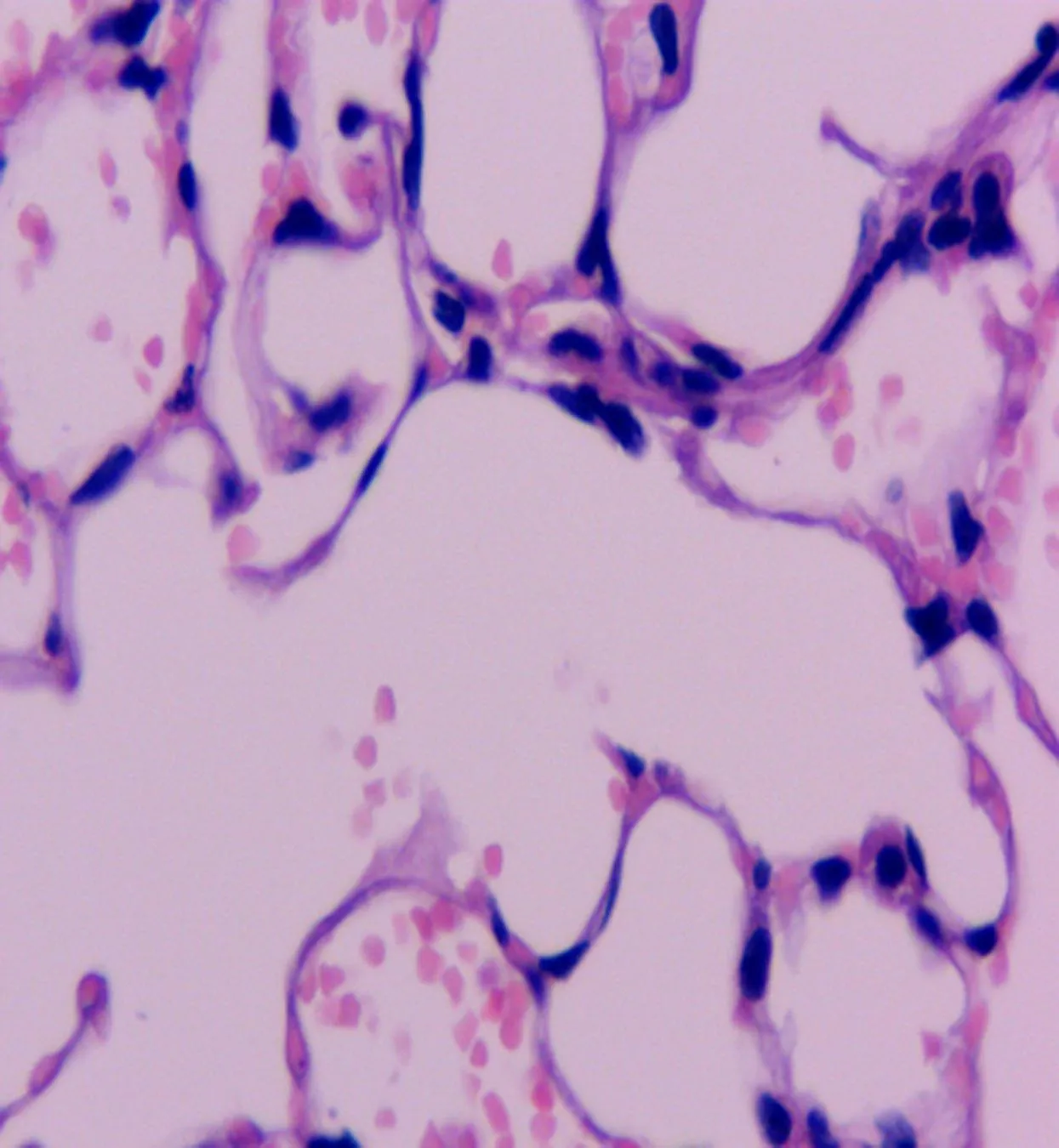
D-SO组
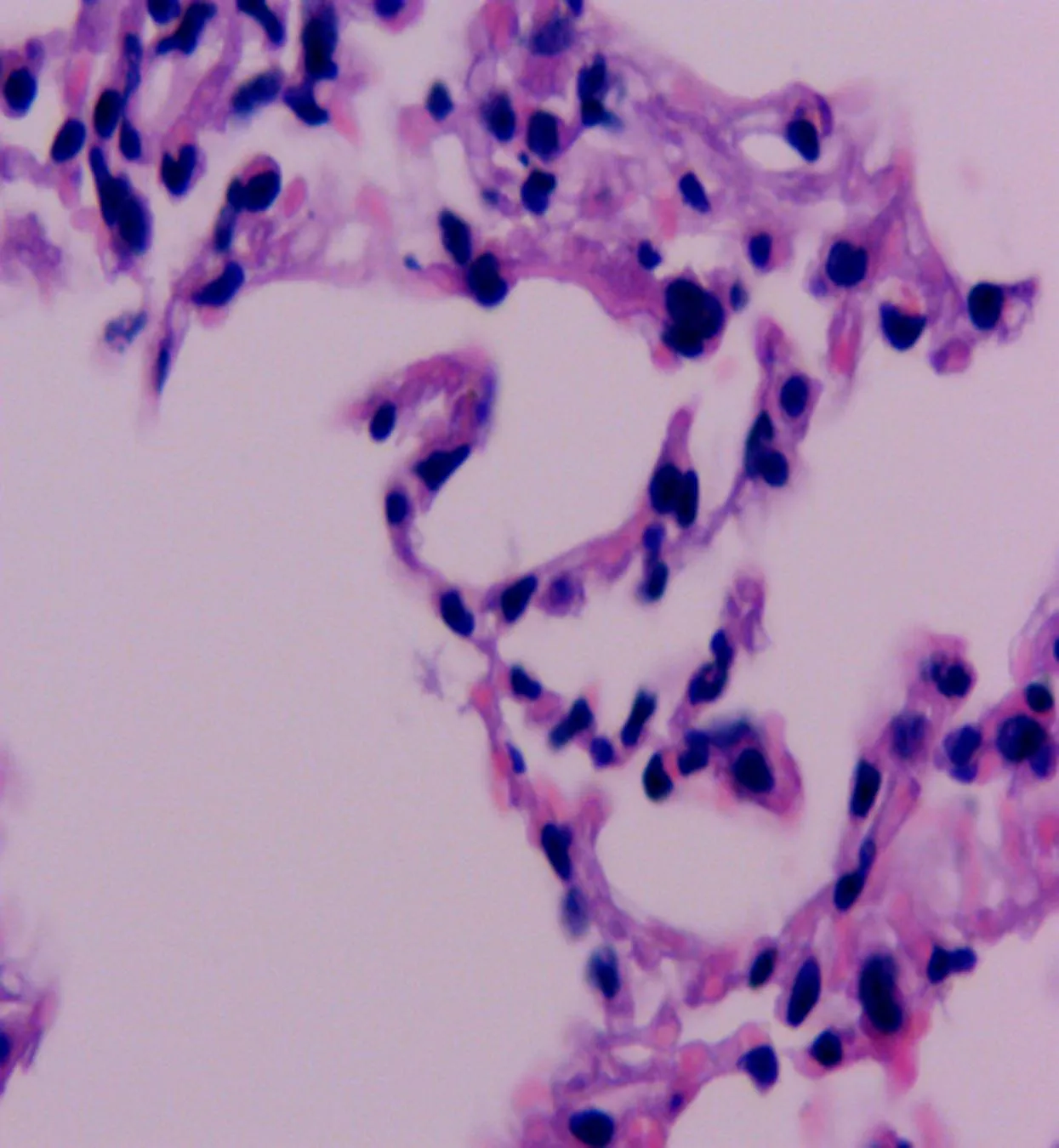
D-NAC+IPostC组
2.2 3组小鼠肺组织湿干重(W/D)比值比较D-NAC+IPostC组和D-I/R组小鼠的W/D明显高于D-SO组(P<0.05),而D-NAC+IPostC组小鼠的湿/干重比明显低于D-I/R组(P<0.05)(表1)。
2.3 3组小鼠肺通透性指数比较心肌I/R后糖尿病小鼠肺通透性发生了显著变化。与D-SO组比较,D-NAC+IPostC组和D-I/R组小鼠肺通透指数明显升高(P<0.05),而D-NAC+IPostC组小鼠的肺通透指数明显低于D-I/R组(P<0.05)(表1)。
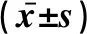
表1 3组小鼠肺损伤评分、肺湿干重比及肺通透性指数比较
2.4 3组小鼠血清炎症因子水平比较与D-SO组比较,D-I/R组小鼠的CRP和TNF-α水平降低(P<0.05),MCP-1水平升高(P<0.05)。与D-I/R组比较,D-NAC+IPostC组小鼠的CRP水平明显升高(P<0.05),TNF-α及MCP-1水平明显降低(P<0.05)(表2)。
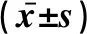
表2 3组小鼠炎症因子表达水平的比较
2.5 3组小鼠氧化应激指标的比较心肌I/R后,糖尿病小鼠肺组织氧化应激增加。与D-SO组比较,D-I/R组及D-NAC+IPostC组MDA含量增加,SOD和GSH含量降低,与D-I/R组相比,D-NAC+IPostC组MDA含量降低,SOD和GSH含量升高(P<0.05)(表3)。
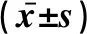
表3 3组小鼠氧化损伤程度的比较
2.6 3组小鼠肺组织HIF-1α和VEGF水平的比较与D-SO组比较,D-I/R组及D-NAC+IPostC组小鼠HIF-1α和VEGF表达水平升高(P<0.05),与D-I/R组相比,D-NAC+IPostC组小鼠HIF-1α和VEGF表达水平增加 (表4、 图2)。
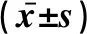
表4 3组小鼠缺氧诱导因子1α和VEGF表达水平的比较
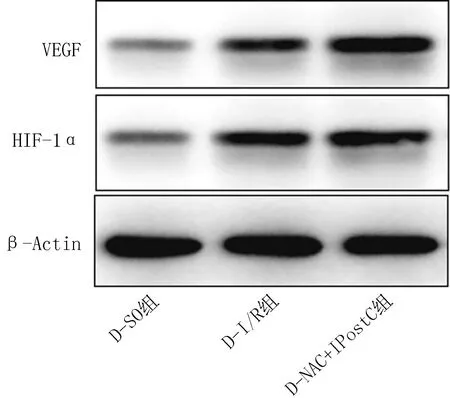
图2 3组HIF-1α和VEGF表达水平的比较图
3 讨论
多项研究表明,心肌缺血再灌注后远端器官中,肺是易受损伤的器官之一,并且糖尿病患者肺损伤更加严重[10-11]。糖尿病可加重肺功能障碍,其机制可能涉及氧化应激、炎症反应、NF-κB通路以及线粒体功能障碍等。本研究结果显示,糖尿病小鼠心肌I/R可引起急性肺损伤,表现为肺组织病理损伤加重,肺组织氧化应激增加,肺水肿加重,肺通透性指数增加。这与Kong等[2]的研究结果一致。
NAC是一种自由基清除剂和谷胱甘肽前体,可作为粘液增溶剂用于治疗各种呼吸道疾病[12]。最新的研究表明[13-14],N-乙酰半胱氨酸还有其他药理作用,例如清除自由基,减少炎性细胞因子、趋化因子和粘附分子的产生,以及对心肌缺血/再灌注损伤有保护作用。缺血后处理也是减少心肌缺血/再灌注损伤的有效方法,但其在糖尿病状态下心肌保护作用缺失。Guo等[9]研究结果证实,NAC可降低大鼠肠系膜I/R后的炎症和肺损伤。Li等[15]研究结果证实,IPostC可通过抑制内质网应激诱导的肺泡上皮细胞凋亡,有效改善心肌缺血再灌注诱导的肺损伤。本研究结果表明,NAC联合IPostC可有效降低心肌I/R后肺损伤,表现为肺组织病理学损伤减轻,循环中炎症因子下降,肺组织氧化应激程度降低。
HIF-1α是调节氧稳态的关键因子,其激活可通过改变能量代谢、细胞增殖、血管生成和血管重构,在缺氧环境中增强细胞的存活力[15]。HIF-1α的稳定表达使细胞或组织适应心肌I/R损伤期间的缺氧反应,保护心肌细胞免受缺血缺氧的影响,改善患者预后[16-17]。Semenza等[18]研究证实,HIF-1α对预防心肌I/R损伤至关重要,VEGF作用于HIF-1α的下游,在心肌I/R损伤中可发挥有效的心肌保护效应。本研究结果表明,糖尿病小鼠心肌I/R可引起肺组织HIF-1α/VEGF通路蛋白变化,表现为肺组织HIF-1α及VEGF蛋白表达增加,而NAC联合IPostC可通过激活HIF-1α/VEGF通路发挥肺保护作用。
综上所述,本研究结果证实糖尿病小鼠心肌I/R可引起肺损伤,其机制可能与HIF-1α/VEGF通路有关,NAC联合IPostC可通过抑制炎症反应、降低肺组织氧化应激、激活HIF-1α/VEGF通路减轻糖尿病小鼠心肌I/R后肺损伤。提示HIF-1α是一个潜在的分子靶点,可为临床治疗糖尿病并发肺损伤提供新思路。

