急性髓系白血病患者外周血中Tfh和Tfr细胞及相关因子变化特点的初步研究
张冉冉, 沙巴艾提·吐达洪, 张 瑞, 谢仁古丽·阿力木, 龚 珊, 曲建华
(新疆医科大学第一附属医院血液病中心, 新疆维吾尔自治区血液病研究所, 乌鲁木齐 830054)
急性髓系白血病(Acute myeloid leukemia,AML)是一种造血干细胞的恶性克隆性疾病,其特征是骨髓和外周血中未成熟髓系细胞的积累和扩增,从而导致正常造血衰竭。其发病率随AML患者年龄增长有明显增高的趋势,该病有较高的死亡率[1]。大多数患者在使用传统的化疗及异基因造血干细胞移植(all-HSCT)的治疗方案后,有一定的完全缓解率(CR),但其复发率较高,且预后较差[2]。近年来,越来越多的研究发现AML患者免疫治疗的重要性,并取得了一定的治疗效果。有关研究报道,AML患者发病机制与机体异常的细胞免疫有关,免疫紊乱在AML疾病的进展中起到重要作用,特别是T细胞免疫功能[3]。
滤泡辅助性T细胞(Follicular helper T cell,Tfh)是一群特异性表达趋化因子受体5(C-X-C chemokine receptor type,CXCR5)的CD4+T细胞新亚群,其通过表达表面分子程序性死亡受体1(Programmed death-1,PD-1)、关键转录因子B细胞淋巴瘤6(B-cell lymphonma 6,BCL-6)和分泌细胞因子IL-21作用于B淋巴细胞,促进B细胞的增殖活化及形成生发中心(Germinal center,GC),是机体适应性免疫的重要组成部分[4]。滤泡调节性T细胞(Follicular regulatory T cell,Tfr)是另一种新的CD4+T亚群,其具有Treg细胞和Tfh细胞的双重特性,可以表达Treg细胞特征分子如特异转录因子叉头翼状转录因子3(Foxp3)、B淋巴细胞诱导的成熟蛋白1(Blymphocyte induced maturation protein 1,Blimp-1)和分泌细胞因子IL-10,还可以表达Tfh细胞相关因子如PD-1、CXCR5、BCL-6等,主要功能参与负性调控Tfh细胞,抑制生发中心Tfh细胞和B细胞功能,防止过强的体液免疫应答[5-6]。已有研究证实循环滤泡辅助性T细胞(Tfh细胞)和滤泡调节性T细胞(Tfr细胞)数量及功能异常与多种疾病有关,包括自身免疫性疾病、风湿性疾病、肿瘤疾病等,二者处于动态平衡状态,共同维持机体免疫系统的稳定[7]。有关研究报道,AML患者存在 Tfh/Tfr比例失衡,可能是导致发病的主要原因[8]。目前,关于Tfh及Tfr细胞在AML疾病发展中的研究机制尚不清楚,本研究通过检测AML患者外周血Tfh细胞、Tfr细胞、相关转录因子及细胞因子的表达情况,并分析其与AML预后不良的相关性,为AML的免疫治疗提供新思路。
1 资料与方法
1.1 研究对象选择2022年5月至2023年6月新疆医科大学第一附属医院血液科收治的初诊AML(非M3型)患者60例(AML组)作为研究对象,排除严重心、肺、肝脏疾病病史。其中男性41例(66.67%),女性19例(33.33%),中位年龄47.5岁(37.75,57.75)。按照2021版WHO的分子遗传学预后危险度分级标准[9]:NPM1突变但不伴有FLT3-ITD突变,或者伴有低等位基因比FLT3-ITD突变或CEBPA双突变为预后良好;inv(16)(p13;q22)或(t16;16)(p13;q22)伴有C-kit突变或(t8;21)(q22;q22)伴有C-kit突变,NPM1野生型无FLT3-ITD突变或伴有低等位基因比FLT3-ITD突变(不伴有遗传学预后因素)或NPM1突变伴有高等位基因比FLT3-ITD突变为预后中等;TP53突变、RUNX1(AML1)突变、ASXL1突变、NPM1野生型伴高等位基因比FLT3-ITD突变为预后不良;分组为预后良好组16例,预后中等组23例,预后不良组19例,数据缺失组2例。所有AML病例诊断均经骨髓细胞形态学、细胞遗传学和分子生物学检查确诊。另选取同时期于本院体检中心就诊的健康体检者40例作为对照组,其中男性26例(65.00%),女性14例(35.00%),中位年龄58.5岁(45.25,69.25)。两组受试者年龄及性别差异无统计学意义(P>0.05),具有可比性。本研究严格遵循《赫尔辛基宣言》、世界卫生组织与国际医学科学组织理事会共同制定的《涉及人的生物医学研究国际伦理准则》的有关规定,获得新疆医科大学第一附属医院伦理委员会批准(批准文号:K202306-11),所有受试者均知情同意。
1.2 研究方法
1.2.1 标本采集及处理 分别采集AML组和对照组空腹静脉血8 mL,置于二胺四乙酸(Ethylene diamine tetraacetic acid,EDTA)抗凝试管中,颠倒混匀后静置,于2 h内送检。采集好的外周血经室温150 r/min离心5 min,收集上层血浆,立即冻存于-80℃冰箱,下层血细胞使用人淋巴细胞分离液通过密度梯度离心法分离外周血单个核细胞(PBMC),调整细胞浓度至107/mL,加入二甲基亚砜(DMSO)后冻存-80℃冰箱。
1.2.2 试剂及仪器 流式专用溶血素和流式抗体FITC anti-human CD4(货号:566802)和BB700 anti-human CD196(货号:566526)购自美国BD公司,而抗体PE anti-human CXCR5(货号:356904)购自美国Biolegend公司;WB抗体BLIMP-1 Mouse Monoclonal antibody(货号:AG1250)购自碧云天和BCL-6 Rabbit Polyclonal antibody(货号:21187-1-AP)、Vinculin Rabbit Monoclonal antibody(货号:26520-1-AP)购自Proteintech中国公司;Human IL-10(货号:JM-03221H1)及IL-21(货号:JM-04810H1)的ELISA Kit购自上海晶抗有限公司,Human TGF-β1(货号:ADS-1920H2)的ELISA Kit购自江苏艾迪生有限公司。高速离心机和酶标仪购自美国Thermo公司;蛋白成像仪购自美国Azure Biosystems公司;流式细胞分析仪购自美国贝克曼公司等。
1.2.3 流式细胞仪检测外周血滤泡辅助性T细胞(Tfh)和滤泡调节性T细胞(Tfr)的表达水平 将采集好的外周静脉血加入抗凝管内,吸取100 μL全血置于流式管内,分别加入抗体CD4-FITC、CXCR5-PE/Dazzle各1 μL,在避光环境下温育20 min;后加入1 mL溶血剂混匀,在避光环境下静置20 min;随后经150 r/min下离心5 min,倒去上清;加入500 μL的破膜/固定液,涡旋混匀后,4℃避光孵育40 min;再次离心洗涤细胞后,倒去上清,加入FOXP3-PerCP/Cyanine 5.5抗体1 μL, 静置40 min;再加PBS溶液300 μL混匀,上流式细胞仪检测Tfh(CD4+CXCR5+FOXP3-)和Tfr(CD4+CXCR5+FOXP3+)细胞的比例。
1.2.4 Western blot检测外周血中BCL-6和Blimp-1的蛋白表达水平 Ficoll法梯度离心收集PBMC细胞后,将冻存的PBMC细胞统一冰上解冻,加入RIPA裂解液,30 min后通过离心(4℃,10 000 r/min,30 min)收集总蛋白,用BCA试剂盒测定蛋白浓度,等量的蛋白质样品(20 μg每孔)通过10%的SDS-PAGE电泳,并在110 V电压2 h条件下转移到PVDF膜上。加入5%脱脂牛奶(室温,2 h)封闭,1×TBST洗涤2次,再将PVDF膜放置在抗BCL-6和抗Blimp-1的一抗稀释液中4℃冰箱过夜(1∶1 000稀释,4℃,8 h) ,洗涤后加入二抗(1∶5 000稀释,室温,1 h)。ECL可视化处理,以Vinculin为内参,分析BCL-6和Blimp-1相对蛋白表达量。
1.2.5 酶联免疫吸附实验(ELISA)检测细胞因子IL-10、TGF-β1及IL-21的表达水平 血清标本在室温下缓慢解冻,离心,每孔加入50 μL待测标准品或样品,再加入100 μL过氧化物酶工作液(HRP),封板,37℃孵育1 h,弃去液体并甩干,洗板5次,每孔加入100 μL的底物溶液,37℃孵育15 min,50 μL终止溶液终止反应,检测每孔450 nm吸光度,根据测得的标准品浓度以及对应的OD值绘制 IL-10、TGF-β1及IL-21的标准曲线。
2 结果
2.1 AML组与对照组一般资料比较AML组与对照组在性别、年龄方面均衡可比,差异无统计学意义(P>0.05)。与对照组相比,AML组的白细胞计数、血红蛋白、血小板计数差异均具有统计学意义(P<0.05),见表1。
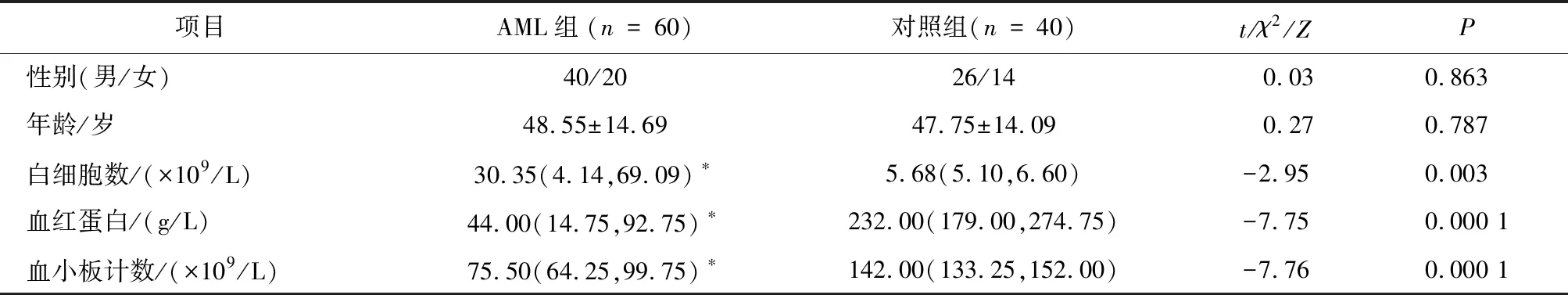
表1 两组一般资料的比较
2.2 AML组与对照组Tfh细胞和Tfr细胞水平比较流式结果显示,与对照组相比,AML组中的Tfr细胞比例明显升高(P<0.05),Tfh细胞比例略升高(P>0.05),Tfh/Tfr比值明显降低(P<0.05),见图1、表2。与预后中等组和预后良好组相比,预后不良组Tfr比例明显增高(P<0.05),Tfh/Tfr比值明显降低(P<0.05);与预后良好组相比,预后中等组Tfr细胞比例水平增高(P<0.05),而Tfh/Tfr比值明显降低(P<0.05),见表3。

图1 AML组与对照组中Tfh、Tfr细胞的流式图
表2 两组外周血中Tfh、Tfr和Tfh/Tfr细胞比例水平比较
表3 不同预后分层AML患者外周血中Tfr、Tfh/Tfr细胞比例水平比较
2.3 AML患者与对照组血清IL-10、TGF-β1及IL-21的水平比较ELISA结果显示,与对照组相比,AML组血清中IL-10、TGF-β1水平明显增高(P<0.05),而血清IL-21水平略增高,差异无统计学意义(P>0.05),见表4。与预后中等组和预后良好组相比,预后不良组血清IL-10、TGF-β1水平明显增高(P均<0.05);与预后良好组相比,预后中等组血清TGF-β1、IL-10水平升高,差异均有统计学意义(P<0.05),见表5。
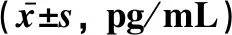
表4 两组血清中IL-10、TGF-β1和IL-21表达水平比较
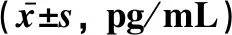
表5 不同预后分层AML患者血清中IL-10、TGF-β1表达水平比较
2.4 AML患者与对照组外周血BCL-6和Blimp-1蛋白相对表达水平的比较与对照组相比, AML患者外周血Blimp-1蛋白相对表达水平降低,差异有统计学意义(P<0.05),而BCL-6蛋白相对表达水平略升高,差异无统计学意义(P>0.05),见图2、表6。
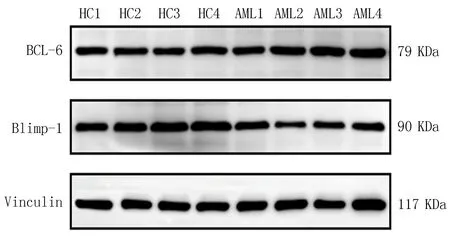
图2 AML组和对照组BCL-6和Blimp-1蛋白的相对表达水平
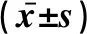
表6 两组BCL-6和Blimp-1蛋白表达水平的比较
2.5 AML患者外周血中Tfr和Tfh/Tfr比值与其细胞因子IL-10、TGF-β1之间的相关性Pearson相关性分析结果显示,Tfr细胞与AML患者血清IL-10、TGF-β1水平呈正相关(r=0.706、0.619,P<0.000 1),Tfh/Tfr比值与AML患者血清IL-10、TGF-β1水平呈负相关(r=-0.454,-0.446,P<0.001),见图3。
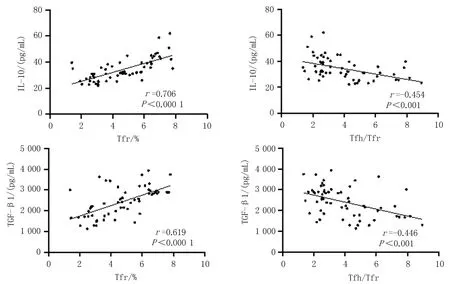
图3 AML患者外周血Tfr细胞和Tfh/Tfr比值与细胞因子IL-10、TGF-β1的相关性分析
3 讨论
急性髓系白血病(AML)是造血组织恶性侵袭的肿瘤,是成人急性白血病最常见的一种类型。AML的发病机制比较复杂,免疫调节因子表达异常和免疫细胞的存活与凋亡参与了AML的发生发展,尤其是T细胞免疫功能[10-11]。在不同抗原刺激及细胞因子环境下,初始的CD4+T细胞可以分化为辅助性T细胞(Th),如Th1、Th2、Th17、Tfh和Tfr等细胞,这些免疫细胞及其细胞因子在AML疾病发生发展中发挥重要作用。
Tfh及Tfr细胞均是由CD4+T淋巴细胞分化而来。Tfh细胞是2000年由Schaerli与Breitfeld等[12-13]人首次提出,其表达核心转录因子BCL-6及分泌细胞因子IL-21,促进Tfh细胞分化,在生发中心(GC)中辅助B细胞增殖分化,增强机体体液免疫效应[14]。相比于健康人,Tfh细胞数量在多种肿瘤疾病中增多,如肠癌、肝癌、乳腺癌及血液系统肿瘤等疾病[15-17],而在AML患者中少见报道。Tfr细胞于2011年在源自外周淋巴器官中胸腺Treg前体的细胞亚群中被首次发现,可同时表达Tfh和Treg细胞的标志物,其在功能上具有Tfh细胞和Treg细胞的双重特征,即Tfr细胞负性调控B细胞增殖化及GC形成,对维持正常的免疫功能至关重要[18]。已有研究表明,卵巢癌局部浸润的Tfr细胞可以通过抑制 CD8+T细胞活性,促进肿瘤生长[19];而在乳腺癌中,Tfr细胞则主要参与抑制Tfh细胞介导的体液免疫形成[20]。
Guo等[8]研究学者报道,与健康对照组相比,初诊AML患者外周血的Tfr细胞比例增高,Tfh/Tfr细胞比例降低,本研究结果与其一致,都表明AML患者中存在Tfh/Tfr的免疫紊乱,可能导致了疾病的发生。Guo等的研究还发现在经过1个周期的诱导化疗后,与未达到CR的患者相比,达到CR的AML患者中Tfr细胞明显降低,而Tfh/Tfr比例明显增高,提示化疗后患者的Tfh/Tfr细胞失衡状态得到扭转,恢复AML患者体内正常免疫应答。本研究同样也发现随着患者预后越差,Tfr细胞比例越高,而Tfh/Tfr比值明显降低。这些均提示Tfr细胞可能与AML疾病的发生有重要关联,并且Tfh/Tfr比值也可能是AML患者疾病进展中的一个重要指标。故推测患者体内出现Tfr细胞数量增加,Tfh/Tfr比例失调,打破了正常的免疫稳态,随着肿瘤负荷增加,致使恶性克隆细胞产生了免疫逃逸。
本研究通过分析相关转录因子蛋白水平与AML疾病发病的关系,发现在AML患者体内存在转录因子BCL-6/Blimp-1的失衡,并且该平衡偏向于Blimp-1蛋白水平减低,可能低水平的Blimp-1参与了AML的发病。
Tfr细胞可以通过IL-10作用于B细胞,调节GC B细胞的成熟,又可以通过高表达TGF-β调控Tfh细胞分化,抑制其辅助B细胞成熟[21-22]。本研究结果显示,AML患者中,Tfr细胞分泌的细胞因子IL-10、TGF-β1水平明显高于对照组,且预后不良组患者血清中IL-10、TGF-β1细胞水平又显著高于预后中等组和预后良好组,表明随着疾病的进展,Tfr细胞通过表达更高水平的免疫抑制因子,表现出更强的免疫抑制作用。
本研究采用Pearson进行相关性分析,结果显示,AML患者血清中IL-10、TGF-β1水平与Tfr细胞比例呈正相关,说明AML患者体内高水平的IL-10、TGF-β1细胞因子可能上调了Tfr细胞的免疫抑制功能,发生免疫逃逸现象,可能是导致疾病发生发展的重要原因之一。Tfh和Tfr细胞分化、发育及调控机制受很多因素影响,其中BCL-6/Blimp-1是一对相互拮抗的转录调节因子,在Tfh、Tfr细胞分化过程中起到关键调节作用。转录因子Blimp-1是BCL-6的拮抗因子,可抑制BCL-6的表达,阻止CD4+T细胞向Tfh细胞分化,抑制Tfr细胞分化[23]。在Blimp-1特异性缺失的小鼠中,发现Tfr细胞数量显著增加[24]。另一项研究表明,T淋巴细胞核因子2(NFAT2)上调Treg细胞表面上CXCR5的表达,进而转化Tfr细胞,Blimp-1可直接通过抑制NFAT2的表达,从而进一步抑制Tfr细胞的分化[25]。本研究发现AML患者体内出现Tfr细胞水平升高,转录因子Blimp-1水平减低,推测可能Blimp-1负性调控Tfr细胞分化,AML患者中Blimp-1的低表达,导致Tfr细胞过度分化,高表达的Tfr细胞可能通过分泌IL-10和TGF-β1促进CD4+T细胞向Tfr分化,导致Tfh/Tfr平衡紊乱,进而参与了AML疾病的进一步发生。本实验为单中心研究,样本量相对较少,今后可扩大样本量以减少其他混杂因素对结果的影响。
综上所述,AML患者Tfr细胞及其细胞因子高表达,存在Tfh/Tfr比值失衡,并与AML不良预后相关,为AML的免疫致病机制研究提供理论基础,未来可能成为AML的治疗和预后预测指标。

