miR-214-5p通过DNMT1介导的AXIN2基因DNA甲基化修饰在皮肤基底细胞癌中的作用机制
熊斯颖, 邵 蕾, 杨 艳, 高爱莉, 揭丽云
(1广州市皮肤病防治所皮肤科, 广州 510095; 2毕节市第二人民医院皮肤科, 贵州 毕节 551700)
皮肤基底细胞癌(Cutaneous basal cell carcinoma,BCC)是一种常见的皮肤恶性肿瘤,约占所有皮肤恶性肿瘤的70%[1-2]。近年来,在我国的发病率呈逐年升高趋势[3]。众所周知,长期暴露于紫外线照射是发生BCC的重要危险因素[4]。但并非所有的BCC患者都曾接受过长期紫外线照射,这表明有其他因素参与BCC的发病机制。研究显示,遗传、环境、免疫等因素在BCC的发生、发展中发挥着至关重要的作用[5-6]。最近,表观遗传学已被证实在多种疾病的发生机制中扮演着重要角色,受到了诸多学者的关注。DNA甲基化是研究最多的一种表观遗传修饰机制,在维持细胞功能、染色质结构改变及遗传印记等多种生物学过程中具有重要意义[7]。研究显示,轴抑制蛋白2(Axis inhibition protein 2,AXIN2)基因启动子区DNA甲基化与多种癌症的发生、发展有关[8-10]。小分子核糖核酸(microRNA,miRNA)在转录和转录后基因调控中发挥重要作用。研究表明,miR-214-5p在癌症中表达异常,且其对下游靶蛋白DNA 甲基转移酶1(DNA methyltransferase,DNMT1)具有负向调控作用,而AXIN2基因启动子区DNA甲基化率受到DNMT1的调控[11]。因此,本研究在BCC患者中开展了关于miR-214-5p是否通过DNMT1介导AXIN2基因启动子区DNA甲基化率改变参与BCC的发病机制中,为疾病的预防和靶向治疗提供新视角。
1 材料与方法
1.1 一般资料收集2022年1月-2023年6月在广州市皮肤病防治所就诊治疗的102例BCC患者作为研究对象,其中男性65例,女性37例,年龄34~83周岁,平均年龄(65.52±5.73)岁,皮损直径(5.03±0.62)cm,组织学分型为结节型44例,非结节型58例,发生转移26例,无转移76例。提取患者癌组织和癌旁正常组织标本,离体后立即用石蜡包埋保存备用。纳入标准:(1)经组织病理学诊断为BCC;(2)年龄≥18周岁;(3)临床病理资料完整;(4)患者自愿参与研究。排除标准:(1)患有其他部位肿瘤;(2)合并严重心、脑、肺、肝、肾功能不全;(3)患有自身免疫性疾病、血液系统疾病或神经系统疾病。本研究所有程序符合赫尔辛基宣言,经医院伦理委员会的批准(审批号:gzsp202241),所有患者均自愿参与研究,并签署了知情同意书。
1.2 试剂与仪器Trizol提取试剂盒(艾德莱生物,批号:RNO401);逆转录试剂盒(美国 Fermentas公司,批号:K1622);实时荧光定量PCR试剂盒(诺唯赞生物,批号:0111-02);实时荧光定量PCR仪(美国伯乐公司,型号:CFX384Touch);SYBR Green试剂盒(日本宝生物,批号:AJ51622A);实时荧光定量PCR所需引物由生工生物工程(上海)股份有限公司合成;QIAGEN试剂盒(德国Hilden公司,批号:133159);EZ DNA MethylationTM-GOLD试剂盒(美国zymo公司,批号:d5005);人皮肤基底细胞癌A-431细胞由上海康朗生物科技有限公司提供;合成miR-214-5p模拟物(mimic)、抑制物(inhibitor)及其阴性对照(mimic NC和inhibitor NC)由上海吉玛制药公司提供。
1.3 方法
1.3.1 焦磷酸测序检测AXIN2基因甲基化率 用QIAGEN试剂盒提取BCC癌组织和癌旁正常组织基因组DNA,紫外线分光光度法检测DNA浓度,-80℃冰箱储存备用。使用EZ DNA MethylationTM-GOLD试剂盒对400 ng基因组DNA进行亚硫酸氢盐转化。过滤DNA亚硫酸氢盐转化率<98%的样品。通过琼脂糖电泳分离目标CpG区的PCR扩增子,用QIAquick凝胶提取试剂盒纯化,依据说明书使用Illumina Hiseq/Miseq 2000检测AXIN2甲基化率。AXIN2甲基化扩增:正向引物序列5′-AGGCTGTCATGGCTGTAGTGCA-3′,反向引物序列5′-ACACCTTCCCTGAGGATGCC-3′。对扩增产物进行焦磷酸法测序,计算甲基化率。
1.3.2 实时荧光定量PCR检测AXIN2基因、DNMT1基因mRNA和miR-214-5p相对表达水平 使用SYBR Green试剂盒测定AXIN2、DNMT1基因mRNA和miR-214-5p的表达水平。β-肌动蛋白和U6作为内参,AXIN2、DNMT1、miR-214-5p和β-肌动蛋白的引物序列见表1。采用RQ=2-ΔΔCT法计算结果并记录。

表1 引物序列设计
1.3.3 基因的靶向关系验证 Targetscan数据库显示,miR-214-5p和DNMT1基因具有靶向调控结合位点。因此,使用双荧光素酶报告基因实验验证两者之间的靶向关系。
1.3.4 miR-214-5p对基底细胞癌A431细胞的处理 用含10%胎牛血清的DMEM培养基,37℃、5% CO2培养A431细胞。分别将miR-214-5p mimic、inhibitor、mimic NC和inhibitor NC转染至对数生长期的A431细胞中,48 h后检测DNMT1基因mRNA表达水平和AXIN2基因甲基化率。
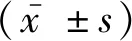
2 结果
2.1 不同临床病理特征BCC患者癌组织AXIN2基因甲基化率的比较不同性别、年龄、皮损直径、组织病理分型的BCC患者癌组织中AXIN2基因甲基化率比较差异无统计学意义(P>0.05),而发生转移患者癌组织中AXIN2基因甲基化率相较于无转移患者显著上升,差异有统计学意义(P<0.05),见表2。
表2 不同临床病理特征BCC患者癌组织AXIN2基因甲基化率的比较
2.2 癌组织和癌旁正常组织AXIN2基因甲基化率和mRNA水平的比较BCC癌组织和癌旁正常组织的AXIN2基因甲基化率分别为(6.24±1.21)%、(4.08±0.73)%,两组间比较差异有统计学意义(t=5.128,P<0.001),见图1A;BCC癌组织和癌旁正常组织的AXIN2基因mRNA相对表达水平分别为(0.87±0.15)、(1.56±0.28),两组间比较差异有统计学意义(t=7.826,P<0.001),见图1B。BCC癌组织的AXIN2基因甲基化率与其mRNA表达水平间呈负相关(r=-0.793,P<0.001)。
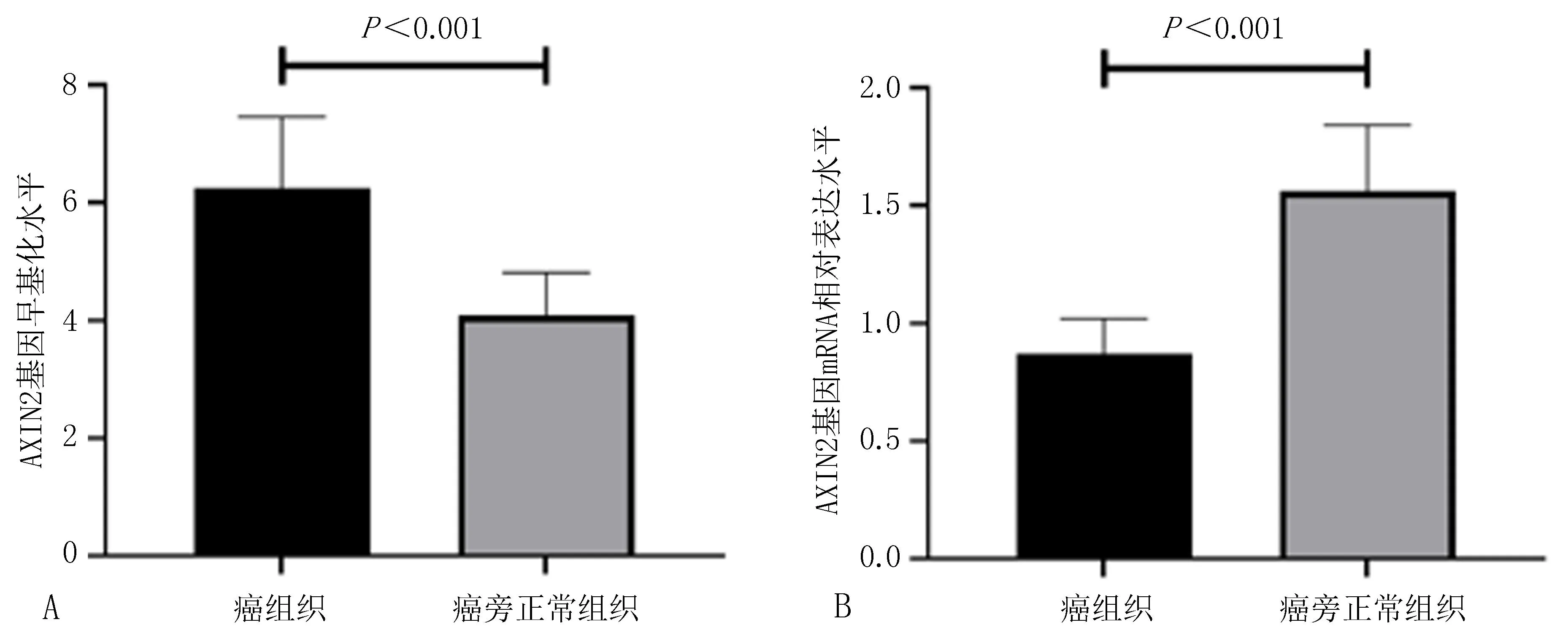
注: A, AXIN2基因甲基化率; B, AXIN2基因mRNA水平。
2.3 癌组织和癌旁正常组织的DNMT1基因mRNA和miR-214-5p表达水平比较BCC癌组织和癌旁正常组织的DNMT1基因mRNA表达水平分别为(2.46±0.57)、(1.71±0.26),两组间比较差异有统计学意义(t=4.838,P<0.001),见图2A。BCC癌组织的DNMT1基因mRNA水平与AXIN2基因甲基化率呈正相关(r=0.814,P<0.001),而与AXIN2基因mRNA表达水平呈负相关(r=-0.795,P<0.001)。BCC癌组织和癌旁正常组织的miR-214-5p表达水平分别为(0.62±0.11)、(1.13±0.16),两组间比较差异有统计学意义(t=5.426,P<0.001),见图2B。癌组织的miR-214-5p表达水平与DNMT1基因mRNA表达水平间呈负相关(r=-0.747,P<0.001)。
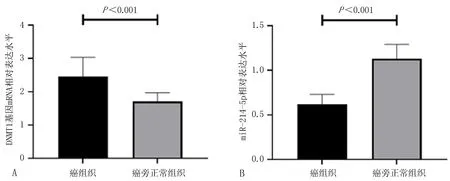
注: A, DNMT1基因mRNA水平; B, miR-214-5p水平。
2.4 miR-214-5p和DNMT1基因的靶向关系验证生物信息学Targetscan数据库显示,miR-214-5p和DNMT1基因具有潜在靶向结合位点,且双荧光素酶报告基因实验结果表明,DNMT1是miR-214-5p的靶基因,见图3。

注: A, miR-214-5p和DNMT1靶向结合位点; B, 与miR-214-5p-mimic组比较,***P<0.001。
2.5 转染后的细胞DNMT1基因mRNA水平的比较与mimic NC (1.02±0.11)、 inhibitor (1.63±0.18)和inhibitor NC(1.01±0.14)比较,miR-214-5p mimic的DNMT1基因mRNA水平(0.62±0.09)显著降低,差异有统计学意义(P<0.001);而inhibitor的DNMT1基因mRNA水平相较于其他三组显著上升,差异有统计学意义(P<0.001),见图4。
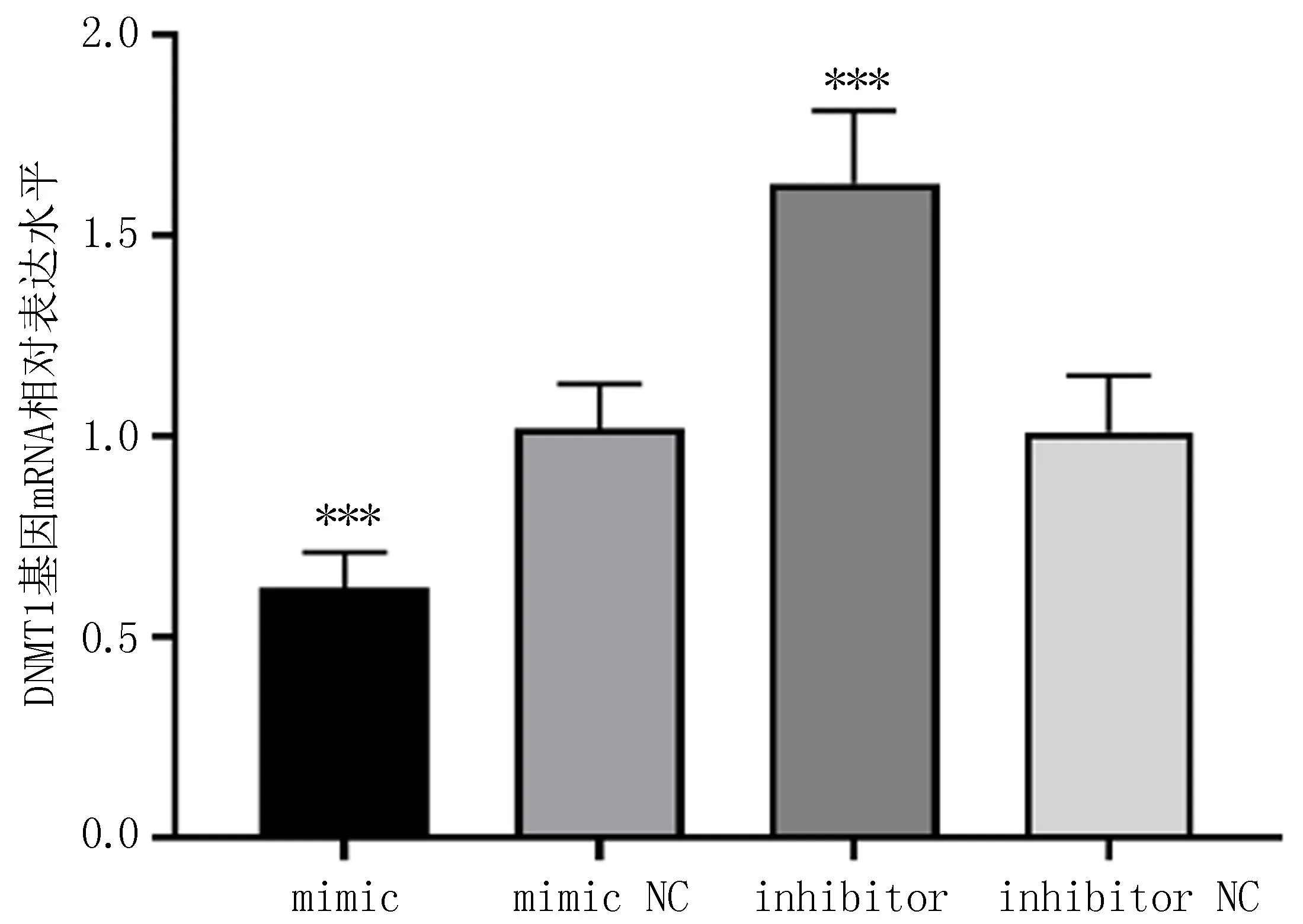
注:与其他三组比较, ***P<0.001。
2.6 转染后的细胞AXIN2基因甲基化率的比较与mimic NC(3.26±0.47)%、inhibitor(5.79±0.83)%和inhibitor NC(3.31±0.42)%比较,miR-214-5p mimic的AXIN2基因甲基化率(2.13±0.32)%显著降低, 差异有统计学意义(P<0.001); 而inhibitor的AXIN2基因甲基化率与其他三组相比显著升高,差异有统计学意义(P<0.001),见图5。
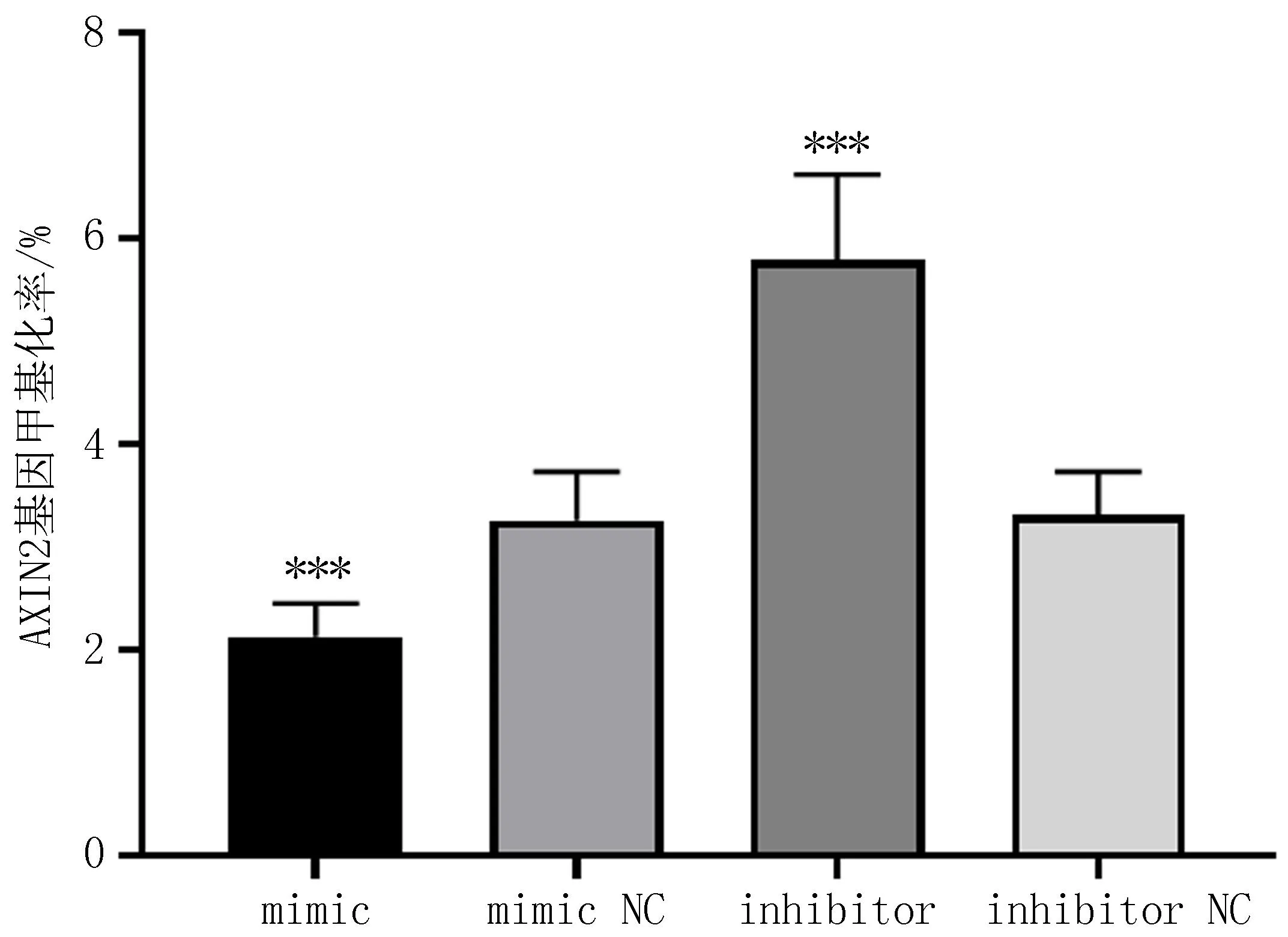
注:与其他三组比较, ***P<0.001。
3 讨论
BCC是一种好发于面颈部、手部等暴露部位的恶性肿瘤,严重危害患者的生命健康和生活质量[12-13]。本研究通过分析发现,AXIN2基因甲基化率与BCC的发生、发展有关,这有助于阐明BCC的发病机制,为其临床治疗靶标的发现提供参考。AXIN2是Wnt/β-catenin信号通路的负调控因子。研究表明,Wnt/β-catenin信号通路的异常激活使得c-myc和Cyclin D1转录增强,对细胞增殖、分化、迁移、凋亡等多种细胞生物学功能具有调控作用,该通路已被证实在多种癌症的发生、发展中起关键作用[14-15]。乳腺癌组织中,AXIN2基因启动子甲基化阳性率(40.5%)相较于癌旁组织(19.0 %)显著升高,且癌组织中的AXIN2甲基化表达水平与淋巴结转移、雌激素受体及孕激素受体表达状态有关[8]。结肠癌组织中,AXIN2基因甲基化率显著增高,且与疾病的进展有关[9]。Kandimalla等[10]研究结果显示,AXIN2甲基化率升高与II期结肠癌复发密切相关,可作为结肠癌不良预后的生物标志物。本研究结果显示,BCC癌组织的AXIN2基因甲基化率显著高于癌旁正常组织,而基因mRNA相对表达水平显著低于癌旁正常组织,且BCC癌组织的AXIN2基因甲基化率和mRNA相对表达水平呈负相关。此外,发生转移患者癌组织中AXIN2基因甲基化率显著高于无转移患者。提示AXIN2基因甲基化率升高可能通过下调基因表达参与到BCC的发生机制中。
基因甲基化率受DNA甲基转移酶家族调控,DNMT1作为该家族的重要成员之一,在基因甲基化率调控中起着关键作用。Targetscan数据库分析结果表明,DNMT1与miR-214-5p具有靶向结合位点。本研究通过双荧光素酶报告基因实验结果也验证了miR-214-5p与DNMT1的靶向关系。因此,DNMT1是miR-214-5p的靶基因。miR-214-5p已被证实可参与到多种癌症的发生、发展中[16-17]。Cao等[16]的研究显示,miR-214-5p对胰腺癌细胞的迁移和侵袭具有调控作用,可作为胰腺癌靶向治疗的生物学标志。Zhang等[17]的研究发现miR-214-5p可通过靶向ROCK1抑制人骨肉瘤细胞的增殖和侵袭。本研究结果显示,miR-214-5p在BCC患者中的表达水平降低,而DNMT1表达水平升高。提示miR-214-5p可能通过靶向DNMT1表达参与BCC的发病机制中。为进一步明确miR-214-5p通过DNMT1介导的AXIN2基因DNA甲基化修饰在BCC中的作用机制,本研究使用miR-214-5p转染A431细胞结果显示,miR-214-5pmimic的DNMT1表达水平和AXIN2基因甲基化率相对于其他三组显著下降,而inhibitor的DNMT1表达水平和AXIN2基因甲基化率相对于其他三组显著上升。表明BCC中miR-214-5p表达水平下调,上调DNMT1的表达水平,使AXIN2基因甲基化率升高。
综上所述,miR-214-5p可通过靶向作用于DNMT1,影响AXIN2基因的DNA甲基化率,调节AXIN2基因表达,参与到BCC的发病机制中。

