宫颈癌放疗患者临床特征、DVH参数及血清细胞因子预测急性放射性肠炎发病的前瞻性队列研究
戴 颖, 臧春宝, 张余飞, 柯 学, 刘云琴
(安徽省肿瘤医院放疗科, 合肥 230000)
宫颈癌是一种发生在子宫颈细胞中的癌症,与人乳头瘤病毒(Human papilloma virus,HPV)有关。近年来对宫颈癌的预防、筛查、诊断和治疗方面都取得了一定进展,宫颈癌的发病率位居女性癌症发病率的第四位,据统计2016年中国新增宫颈癌病例约119 300例,死亡病例约37 200例[1]。放疗是宫颈癌治疗的主要方法,但近80%接受盆腔放疗的患者出现急性放射性肠炎(Acute radiation enteritis,ARE)[2]。ARE常自放疗开始后第2周出现,在第4~5周达到高峰[5]。临床常见症状为恶心、呕吐、腹痛等。ARE发生的主要病因为射线对肠道黏膜的直接损伤[6],其机制为辐射导致肠隐窝上皮干细胞死亡,从而导致上皮细胞丢失,同时辐射对肠道屏障的损伤也会使得肠道抵抗病菌、病原的能力降低,发生继发损害[8]。电离辐射是一种促炎信号,在肠道微环境中产生活性氧,激活促炎细胞因子、趋化因子和生长因子,招募免疫细胞,诱导炎症反应的发生[9]。本研究收集了宫颈癌患者相关的临床及放疗相关参数,采用流式荧光法检测患者放疗前后血清细胞因子水平,分析各因素对急性放射性肠炎的预测作用,现报道如下。
1 资料与方法
1.1 一般资料以2022年3月-2022年12月就诊于安徽省肿瘤医院放疗科的48例宫颈癌患者为研究对象。纳入标准:(1)年龄18~80岁;(2)病理确诊为宫颈癌;(3)患者无认知、交流障碍;(4)Karnofsky 功 能 状 态 ( Karnofsky performance status,KPS) 评分>70 分,预期生存≥6 个月。排除标准:(1)既往腹盆腔放疗史;(2)合并严重心肺原发性疾病、肠道疾病或免疫性疾病者;(3)因严重非胃肠道并发症或个人原因未能完成放疗者。本研究通过安徽省肿瘤医院伦理委员会审批,所有患者均签署知情同意书。
1.2 方法
1.2.1 放射治疗 (1)定位:定位前1 h患者排空大小便;饮用800 mL水(加入含碘造影剂),使膀胱充盈及肠道显影。患者取仰卧位行定位扫描,上界为第11胸椎上缘,下界至坐骨结节下5 cm,层厚为2.5 mm。将所得CT图像经局域网传到放射治疗计划系统 (Treatment planning system,TPS)。根据美国肿瘤放射治疗协作组织(Radiation therapy oncology group,RTOG)相关推荐勾画靶区及危及器官(Organ at risk,OAR),并由一位副主任级别以上医师审核靶区及计划。(2)治疗:采用6MX-X射线,放疗总剂量为45~50 Gy,1.8~2 Gy/d,5次/周,5周完成整个放疗计划。阳性淋巴结(GTVnd)局部加量至60 Gy。腹主动脉旁、髂总出现可疑阳性淋巴结则行延伸野照射;病灶侵及子宫外膜行宫旁加量。OAR受照剂量限制:小肠V40<30%、V45<195%、Dmax<54 Gy,直肠V50<35%、Dmax<54 Gy,乙状结肠V50<35%、Dmax<54 Gy,膀胱V50<35%、Dmax<54 Gy,外阴Dmax<50 Gy,股骨头V50<5%,骨盆V20<76%,V10<95%。根据患者复发危险因素及一般情况决定是否行同步化疗,同步化疗方案均为每周顺铂35 mg/m2方案。
1.2.2 急性放射性肠炎评估 根据RTOG急性放射损伤标准评价(下消化道包括盆腔)[3]:0级:无变化;1级:大便次数增多或大便习惯改变,无需用药/直肠不适,无需止痛治疗;2级:腹泻,需要抗副交感神经药/黏液分泌增多,无需卫生垫/直肠或腹部疼痛,需止痛药;3级:腹泻,需肠胃外支持/重度黏液或血性分泌物增多,需卫生垫/腹部膨胀平片示肠管扩张;4级:急性或亚急性肠梗阻、瘘或穿孔,胃肠道出血需输血,腹痛或里急后重,需置管减压或肠扭转。1级及以上即为发生急性放射性肠炎,纳入ARE组,0级纳入非ARE组。
1.3 指标测定
1.3.1 临床特征指标的收集 患者入院时行病史采集及影像学评估,收集患者年龄、疾病分期、病理类型、BMI等情况。
1.3.2 放疗剂量体积直方图(Dose volume histogram,DVH)参数的收集 制定患者放疗计划后,自计划系统中记录患者小肠、乙状结肠、直肠的V40、V45、V50(%)数据。
1.3.3 血浆细胞因子的测定 放疗前及放疗第5周后采用EDTA抗凝管收集患者空腹静脉血液,以3 000 r/min离心30 min,采用BD FACS Calibur流式细胞仪(美国艾森公司),按12项细胞因子检测试剂盒(青岛瑞斯凯尔生物科技有限公司)说明书操作,检测患者血浆中的IL-4、IL-6、IL-10、IL-12p70、IL-10、IFN-γ、TNF-α水平。
2 结果
2.1 临床特征资料与ARE发生率的比较本研究共入组48例患者,未发生ARE的例数23例,发生ARE的例数为25例,其中ARE1级14例,ARE2级11例。非ARE组与ARE组比较,不同临床分期组间ARE发生率差异有统计学意义(P<0.001);年龄、BMI、病理类型、照射剂量是否大于50 Gy、是否手术治疗、是否延伸野照射、是否宫旁加量、是否同步化疗的分组间ARE发生率差异无统计学意义(P>0.05),见表1。

表1 临床特征资料与ARE发生率的比较
2.2 ARE组与非ARE组DVH参数及放疗前后血浆细胞因子水平的比较与非ARE组比较,ARE组小肠、乙状结肠及直肠的V40、V45、V50;放疗前后血浆IL-4、IL-6、IL-12p70、IL-17、IFN-γ、TNF-α水平差异均无统计学意义(P﹥0.05),见表2、3。

表2 ARE组与非ARE组DVH参数比较/%

表3 ARE组与非ARE组血浆细胞因子水平比较/[ M(P25,P75), ng/mL]
2.3 DVH参数、放疗前细胞因子水平与ARE发生率的比较以DVH参数及放疗前细胞因子水平中位数为界,将患者分为小于等于中位数组与大于中位数组,比较ARE发生率。其中IL-12p70小于等于中位数组ARE发生率65.4%,高于IL-12p70大于中位数36.4%,差异有统计学意义(P<0.05),见表4。

表4 以DVH参数及细胞因子水平中位数分组ARE发生率比较
2.4 ARE相关影响因素的Logistic回归分析Logistic回归单因素分析结果显示分期、IL-12p70大于中位数、IL-17大于中位数、IFN-γ大于中位数对于ARE的发生是有潜力的影响因素(P<0.2),见表5。将上述因素纳入多因素分析,结果显示,分期、IL-12p70大于中位数、IL-17大于中位数是ARE发生的影响因素(P<0.05)。其中IL-17>中位数是危险因素,比值比(Odds ratio,OR)为12.056(95%CI:1.061~137.048),分期、IL-12p70大于中位数是保护因素,OR分别为0.249(95%CI:0.077~0.797),0.108(95%CI:0.010~1.226),见表6。
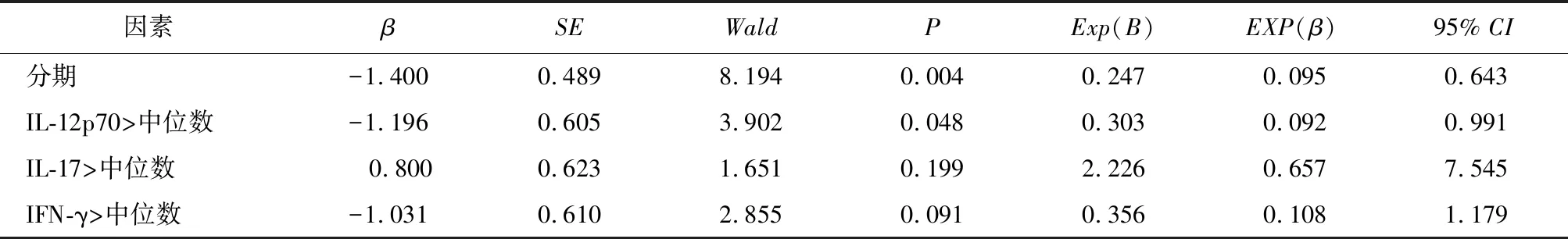
表5 Logistic回归单因素分析筛选影响ARE发生的因素

表6 ARE相关因素Logistic回归多因素分析
2.5ROC曲线分析单因素及联合模型对ARE的预测效能ROC曲线分析结果显示单因素中分期对ARE的发生有预测价值(P<0.05)。含分期、IL-12p70大于中位数、IL-17大于中位数3个因素的联合模型对ARE的发生具有预测价值(P<0.000 1),其AUC为0.838,敏感度为0.720,特异度为0.826,见表7、图1。

表7 单因素及联合模型预测效能检验相关参数

图1 分期、IL-12p70大于中位数、IL-17大于中位数、IFN-γ大于中位数及联合模型的ROC曲线
3 讨论
随着放疗技术的进步,腹盆腔肿瘤放射治疗中胃肠道等正常器官受量下降,相关胃肠道不良反应发生率较前下降,但ARE仍然是限制腹盆腔放疗的重要因素[4]。本研究通过对患者临床资料、放疗DVH参数、放疗前后血清细胞因子水平与ARE发生率的分析发现,含分期、IL-12p70大于中位数、IL-17大于中位数3个因素的联合模型对ARE的发生具有预测价值。
本研究结果提示临床分期与ARE发生相关,其原因与早期病人行子宫及附件切除术相关。术后的患者直肠位置较前移动,所受照射量高于未手术者;手术后末端回肠和远端结肠较为固定,也会导致RE的发病率升高[10]。放射性损伤在一定程度上与受照剂量有相关性,本研究样本受照均在剂量限制内,因样本量较小,故未能在DVH参数上体现该相关性,结果中DVH参数未能有效预测ARE的发生。目前尚无研究系统全面地描述细胞因子与放射性肠炎的关系,多数既往研究设置在动物模型或小样本患者群体中,通常是将放疗前、后肠道黏膜局部的细胞因子水平做对比,探讨指标较少且各不相同。例如,Liu等发现接受放疗后的大鼠肠道中的IL-2、IL-6明显增高[11]。Indaram等检验了IL-1β、IL-2、IL-6和IL-8在放射性肠炎患者患处黏膜样本中的水平,将其与正常样本及炎性肠病样本做对比,结果显示,与正常样本对比,IL-2、IL-6和IL-8水平在放射性肠炎及炎性肠病患者样本中明显增高,且炎性肠病患者样本的IL-6和IL-8水平高于放射性肠炎样本[12]。本研究中血清中IL-6水平在放疗前后分别为1.5 ng/mL和2.3 ng/mL,有升高趋势,但由于样本量限制或血清与黏膜局部组织的不同,差异无统计学意义,可继续扩充样本进一步研究。在临床中因放射性肠炎的病人肠道黏膜修复能力差,目前不建议行肠镜下活检,本研究聚焦于放疗前血液中的细胞因子水平,且纳入了更多的细胞因子检测指标,探讨是否有细胞因子能反映更易发生放射性肠炎的微环境。在本研究中放疗前血清中的IL-17水平是ARE发生的危险因素,IL-17具有募集中性粒细胞的作用,还可诱导T细胞活化以及刺激成纤维细胞、巨噬细胞、上皮细胞产生多种炎症因子,还可与TNF-α协同加强炎症效应[13]。既往研究表明IL-17及IL-23p19在慢性放射性肠炎黏膜组织中高表达,且与症状积分及内镜评分呈正相关,可佐证Th-17/IL-23免疫轴参与了RE的发生发展[14]。除此之外,本研究中放疗前血清中的IL-12p70显示为ARE的保护因素,IL-12p70(活性白细胞介素12)是一种分泌性异二聚体细胞因子,含有二硫键结合的p35和p40亚基。IL-12是Th1细胞免疫应答的决定因素,也是诱导T淋巴细胞和NK细胞产生IFN-γ的细胞因子[15]。高剂量的辐射可导致机体转向Th2型微环境,倾向免疫抑制状态[16]。Linard等建立的Th1缺陷小鼠模型放疗后出现更严重的肠道胶原降解,表明Th2型微环境与肠道放射性损伤有关[17]。基于以上研究,推测放疗前较高水平的IL-12可以维持机体内的Th1/Th2平衡,减轻放疗所致RE。
目前对ARE多采用支持性治疗[18],如载体类药物、抗氧化剂、益生菌、肠黏膜保护剂、谷氨酰胺等[19-20]。高压氧治疗(Hyperbaric oxyen,HBO) 以及手术治疗虽有一定的疗效,但其结果多为小型的单中心非双盲研究[21]。腹盆腔肿瘤的放射治疗通常疗程较长,大多数针对放射性肠炎的治疗手段起效较慢,本研究建议对行腹盆腔放疗的患者进行治疗前综合评估,包括临床参数、放射计划DVH参数及细胞因子水平等,筛选出更容易发生放射性肠炎的人群,从而进行早期干预、精准预防,使患者获益。

