马里苷对糖尿病小鼠肝脏和胰腺组织形态及自噬的影响*
张 芳,祖力皮亚·阿布拉,克迪热亚·卡迪尔,宋志鹏,张博翔,张雁潮,彭小雨,李 甜
新疆医科大学,新疆 乌鲁木齐 830011
糖尿病是以体内血糖调节失衡为特征的代谢紊乱性疾病。根据胰岛素的相对或绝对性缺乏,糖尿病分为1 型糖尿病(type 1 diabetes mellitus,T1DM)和2 型糖尿病(type 2 diabetes mellitus,T2DM)。T1DM 是由胰腺β细胞受损导致的胰岛素缺乏的自身免疫性疾病;T2DM 的特征是由于胰岛素分泌的逐渐性减少而导致胰岛素相对不足,亦或是目标组织如肝脏、骨骼肌、脂肪组织中的胰岛素受体作用降低,也称为胰岛素抵抗[1]。高血糖是两种类型糖尿病的共同特征。慢性高血糖不仅损害相关脏器以及外周靶组织,也会造成机体代谢紊乱,累积形成严重的各种并发症[2-4]。
马里苷是一种黄酮类化合物,提取自稀有高寒、功效独特的野生植物两色金鸡菊。已有研究证实两色金鸡菊具有抗氧化、降血压、降血糖、降血脂、抗肿瘤的生物学功效[5-6]。马里苷是两色金鸡菊中重要的黄酮类化合物,能够改善胰岛素抵抗、抑制糖异生并促进糖原合成,但其具体作用机制还需进一步研究[7-8]。本研究通过研究马里苷对糖尿病小鼠肝脏和胰腺的组织形态的影响进而对其调节自噬的功能进行探讨。
1 材料与方法
1.1 实验动物选择因瘦素受体基因缺陷造成自发形成糖尿病的10 只db/db 小鼠和30 只db/m小鼠为研究对象。小鼠购自江苏常州卡文思实验动物有限公司,实验动物合格证号:IACUC-20190226-20。饲养条件:实验小鼠单笼、单只饲养,自由饮水,每隔两天更换垫料,SPF 动物饲养室模拟自然昼夜条件,日间相对温度(20±2)℃,相对湿度(45±5)%,每日日照时间为12 h。本实验按照《新疆医科大学实验动物护理与使用指南》进行动物实验(伦理批准号:IACUC-20190226-20)。
1.2 试剂及仪器马里苷(法国Extrasynthese公司,货号:C00007893);二甲双胍(上海施宝制药有限公司,批号:H20023370);GAPDH 抗体(北京国鼎昌盛生物技术有限公司,批号:GA003-R);二抗IgG H&L/HRP(Bioss,批号:Bs-0295G-HRP);兔抗LC3 Ⅱ/I、P62、ATG、Beclin(Cell Signaling Technology,批号:12741,39749,12994,3495);HE染色试剂盒(Biosharp,批号:BL700B-1);山羊血清、羊抗兔二抗、DAB 显色试剂(中杉金桥生物技术有限公司,批号:ZLI-9065,2010D1217,ZLI-9018)。043BR39035 型垂直型电泳槽、BIO-RAD 型凝胶成像仪(美国Bio-Rad 公司);DM3000 型拍照显微镜(Leica公司)。
1.3 分组及处理10 只雄性db/m 小鼠为对照组,30只雄性db/db小鼠分为模型组、二甲双胍阳性药组、马里苷给药组,每组10 只。小鼠饲养于新疆医科大学动物实验中心SPF 级动物饲养室。各组小鼠均喂养转基因敲除小鼠饲料和基础饲料,二甲双胍阳性药组给予二甲双胍溶液灌胃,剂量为280 mg/kg,马里苷给药组给予马里苷溶液灌胃,剂量为50 mg/kg。各组灌胃体积0.02 mL/g,持续8周。8周后处死小鼠,收集各组小鼠胰腺和肝脏组织样本,并进行后续实验。
1.4 标本采集用10%戊巴比妥钠溶液麻醉处死小鼠后,小心摘取肝脏和胰腺,注意不要破坏其结构。纵向将肝脏和胰腺剖成两半,用4%多聚甲醛在4 ℃冰箱固定一夜,经石蜡包埋固定成型。
1.5 观察指标
1.5.1 小鼠肝脏和胰腺病理学观察 标本进行脱蜡后,100%、90%、80%酒精处理各5 min,并分别用自来水冲洗5 min;苏木精染色5 min,流水冲洗;5%乙酸分化1 min,组织变色呈现蓝色;伊红染色1 min,流水冲洗;70%、80%、90%、100%酒精脱水各10 s,再用二甲苯Ⅰ5 min,二甲苯Ⅱ10 min透明化处理,晾干切片后用中性树脂进行封片。每组随机选取4 只小鼠的组织切片,在光学显微镜下观察小鼠肝脏和胰腺的组织形态。
1.5.2 免疫组化染色对肝脏组织P62 的定位、定量分析 光镜下观察不同组小鼠肝脏P62 的表达,HE 染色后将小鼠肝脏组织制成石蜡块。经脱蜡、复水、蒸馏水洗涤切片后,将其浸泡于10 mol/L浓度的柠檬酸盐溶液中。进行抗原修复后,缓冲液洗3 min/2 次,之后将切片浸泡于3%过氧化氢溶液10 min。用PBS 溶液进行洗涤切片后,0.5%Triton X-100 溶液浸泡切片10 min。最后封闭(5%BSA 溶液)切片45 min,将配置好的一抗溶液在37 ℃孵育1~2 h。孵育结束后,用PBS溶液清洗切片3 次,加酶标二抗在室温中孵育30 min,再次用PBS 溶液洗涤切片3 次后,用DAB 显色液显色5 min,之后用自来水充分冲洗,复染,脱水,透明化处理,最后在光学显微镜下进行形态学观察和取图。
1.5.3 Western Blotting 检测小鼠肝脏组织内自噬相关蛋白的表达水平 小鼠断颈处死后,取其肝组织,提取目的蛋白并采用蛋白免疫印迹检测。将小鼠肝脏组织剪碎,与生理盐水混合离心,反复此步骤,直至离心上清液无色透明;吸去离心上清液,加入裂解液,之后将裂解产物在冰浴中用超声机,超声后离心吸去上清,获取肝组织蛋白质。电泳前进行溶液配置、制胶,将提取的蛋白质电泳、转膜、封闭,进行一抗、酶标二抗孵育,最后加入酶底物,化学显色。用Bio-Rad凝胶成像仪采集图像,用Image-lab 软件对Western-blotting结果进行带密度测定分析。
1.6 统计学方法选择SPSS 26.0 软件对各组数据进行统计学分析,GraphdPadPrism 8.0 软件辅助作图,多组数据采用单因素方差分析进行统计,P<0.05表明差异有统计学意义。
2 结果
2.1 小鼠肝脏组织病理学改变对照组小鼠肝脏组织内肝小叶结构完整清晰,肝细胞板排列整齐,肝细胞呈多边形,1~2 个细胞核居中,胞浆丰富;门管区将相邻肝小叶分隔开,较易识别。模型组小鼠肝脏组织内肝小叶结构模糊,肝索紊乱,部分部位索状结构消失,肝细胞体积变大呈圆形,伴有气球样变,胞核移向胞膜,胞膜完整结构破坏,界限不清,部分可见细胞弥漫性脂肪空泡变性。门管区可见大量炎症细胞浸润,相对于模型组小鼠,二甲双胍阳性组与马里苷给药组小鼠肝小叶结构较清晰,肝细胞排列成索状,部分肝细胞体积较大,呈圆形,胞膜结构不清晰,门管区少量炎性细胞浸润。见图1。

图1 各组小鼠肝脏组织病理学观察(HE,×200)
2.2 小鼠胰腺组织病理学改变对照组小鼠胰腺组织结构饱满,胰岛在胰腺腺泡间散在分布,形态呈圆形或卵圆形,与周围组织分界清晰,未见明显异常;胰岛内胰岛细胞排列整齐,胞核呈圆形居中,胞浆丰富;模型组小鼠的胰腺组织出现明显肥大,胰岛萎缩,形态不规则,边缘不整齐,与周围组织界限不清晰,并有纤维组织增长,胰岛细胞排列紊乱,并且部分胰岛细胞出现空泡状甚至出现核固缩和核溶解现象。相对于模型组,二甲双胍阳性药组和马里苷给药组小鼠胰岛形态较正常,边界比较清晰,胰岛细胞排列有明显改善,胰岛细胞空泡状变性减少。见图2。

图2 各组小鼠胰腺组织病理学改变(HE,×200)
2.3 小鼠肝脏自噬相关蛋白P62 表达模型组与对照组小鼠相比,肝脏组织细胞P62 表达显著增高,而二甲双胍和马里苷干预可缓解逆转糖尿病引起的P62表达。见图3。

图3 各组小鼠肝脏组织P62免疫组化图(免疫组化染色,×200)
2.4 小鼠肝脏自噬相关蛋白LC3Ⅱ/I、P62、ATG5和Beclin1 表达与对照组比较,模型组小鼠P62水平显著增高(P<0.01),LC3Ⅱ/I 比值、Beclin1和ATG5 水平均下降(P<0.05);与模型组比较,二甲双胍和马里苷干预后均能降低糖尿病小鼠P62的表达,增加LC3Ⅱ/I、Beclin1 及ATG5 的表达水平(P<0.05)。见图4—5。
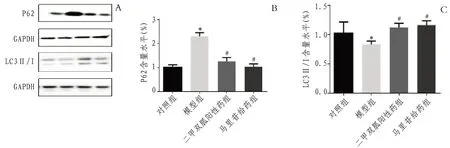
图4 各组小鼠肝脏自噬相关蛋白P62、LC3Ⅱ/I含量水平比较

图5 各组小鼠肝脏自噬相关蛋白ATG5、Beclin1含量水平比较
3 讨论
慢性高血糖造成机体代谢紊乱,同时损害相关脏器以及外周靶组织。肝脏作为物质代谢的中间场所,从一开始就处于糖尿病发展过程中代谢网络的核心位置,并直接或间接地参与整个机体物质代谢过程[9-10]。糖尿病会造成肝脏病理性损害,表现为肝小叶和肝细胞形态学改变[11]。本实验主要通过观察对比db/db 糖尿病小鼠组与马里苷药物组小鼠的肝小叶结构、肝细胞板围绕中央静脉形态和肝细胞形态的不同,发现马里苷对于糖尿病小鼠肝脏损伤具有缓解及纠正作用。
胰腺内的胰岛细胞可产生胰岛素、胰高血糖素,它们可以调节机体血糖的变化,对于糖尿病疾病的转化发展具有非常重要的作用[12]。实验证明马里苷可显著改善db/db 小鼠胰腺体积增大及胰岛细胞排列紊乱,同时能增加其胰岛素分泌量并升高血浆胰岛素水平,因此马里苷对于糖尿病小鼠胰腺损伤的也有着明显的治疗作用[13]。
细胞自噬与人类健康和疾病防治有着密切的关系。自噬过度还是自噬不足都可能导致疾病发生[14]。在胰岛素抵抗的情况下,器官和组织的自噬被明显抑制。自噬对于维持细胞内代谢平衡,调控细胞各种活动,保护细胞完整性,维持细胞自稳具有重要作用[15]。自噬体在形成过程中有两种自噬有关蛋白质是必须参与的,即ATG5 和Beclin-1(酵母ATG6 同源物),二者除了促进自噬体的形成,还被认为是调控细胞自噬和凋亡的分子开关蛋白[16]。LC3 是自噬的重要标志物,当自噬被激活时,胞浆型LC3(即LC3-I)会酶解掉一小段多肽,转变为(自噬体)膜型(即LC3-Ⅱ),LC3-Ⅱ/I 比值的大小可以估计自噬水平的高低。P62蛋白称作SQSTMI,因其与LC3 的相互作用表达在自噬体上,在正常生理情况下易被自噬降解,P62表达量的升高意味着自噬的缺陷,是与自噬强度呈负相关的标志分子[17-18]。实验表明马里苷可以显著增加糖尿病小鼠肝脏自噬相关蛋白LC3Ⅱ/I、ATG5 和Beclin1 的表达,降低P62 的表达,促进糖尿病小鼠肝脏自噬表达。
综上所述,自噬参与调控机体对胰岛素的敏感性及其应答,并影响肝脏组织胰岛素信号的传递,调控肝脏胰岛素抵抗的发生[19]。肝脏胰岛素抵抗的发生,影响机体糖代谢,破坏肝脏组织结构和功能,会进一步加重糖尿病[20]。从本实验可以得出,马里苷通过诱导自噬调节肝脏胰岛素抵抗,起到治疗糖尿病的作用。

