清肠温中方联合粪菌移植对溃疡性结肠炎小鼠肠黏膜免疫的调控作用*
孙中美,李军祥,路琼琼,丁庞华,姜 慧,施晓军,毛堂友△
1 北京中医药大学东方医院,北京 100029; 2 天津市南开医院,天津 300102
溃疡性结肠炎(ulcerative colitis,UC)是一种累及黏膜及黏膜下层的结肠、直肠的慢性非特异性炎症性疾病。UC 的病因尚不明确,目前亦无治愈方法[1]。粪菌移植是通过调节肠道菌群治疗UC 的新兴疗法,主要是将健康供菌者粪便中的功能菌群,移植到患者胃肠道内,通过重塑肠道菌群结构,从而达到治疗目的[2]。但越来越多的研究发现粪菌移植治疗UC 的疗效存在局限性,尤其是长期疗效不明确。中医药治疗UC 历史悠久,可通过调节人体阴阳平衡、达到五脏调和。前期研究发现,清肠温中方治疗UC 疗效确切,且联合应用粪菌移植可明显缓解UC 的肠道炎症及病理损伤,但具体机制不明[3]。本研究在前期工作的基础上,以肠黏膜免疫为切入点,通过检测γδT 细胞、CD4+T 细胞、分泌型免疫球蛋白A(secretory immunoglobulin A,sIgA)及其相关因子的表达,探究清肠温中方联合粪菌移植治疗UC 小鼠的免疫学机制。
1 材料及方法
1.1 实验动物30 只6~8 周的SPF 级健康雌性C57BL/6 小鼠,购自斯贝福(北京)生物技术有限公司,实验动物许可证号:SCXK(京)2016-0002。饲养于北京中医药大学东方医院SPF 级动物房,12 h 光照/黑夜循环,温度25 ℃,湿度60%,自由进食饮水饲养。动物的饲养及干预过程,严格遵守北京中医药大学东方医院实验动物中心操作规范进行,实验过程已通过北京中医药大学东方医院实验动物伦理委员会审查(实验动物伦理批准号:201922)。
1.2 实验用药清肠温中方(药物组成:黄连6 g,炮姜10 g,三七6 g,青黛3 g,地榆炭15 g,苦参9 g,木香6 g,炙甘草6 g)配方颗粒购自于北京中医药大学东方医院颗粒药房,药物制备及质控由北京康仁堂药业有限公司完成。
1.3 试剂及仪器DSS(MW 36000-50000Da,MP Bio-medical);便潜血试纸(珠海贝索生物技术有限公司,批号:B191101);10%中性福尔马林固定液(北京索莱宝科技有限公司,批号:20200917);HE染液(北京索莱宝科技有限公司,批号:20200904);小鼠sIgA Elisa 试剂盒(上海酶联生物科技有限公司,批号:201909);One Step TB Green®Prime Script™RT-PCR Kit Ⅱ(Takara Bio,批号:AJC1834A);RPMI1640 培养基(Hyclone,批号:AF2954630);胎牛血清(Hyclone,批号:DD19362264)。 FITC-CD3,BV605-CD4,BUV395-TCRγδ(BD Pharmingen、Biolegend、eBioscience),UCT 型超薄切片机(Leica);LSRFortessaTM型流式细胞仪(BD Bio-sciences),7300 Real Time PCR System(App-lied Biosystems);Synergy H1 型多功能酶标仪(Bio-Tek);BX51 显微镜(Olympus)。
1.4 造模及分组将30只雌性C56BL/6小鼠,按1∶4 的比例随机分为空白组、干预组,普通饲料喂养,昼/夜12 h/12 h 交替,温度25 ℃,湿度60%。空白组小鼠全程自由进食饮水,自第8 天起,每日接受无菌水灌胃(0.1 mL/20 g),并于每天早上10 点采集新鲜粪便,制作粪便滤液;粪便滤液制作方法在前期研究的基础上进行部分更改[4-5],具体步骤如下:腹部轻柔按摩或者搔刮法刺激小鼠排便,称定质量后按照1∶5 的比例将粪便溶解并匀浆于无菌水中,在4 ℃,2000 r/min 离心1 min后,分离上清液,保存在4 ℃冰箱保存,按照0.1 mL/20 g 剂量灌胃。干预组小鼠予2.5% DSS 水溶液自由饮用7天造模后,随机分为4组:模型组、清肠温中方组、粪菌移植组、联合组。自第8 天起,模型组小鼠予无菌水灌胃(0.1 mL/20 g),清肠温中方组予清肠温中方水溶液(1.8 g/kg,0.1 mL/20 g)灌胃,粪菌移植组予粪菌滤液(0.1 mL/20 g)灌胃,联合组予清肠温中方(1.8 g/kg,0.1 mL/20 g)联合粪菌滤液(0.1 mL/20 g)灌胃。各组干预7天,监测小鼠疾病活动指数(disease activity index,DAI),光镜下观察HE 染色结肠组织石蜡切片,评价病理变化。干预结束后,麻醉后处死小鼠,取脾脏置于含有10%FBS 的RPMI1640 培养基中,用于流式细胞术检测。取1 cm 结肠置于10%中性福尔马林固定液中固定,用于制作HE 染色石蜡切片,其余结肠组织置于液氮中冻存,用于相关基因及蛋白的检测。
1.5 观察指标
1.5.1 小鼠DAI 评价 DAI 的评分[6]=(体质量下降指数+粪便性状+粪便潜血)/3。见表1。
1.5.2 小鼠结肠组织病理学评分 各组小鼠结肠组织病理学评分由炎症程度及病变深度两个维度进行评价[7]。见表2。

表2 结肠组织病理学的评分标准
1.5.3 流式细胞术检测UC小鼠免疫系统指标 将小鼠脾脏分别置于含有2 mL 冰RPMI1640 培养基(含10%FBS)的60 mm 培养皿中,使用注射器胶栓轻轻研碎,使用70 μm 白筛网过滤,经过裂红、洗涤,以2000 r/min 离心5 min 后重悬细胞。加入CD3、CD4、TCRγδ 流式抗体,4 ℃避光孵育30 min进行细胞膜表面染色,洗涤离心后重悬细胞,进行流式细胞检测。
1.5.4 RT-qPCR 法检测UC 小鼠结肠TLR2、pIgR mRNA 的表达 Trizol 法提取小鼠结肠总RNA 后,利用One Step TB Green®PrimeScript™RTPCR Kit Ⅱ按照说明书进行反转录及扩增,以GAPDH 为内参,以2-△△Ct法对数据进行分析。本研究中所用的引物序列见表3,引物由英潍捷基(上海)贸易有限公司合成。

表3 引物序列
1.6 ELISA 法检测UC 小鼠结肠sIgA 的表达称取结肠组织质量,以冰生理盐水制成10%的组织匀浆,严格按照ELISA试剂盒说明书,在450 nm波长下测定吸光度值,绘制标准曲线计算sIgA含量。
1.7 统计学方法应用GraphPad prism 8 进行数据统计及绘图。计量资料以表示。组间比较采用单因素方差分析,P<0.05 为差异有统计学意义。
2 结果
2.1 小鼠一般情况除联合组2 号小鼠在实验第12 天不明原因死亡,其余小鼠均对造模及药物干预较为耐受。造模期间,各干预组小鼠开始出现不同程度的粪便潜血阳性,并最终出现肉眼血便,伴随毛发光泽减退,反应迟缓、懒动、大便稀溏、体质量增加趋势放缓,且自第5 日起体质量明显下降。而停用DSS 水溶液后,小鼠临床表征均开始缓解,且各干预组小鼠呈现相对快速地恢复过程。
2.2 小鼠DAI指数DAI由体质量、粪便性状、粪便潜血三个维度构成。造模成功后各自干预7天,与空白组比较,模型组小鼠DAI明显升高(P<0.01);与模型组相比,粪菌移植组、清肠温中方组以及联合组小鼠DAI指数均明显下降(P<0.05)。见表4。
表4 各组大鼠DAI评分、病理评分、γδT细胞、CD4+T细胞、TLR2 mRNAp、IgR mRNA及sIgA比较()

表4 各组大鼠DAI评分、病理评分、γδT细胞、CD4+T细胞、TLR2 mRNAp、IgR mRNA及sIgA比较()
注:与空白组比较,#表示P<0.05,##表示P<0.01;与模型组比较,*表示P<0.05,**表示P<0.01
?
2.3 小鼠结肠组织病理学表现模型组小鼠结肠黏膜隐窝结构紊乱,伴中性粒细胞浸润,结肠黏膜连续性破坏,病理评分显著升高(P<0.01)。清肠温中方组、粪菌移植组、联合组小鼠结肠黏膜炎性细胞浸润等均有不同程度的减轻,黏膜连续性破坏明显减少,且联合组小鼠结肠病理评分较模型组明显降低(P<0.05)。见表4、图1。

图1 各组小鼠结肠组织病理学表现(HE,×20)
2.4 小鼠γδT 细胞含量运用流式细胞术检测脾脏γδT细胞发现,模型组γδT细胞含量较空白组明显升高(P<0.01),而各治疗组与模型组相比明显降低(P<0.05或P<0.01)。见表4、图2。
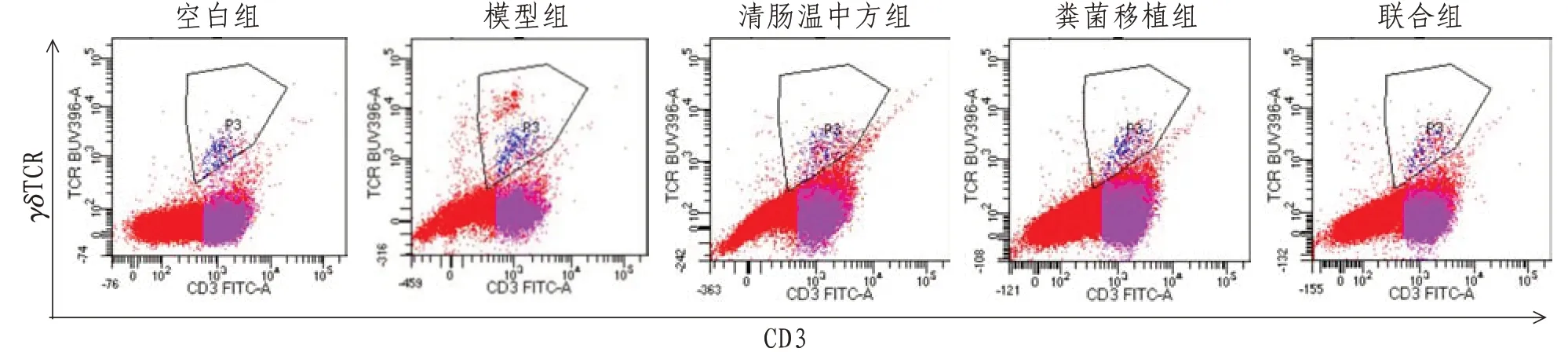
图2 各组小鼠γδT细胞比较
2.5 小鼠CD4+T 细胞表达量与空白组相比,模型组小鼠CD4+T 细胞比例及TLR2 mRNA 表达明显升高(P<0.01),经过清肠温中方、粪菌移植干预后,与模型组相比,干预组小鼠CD4+T 细胞及TLR2 mRNA表达明显降低(P<0.05),见表4、图3。

图3 各组小鼠CD4+T细胞分化比较
2.6 小鼠结肠sIgA 及其受体表达量与空白组相比,模型组小鼠结肠sIgA、pIgR mRNA表达明显降低(P<0.05),经过清肠温中方联合粪菌移植干预7天后,干预组小鼠结肠sIgA、pIgR mRNA 较模型组表达明显升高(P<0.05)。见表4。
3 讨论
UC 因病程长,炎症反复发作,导致结肠癌发病风险明显增高,严重影响患者的生存质量,因此早发现早治疗是UC 的重要策略[7-8]。目前UC 的发病机制尚不完全清楚,越来越多的证据表明本病与肠黏膜免疫紊乱密切相关[9]。
γδT细胞是一类特殊的T细胞,是肠道上皮间淋巴细胞的重要组成部分,构成宿主抵抗肠道病原菌及外来抗原入侵的天然屏障[10]。作为肠黏膜免疫系统的关键效应细胞,当有病原微生物入侵时,γδT 细胞不受MHC 限制,无需经过抗原提成细胞处理,即可迅速活化和增殖,直接识别入侵微生物的表面抗原,从而发挥杀伤性T 细胞的作用,介导肠道免疫反应[11]。但若免疫应答过强,导致大量炎症细胞和炎性细胞因子在肠道局部积聚,则会造成结肠黏膜损伤,诱发肠道炎症。研究发现,UC患者肠黏膜中γδT细胞的表达量较正常人群明显升高,且其细胞数量与疾病严重程度相关[12]。本研究发现,UC小鼠γδT细胞明显升高,而联合组治疗1 周后,γδT 细胞明显降低,提示其治疗UC 的作用机制可能与γδT细胞介导的肠黏膜免疫应答有关。
CD4+T 细胞是人体内主要的T 细胞之一,根据其分泌的细胞因子及介导的功能,又可分为Th1、Th2、Th17、Treg等亚群。CD4+T细胞与炎症性肠病的发生发展密切相关。研究发现,炎症性肠病患者肠道CD4+T细胞浸润明显,且分泌大量的促炎因子IFN-γ[13],从而促进肠道炎症的发生。γδT细胞是固有免疫和适应性免疫之间的桥梁,γδT 细胞具有抗原提呈细胞的功能,如Vδ2γδT 细胞激活后能够将抗原呈递给CD4+T细胞、CD8+T细胞,诱导两者的增殖分化[14]。CD4+T 细胞的增殖活化同时受到Toll 样受体(Toll-like receptor,TLR)调节,TLR 主要参与病原微生物产物的识别[15],其中TLR2 主要识别革兰氏阳性菌的肤聚糖,是沟通肠道菌群与机体免疫的主要媒介。研究发现,UC 患者肠黏膜的TLR2较正常组明显增强,而当TLR2被激活后,CD4+T 细胞增殖加快,诱导IL-6 及IL-17等促炎因子的表达,促进肠道炎症的发生发展[16-17]。本研究发现,模型组小鼠CD4+T 细胞含量及结肠TLR2 mRNA表达明显升高;经过1周的治疗后,联合组小鼠CD4+T 细胞、结肠TLR2 mRNA 表达明显降低。
sIgA 是肠黏膜上的主要免疫球蛋白,肠道黏膜上的第一道防线,对各种内源共生菌及外源入侵的病原体都有抵抗作用。CD4+T 辅助细胞可调节B细胞发育为成熟浆细胞,从而产生sIgA,并由聚合免疫球蛋白受体(pIgR)从黏膜上皮细胞的基底表面转移到顶端表面,进而与肠道菌群形成串扰,维持肠道稳态。而当sIgA 产生减少或分泌障碍时,肠黏膜免疫屏障受损,促进炎症性肠病的发展。本研究采用清肠温中方联合应用粪菌移植作为协同干预手段,可使结肠pIgR mRNA、结肠sIgA表达较模型组明显升高。
综上所述,清肠温中方联合粪菌移植能够有效抑制UC 小鼠肠道炎症,促进黏膜修复,其机制可能与调控γδT 细胞及其介导的肠黏膜免疫应答有关,本次研究为临床中西医结合治疗UC 提供了新的科学依据。

