基于网络药理学探讨“山药-杜仲”药对治疗骨质疏松症的作用机制*
郭 超,张兴彩,王卫国,刘晓晨,吕文学,蔡余力△
1 山东中医药大学,山东 济南 250355; 2 山东中医药大学附属医院,山东 济南 250014
骨质疏松症(osteoporosis,OP)是一种常见的全身性代谢性骨病[1]。流行病学调查显示,随着中国人口老龄化的加剧,罹患OP 的患者人数不断增加,绝经后妇女尤为突出,由骨质疏松导致的骨折例次也在不断上涨,OP 已成为我国老年人面临的重要健康问题[2]。基于中国传统医学理论体系,OP 按其症状表现和致病机理应归属“骨萎”“骨枯”“骨痹”等范畴。《素问·痿论篇》中指出:“肾主身之骨髓……肾气热,则腰脊不举,骨枯而髓减,发为骨痿”,可见肾气的充盈与否,是OP 发病的重要因素[3]。《黄帝内经》云:“谷入气满,泽注入骨,骨属屈伸”,说明脾气充盛,运化水谷,充髓养骨。若脾气不足,运化乏力,亦可以导致筋肉骨骼失养而发为骨质疏松[4]。故治疗OP当以补肾健脾为主。全国名中医药专家曹贻训教授结合多年临床经验采用“益肾健脾法”治疗OP 临床疗效显著,尤以山药、杜仲最为常用,且用量较大。山药为健脾要药,具有补中益气,滋肾益肺等功效。《本草经》云:“山药气温平,味甘,无毒,主伤中……益气力,长肌肉;杜仲味辛平,主腰脊痛,补中,益精气[5]。杜仲为补肾强骨要药,能补肝肾,强筋骨。补肾健脾中药配伍应用,符合益肾健脾治疗原则,在临床中常常取得良好疗效[6-8]。
网络药理学是一种基于基因组学和蛋白组学的新兴科研方法。它通过网络数据库检索,高通量组学数据分析等技术,揭示“药物-基因-靶点-疾病”的关系网络,通过关系网络预测中药潜在药理作用及分子机制,评估药物疗效及副作用等[9]。本研究运用网络药理学方法,探究益肾健脾药对“山药-杜仲”药对在抗骨质疏松中的作用机制,为进一步探索益肾健脾法治疗OP提供研究思路和理论依据。
1 资料与方法
1.1 杜仲、山药活性成分的获取与筛选在TCMSP 数据库(http://tcmspw.com/tcmsp.php)中分别以“山药”“杜仲”为关键词进行检索,获得山药、杜仲的成分信息,以OB≥30%及DL≥0.18 为条件进行筛选,获取山药、杜仲的活性成分。
1.2 山药、杜仲活性成分靶点预测与活性成分-靶点网络构建通过TCMSP 数据库搜寻山药-杜仲活性成分的潜在作用靶点,并通过Uniprot 数据库(http://www.uniprot.org /)将作用靶点进行规范,剔除非人源、重复靶点,转化为基因靶点。并将基因靶点与对应活性成分输入“Cytoscape 3.7.2”,构建山药、杜仲“活性成分-靶点”网络。
1.3 OP 靶点的获取与收集在GeneCards 数据库(https://www.genecards.org/)检索OP关键词“Osteoporosis”获取靶点信息,根据靶点信息的Score值,筛选出与OP联系紧密的关键疾病靶点。
1.4 山药、杜仲与OP 共同靶点筛选与蛋白互作网络构建为明确山药-杜仲活性成分靶点与OP靶点之间的联系,将获取的靶点进行对比后,取两者交集,绘制Venn 图。将交集靶点导入STRING 11.0 数据库(http://string-db.org),物种限定为“Homo sapiens”,构建“药物-疾病”关键靶点蛋白互作网络(key target protein protein interactions,PPI)。同时将PPI 网络导入“Cytoscape 3.7.2”,对关键作用靶点进行分析。
1.5 GO 和KEGG 富集分析将药物-疾病相互作用的关键靶点信息上传至Metascape(http://metascape.org)平台,分别选定对关键基因所涉的生物进程(biological processes,BP)、分子功能(molecular function,MF)、细胞成分(cellular components,CC)和京东基因与基因组全书(Kyoto enlyclopedia of genes and genomes,KEGG)通路富集分析。
2 结果
2.1 山药、杜仲活性成分的收集及网络构建经TCMSP 数据库在线检索得到山药的化学成分71个,杜仲化学成分147 个。通过ADME 参数筛选后得到山药的活性成分16 个,杜仲活性成分28 个。剔除无作用靶点的活性成分,最终得到山药-杜仲活性成分共38 个(山药活性成分12 个,杜仲活性成分26 个,无重复活性成分),见表1。将基因靶点与对应活性成分输入“Cytoscape 3.7.2”,构建山药、杜仲“活性成分-靶点”网络。见图1。

图1 “山药—杜仲”药对成分靶点网络图

表1 “山药—杜仲”药对主要成分
2.2 山药-杜仲活性成分抗OP 的潜在作用靶点预测在TCMSP 数据库中收集“2.1”项中山药-杜仲的活性成分所对应的靶点蛋白,剔除无效和重复的靶点后,得到山药-杜仲的活性成分作用靶点共225 个。通过GeneCards 数据库检索OP 的作用靶点,共得到OP 的作用靶点4315 个,根据Score 值大于中位数筛选出关键基因1376 个。利用维恩图在线绘制平台制作维恩图。见图2。
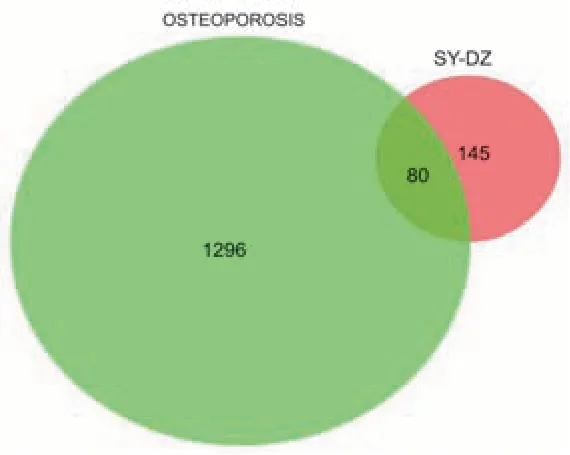
图2 “山药—杜仲”药对活性成分靶点与OP靶点Venn图
2.3 药物-疾病关键靶点PPI 构建将关键交集靶点基因80 个导入至STRING 平台构建PPI,获得PPI网络共有80个节点、1250条边,将该网络各节点信息上传至“Cytoscape 3.7.2”,进行PPI 网络加工制作,见图3。根据各节点Degree 值、紧密度、介度等信息,查阅相关文献进一步分析各节点与OP 的关联程度。其中与OP 关联程度较高的靶点主要有白蛋白(albumin,ALB)、白细胞介素6(interleukin-6,IL-6)、腺苷酸激酶同工酶1(ATK1)、血管内皮生长因子(vascular endothelial growth factor,VEGFA)、抑癌基因p53(tumor suppressor gene p53,TP53)、肿瘤坏死因子(tumor necrosis factor,TNF)、基质金属蛋白酶9(matrix metalloproteinase-9,MMP-9)、雌激素受体1(estrogen receptor 1,ESR1)等。

图3 “山药—杜仲”药对作用于OP靶点的PPI网络图
2.4 GO 和KEGG 富集分析结果应用Metascape数据库将筛选出的山药-杜仲药对与OP交集的80个关键靶点进行GO 和KEGG 分析,80 个关键靶点共涉及5030 个生物进程,564 个分子功能,392 个细胞成分,富集在422条通路上(P<0.01)。根据P值大小排列,分别选取BP、MF、CC前20位的进行分析。其中生物过程主要涉及细胞增殖的负调控、凋亡信号通路、细胞分化的负调控、对脂多糖的反应等。分子功能主要涉及:受体调节活性、转录因子结合 、蛋白酶结合、RNA聚合酶Ⅱ转录因子结合等。细胞成分主要包括细胞外基质、细胞质核周区域、内吞小泡、质网腔、核膜。见图4—6。KEGG通路分析显示,关键靶点富集在与骨质疏松相关的重要通路主要涉及糖尿病并发症中的AGE-RAGE信号通路、低氧诱导因子1(hypoxia inducible factor-1,HIF-1)信号通路、T 细胞受体信号通路、p53 信号通路、TGF-β信号通路等,选取P值前20的通路进行分析,绘制高级气泡图,见图7。

图4 “山药—杜仲”药对作用于OP关键靶点的GO生物学过程分析

图5 “山药—杜仲”药对作用于OP关键靶点的GO分子功能分析

图6 “山药—杜仲”药对作用于OP关键靶点的GO细胞成分分析

图7 “山药—杜仲”药对作用于OP关键靶点的KEGG分析气泡图
3 讨论
OP 作为发病因素多样的慢性全身代谢性骨病,其病理机制复杂,好发于老年人,尤以绝经后妇女常见,增加了老年人骨折的风险[10]。目前抗OP 的一线药物主要是双膦酸盐类药物,这类药物能够抑制骨的过度吸收,达到抗OP 的目的,但副作用较大[11-12]。《黄帝内经》中指出:“脾胃强健,饮食水谷……充养骨髓;反之,脾胃虚弱……无以充养后天之精,势必精亏髓枯而百骸萎废”,说明OP的发生多责之于肾亏脾虚。曹贻训教授在“益肾健脾法”的理论指导下,以大剂量“山药-杜仲”为主药治疗OP,疗效显著。
本研究在相关数据库搜索及查阅文献,共获得“山药-杜仲”药对存在明确作用靶点的活性成分有薯蓣皂苷元、花旗松素、槲皮素、山柰酚等38个。研究表明,山药中的薯蓣皂苷元可促进成骨细胞增殖、分化及抑制破骨细胞形成,减缓骨质疏松的进展[14]。花旗松素具有良好的抗氧化、抑制细胞焦亡、抗炎作用,且能抑制破骨细胞活性并降低破骨细胞特异性基因的表达[15-16]。研究表明,杜仲提取物可显著抑制去卵巢大鼠骨质疏松模型、骨密度的降低及骨微结构的改变[13]。槲皮素和山柰酚是杜仲的主要成分,山柰酚是一种存在于植物中的膳食生物类黄酮,有广泛的药用特性。WONG 等[17]发现,山柰酚可以抑制脂肪生成、炎症、氧化应激、破骨细胞自噬和成骨细胞凋亡,同时激活成骨细胞自噬,实现骨保护。此外,YUAN 等[18]发现槲皮素可以促进骨髓间充质干细胞(bone marrow mesenchymal stem cells,MSCs)增殖和成骨分化,并保护MSCs 免受TNF-α 诱导的成骨损伤,从而显著改善VOX大鼠OP。
PPI 网络显示山药-杜仲药对作用于OP 的关键靶点有ALB、IL-6、ATK1、VEGFA、MMP9、TP53、ESR1等,ALB和IL-6是介导炎性反应的重要成分,可加速骨质疏松进程[19-20]。MUKHERJEE 等[21]研究发现,ATK1是成骨细胞分化的负调节因子,且ATK1在成骨细胞偶联破骨细胞生成的过程中,具有强阳性介质的独特作用,因此ATK1 的抑制能够明显的增加骨重塑,有效控制OP。MMP-9 是属于MMPs 家族的一类依赖锌离子来水解胞外基质的蛋白水解酶,在骨质疏松中发挥着重要作用。研究发现,破骨细胞中MMP-9的基因表达度较高,应用MMP-9合成抑制类药物,可以有效抑制破骨细胞的吸收[22-23]。雌激素缺乏引起的绝经后OP是最常见的骨质疏松类型,雌激素受体主要有两种结构相似的亚型,即ESR1 和ESR2。研究证明ESR1 有与髋部骨密度呈显著相关性的基因位点,且具有遗传倾向,运用ESR 调节剂可有效增高PMOP 患者的骨密度,降低骨折风险[24-26]。此外,TP53、VEGFA 也通过基因的多态性表达影响OP的发生[27-28]。结合相关文献及蛋白互作网络发现,药物作用于疾病的靶点集中在炎症反应、成骨-破骨的动态偶联和人体内分泌稳态等方面,与OP的发病因素的多样化一致。
KEGG 分析可见,“山药-杜仲”药对作用于OP的通路主要包括AGE-RAGE信号通路、T细胞受体信号通路、p53信号通路、TGF-β信号通路、HIF-1信号通路等。研究表明,AGE-RAGE 信号通路在骨质疏松的治疗中起着关键作用[29-30]。HIF-1α 是HIF-1信号通路的主要激活蛋白,且具有促进破骨细胞形成、增强破骨细胞活性的作用[31]。此外,p53 信号通路、TGF-β信号通路、T细胞受体信号通路都是作用于OP 的重要通路,能够刺激P53、TGF-β等调节因子的释放,加重骨质疏松的发展[27,32]。
综上所述,益肾健脾药对“山药-杜仲”可能参与细胞的增殖、分化、凋亡等生物进程,通过细胞因子的生成与释放、调节相关基因转录等方面发挥作用,调节AGE-RAGE 信号通路、HIF-1 等信号通路关键基因的表达对OP 可以起到治疗作用,进一步揭示益肾健脾药对“山药-杜仲”与骨质疏松之间“多成分-多靶点-多通路”的作用。

