基于数据库挖掘分析PDZK1与乳腺癌氟维司群耐药的相关性*
王雪凯 张博雅 李星宇 陈桂来 尹立 向卓 王强,
(1.中国海洋大学医药学院,山东 青岛 266000;2.山东省第二人民医院肿瘤内科,山东 济南 250000)
内分泌治疗主要通过抑制雌激素的生成或雌激素受体阳性的功能发挥作用,是雌激素受体阳性(Estrogen receptor positive,ER+)乳腺癌患者主要的治疗方法之一[1]。其中以氟维司群(Fulvestrant)为代表的选择性雌激素受体下调剂,具有阻断和降解雌激素受体α(Estrogen receptor α,ERα)的功效。氟维司群的主要作用机制是通过药物分子的长侧链阻止ERα蛋白H12的闭合,导致受体疏水表面暴露,诱导ERα通过泛素-蛋白酶体系统降解[2-3]。常用于ERα突变导致的他莫昔芬或芳香化酶抑制剂耐药的二线治疗。两项III期临床试验[4-5]的数据表明氟维司群对他莫昔芬耐药的晚期乳腺癌患者与阿那曲唑具有相同功效。其在2017年被欧盟委员会(European Commission)批准用于未接受过内分泌治疗的ER+局部晚期或转移性乳腺癌绝经后妇女的一线疗法。但伴随患者长期的药物治疗,ER配体的非依赖性激活,细胞周期调节蛋白异常表达或miRNA的上调等途径限制了氟维司群治疗获益[6-9]。因此,探索诱导氟维司群耐药机理对临床治疗具有重要的指导意义。
1 材料与方法
1.1 材料与试剂 qPCR预混液(上海翌圣生物科技股份有限公司,中国);DMEM高糖培养基(Gibco公司,美国);FBS特级胎牛血清(BI公司,以色列);无酚红培养基(武汉普诺赛生命科技有限公司,中国);碳吸附胎牛血清(BI公司,以色列);BCA蛋白定量试剂盒(上海雅酶生物医药科技有限公司,中国);ECL基础型化学发光检测试剂盒(上海雅酶生物医药科技有限公司,中国);硝酸纤维素膜(Pall公司,美国);RIPA裂解液(上海碧云天生物技术有限公司,中国);β-actin抗体(Sigma公司,美国);PDZ结构域蛋白1(PDZ domain containing 1,PDZK1)抗体(Santa公司,美国);PDZK1慢病毒质粒(上海汉恒生物科技有限公司,中国);氟维司群(MCE公司,美国);雌二醇(Selleck公司,美国);96孔板(Corning公司,美国)。
1.2 仪器与设备 低温高速离心机(Eppendorf公司,德国);荧光定量PCR(Eppendorf公司,德国);垂直电泳系统(北京六一生物科技有限公司,中国);转印电泳仪(北京六一生物科技有限公司,中国);二氧化碳培养箱(Thermo公司,美国)。
1.3 实验方法
1.3.1 文章研究流程 从GEO数据库中筛选到两组氟维司群耐药数据集,获得与氟维司群耐药相关的差异基因,通过STRING绘制差异基因的蛋白网络互作图(PPI),提取关键的差异基因。在TCGA数据库中分析排名第一的关键基因PDZK1的表达意义。最终通过体外细胞实验验证PDZK1的表达是否影响氟维司群的治疗效果,并在Kaplan-Meier Plotter临床数据库中分析PDZK1的表达与临床预后的相关性。
1.3.2 原始数据的获取与处理 从GEO数据库(https://www.ncbi.nlm.nih.gov/geo/)中获取耐药数据集(GSE74391与GSE14986),亲代细胞均为MCF-7细胞,氟维司群耐药系至少用药物长期处理6个月。通过GEO在线工具获取两组耐药数据集的差异基因(|Log2FC|>1, FDR<0.05),韦恩图获取差异基因交集(|Log2FC|>2, FDR<0.05)。TCGA乳腺癌的基因表达矩阵与临床数据来自TCGA数据库官网(https://portal.gdc.cancer.gov/),根据乳腺癌分子分型,提取数据库中ER+患者数据集,并根据PDZK1表达中间值分为高低表达组进行分析。
1.3.3 蛋白PPI网络分析 差异基因导入至STRING网站(http://string-db.org),绘制差异基因的蛋白互作网络图(交互置信度≥0.400),并删去独立的蛋白节点。将数据导入Cytoscape 软件进行可视化处理,Cytohubba插件对蛋白网络进行打分,排名前5名的基因被视作关键的节点基因。
1.3.4 功能富集分析 “clusterProfilerR”包用于(Gene ontology, GO)功能注释和京都基因与基因组百科全书(Kyoto Encyclopedia of Genes and Geno-mes, KEGG)功能富集分析(q<0.05)。“clusterProfilerR”与“org.Hs.eg.db”包用于基因集富集分析(Gene Set Enrichment Analysis,GSEA),GO功能注释分别在生物过程(Biological process)、细胞组分(Cellular component)和分子功能(Molecular function)展示了排名前10的通路名称,KEGG与GSEA分别展示了排名前30与排名前5的通路名称。
1.3.5 临床数据分析 Kaplan-Meier Plotter在线网站获取乳腺癌基因芯片数据(http://kmplot.com/analysis/index.phpp=background),并将患者范围设定为经过内分泌治疗的ER+群体,分析PDZK1与患者总生存期(Overall survival,OS)、无复发生存期(Recurrence-Free survival,RFS)和远处无转移生存期(Distant metastasis-free survival,DMFS)的相关性。
1.3.6 细胞培养与增殖实验 MCF-7用含10%胎牛血清的DMEM高糖培养基培养,所有细胞均置于37 ℃、5% CO2浓度的培养箱中培养,通过显微镜观察细胞生长情况(细胞密度和细胞状态),两天传代一次。细胞增殖实验,细胞置于无酚红含10%胎牛血清与1 nM雌二醇的DMEM中培养3 d,按照3000个每孔均匀铺至96孔板。待细胞贴壁,加入无酚红含10%胎牛血清与1 nM雌二醇的DMEM以及不同浓度的氟维司群,每组设置5个复孔作为平行实验,每两天换液一次。第5 d每孔加10 μL CCK-8溶液,37 ℃孵育60 min, 450 nm波长下测量吸光度值。
1.3.7 实时荧光定量PCR 收集细胞样品,Trizol法提取细胞总RNA,测量mRNA浓度,反转录合成cDNA,加入qPCR预混液配制10 μL定量体系,检测PDZK1的mRNA表达量。引物序列如下:GAPDH上游5-GTCTCCTC-TGACTTCAACAGCG-3,下游5-ACCACCCTGTTGCTGTAGCCAA-3;PDZ-K1上游5-AAGGTGTGGCTATGAGAGCTGG-3,下游5-CAGCAGGAACAT-GACACGGCTT-3。
1.3.8 蛋白质免疫印迹 收集细胞样品,加入RIPA裂解缓冲液,4 ℃, 12 000 rpm离心10 min,收集上清,BCA法测定蛋白浓度。制备10%, SDS-PAGE凝胶,上样电泳分离,转膜,5%脱脂牛奶封闭1 h,TBST洗膜三次,一抗4 ℃孵育过夜,TBST洗膜三次,加入相对应二抗,室温继续孵育1 h,TBST洗膜,ECL显色。
2 结果
2.1 获取耐药数据集的关键基因 GEO数据库上筛选氟维司群耐药数据集GSE74391与GSE14986,利用GEO在线工具分析氟维司群敏感型MCF-7与耐药型MCF-7的差异基因,火山图展示差异基因(见图1A~B)。韦恩图分析差异基因存在14个上调和23个下调的重合基因(见图1C)。GO生物学功能数据分析显示性激素的合成或调控与氟维司群耐药相关(见图1D)。在STRING网站中绘制网络图,结果展示17个具有相互作用的基因,其中11个是下调显著的基因(见图1E)。Cytoscape软件可视化分析排名前五的关键基因结果,分别为PDZK1、GREB1、TFF1、PGR和CDK6(见图1F),提示这些基因可能与氟维司群耐药相关。
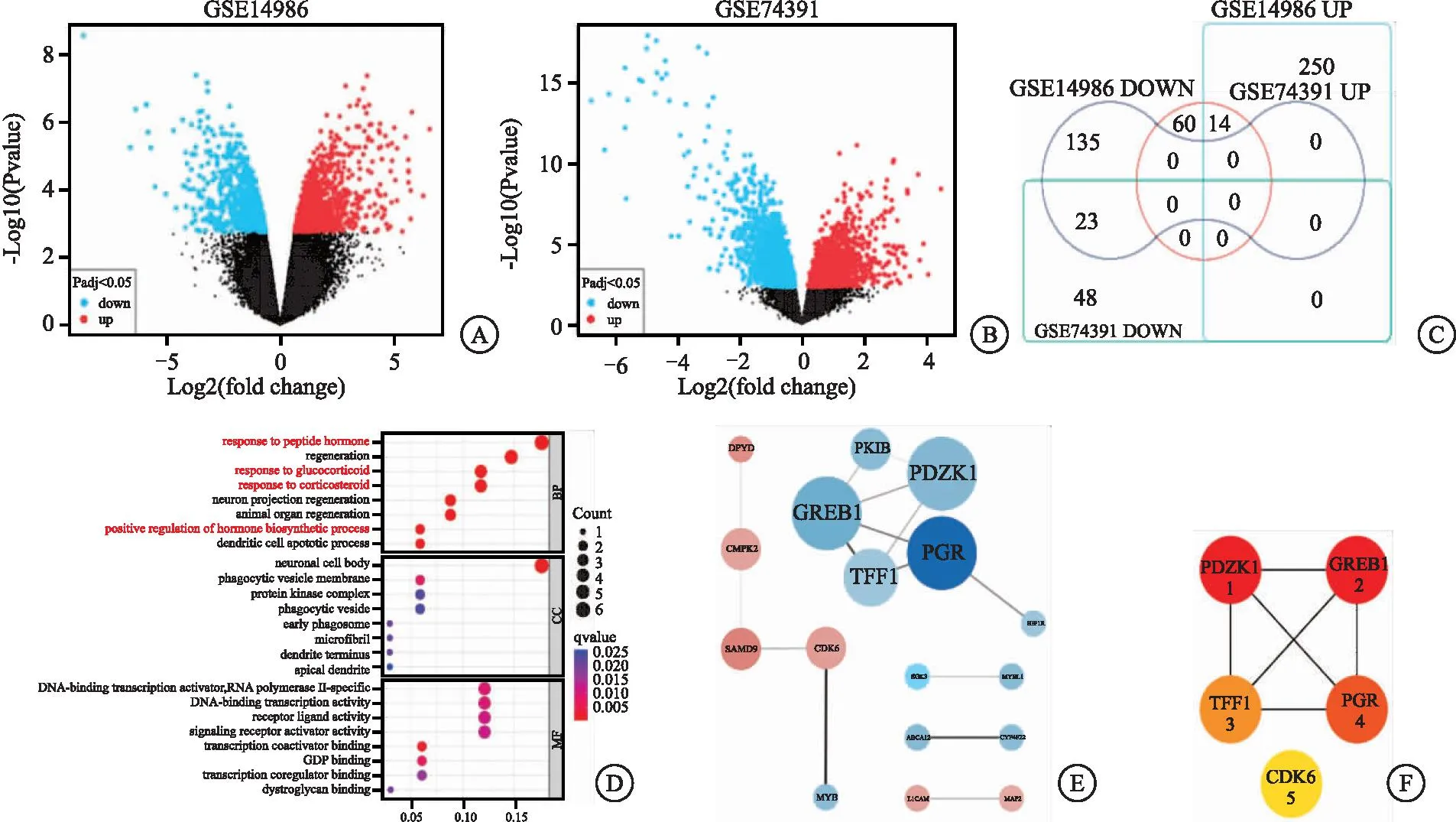
图1 筛选乳腺癌氟维司群耐药相关基因Figure 1 Screening for fulvestrant-resistance related genes注:A、B.差异基因热图,蓝色代表下调显著基因,红色代表上调显著基因;C.韦恩图分析两种数据集显著差异基因的交集;D.GO功能注释,每组分别展示了富集前十的通路名称(q<0.05);E.PPI网络分析,红色代表上调基因,蓝色代表下调基因,节点连线的粗细代表蛋白相关性的强度,圆圈越大代表差异越显著;F.MCC评分,颜色越深代表评分越高。
2.2PDZK1与氟维司群耐药相关性分析 从TCGA数据库提取ER+乳腺癌患者的数据,分析排名第一的PDZK1表达的临床意义。热图分析PDZK1高低表达组的差异基因(|Log2FC|>1, FDR<0.05)(见图2A~B)。差异基因GO功能注释显示富集的生物过程通路主要为内肽酶活性的调节、肽酶活性的调节以及内肽酶活性的负调节、肽酶活性的负调节等(见图2C)。KEGG通路分析相关差异基因直接富集在内分泌耐药通路(见图2D),表明PDZK1的差异表达直接或间接影响内分泌治疗效应。GSEA分析表明与PDZK1低表达相关的差异基因主要富集在药物代谢细胞色素P450通路,见图2E。
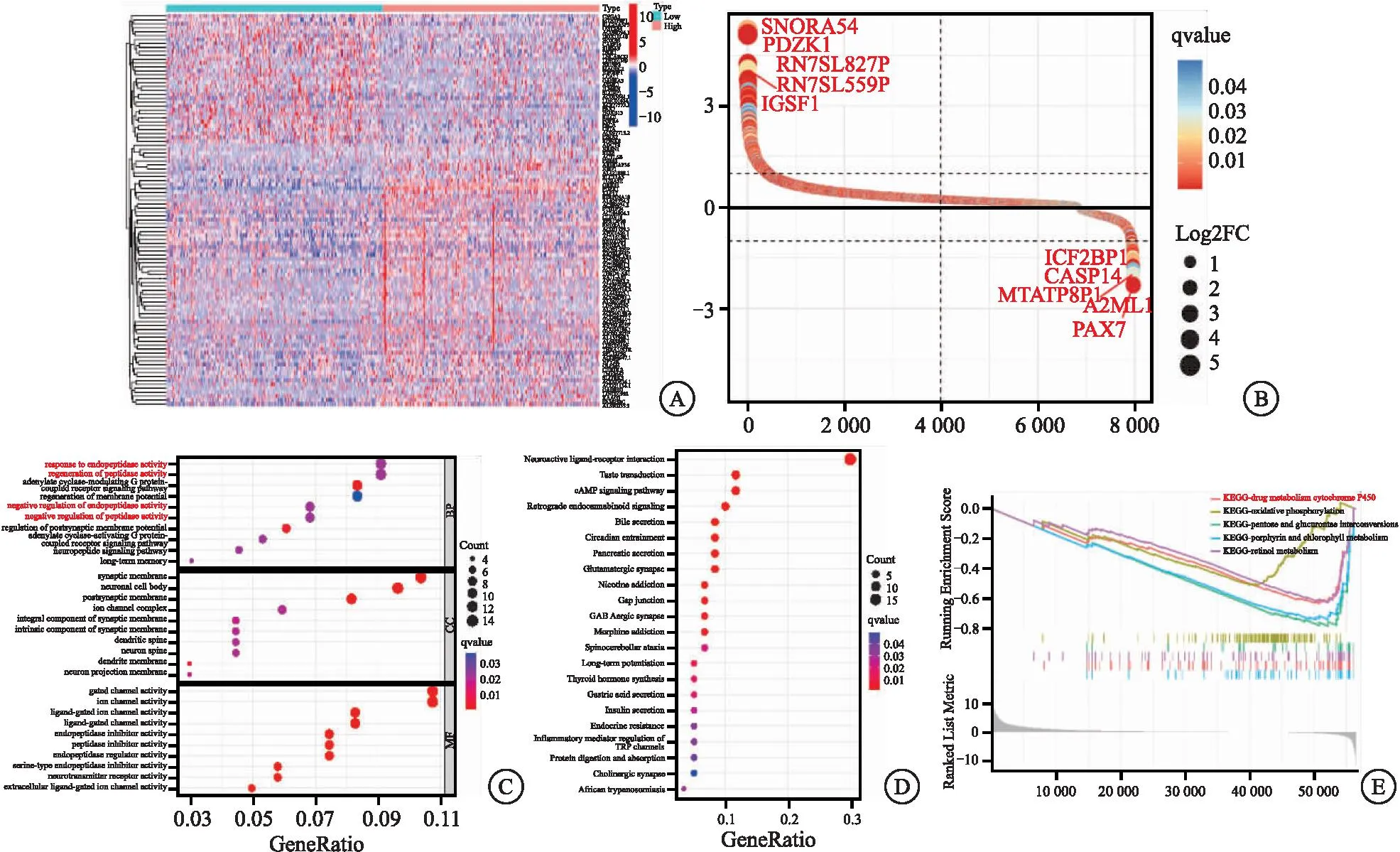
图2 PDZK1的高低表达与乳腺癌氟维司群耐药的相关性分析Figure 2 Analysis of PDZK1 expression and fulvestrant resistance in breast cancer注:A.热图(q<0.05);B.差异基因图,图片展示了排名前5的差异基因;C.GO功能注释,每组分别展示了富集前10的通路名称(q<0.05);D.KEGG通路分析,图片展示了差异基因富集在排名前22的通路名称(q<0.05);E.GSEA分析,PDZK1下调基因的KEGG通路分析(q<0.05),图中展示了排名前5的通路名称。
2.3PDZK1表达与临床预后的相关性 TCGA数据库显示PDZK1高表达与肿瘤临床分期呈显著负相关(见图3A)。Kaplan-Meier Plotter在线网站分析内分泌治疗的ER+乳腺癌群体。结果显示,PDZK1高表达组的患者OS、RFS和DMFS均优于PDZK1低表达组(P<0.05),见图3B~D。
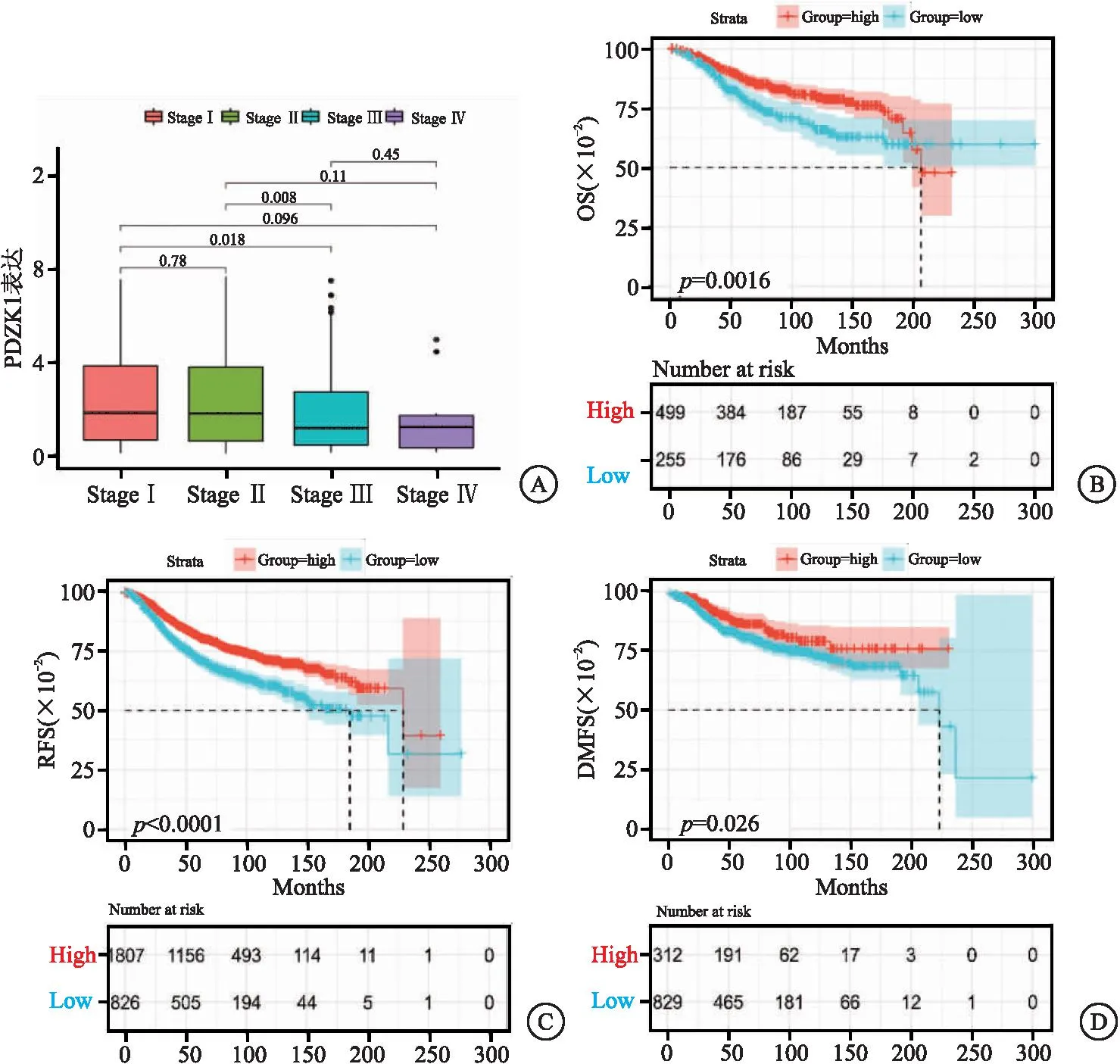
图3 PDZK1表达与ER+乳腺癌患者临床预后良好显著相关Figure 3 PDZK1 expression and clinical prognosis of ER+ breast cancer patients注:A.TCGA ER+患者中分析肿瘤分级与PDZK1表达的关系;B~D. Kaplan-Meier在线分析OS、RFS、DMFS与PDZK1表达的相关性。
2.4PDZK1的表达促进氟维司群治疗敏感性 利用慢病毒构建了过表达PDZK1的MCF-7细胞(见图4A~B)。通过细胞增殖实验检测氟维司群对PDZK1过表达组细胞增殖的影响。结果显示, 与对照组相比,PDZK1过表达显著提升了氟维司群对MCF-7细胞增殖抑制的作用,见图4C。
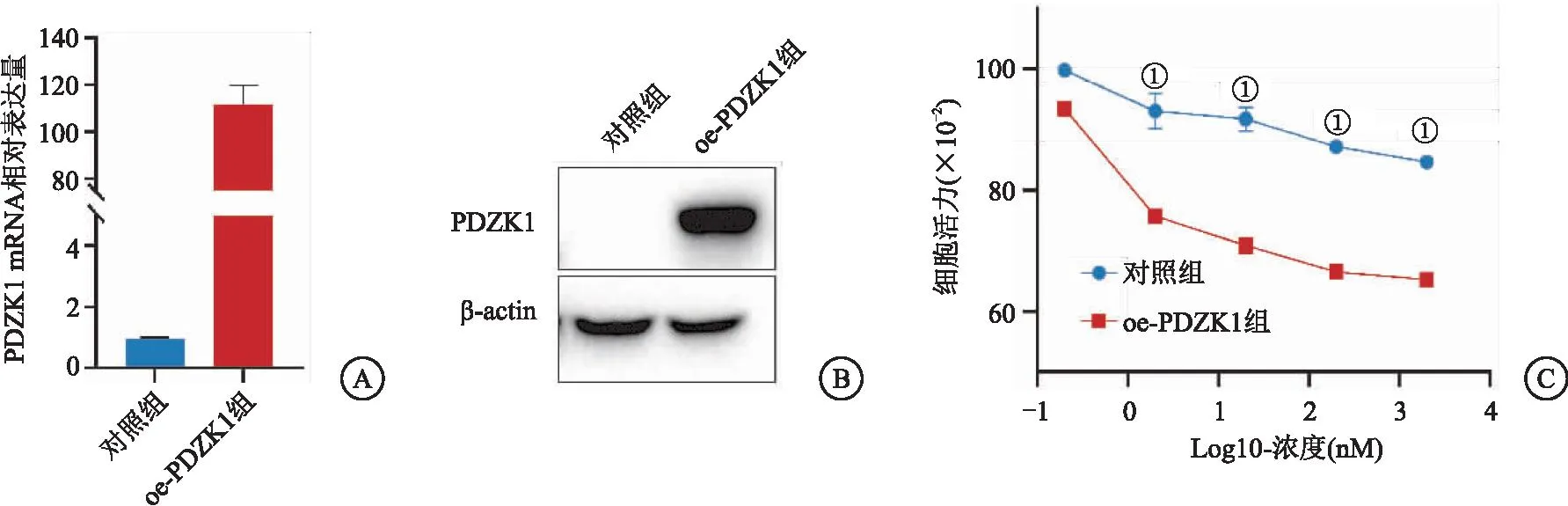
图4 PDZK1的表达促进氟维司群治疗敏感性Figure 4 PDZK1 expression promotes therapeutic sensitivity of fulvestrant注:A.PDZK1过表达的mRNA定量检测;B. PDZK1过表达的蛋白结果;C.检测氟维司群处理4 d后的细胞活力,对照组加千分之一的DMSO溶液;与OC-PDZK1组比较,①P<0.05。
3 讨论
目前,氟维司群是唯一上市的选择性雌激素受体下调剂,2017 年经美国食品药品监督管理局(FDA)批准用于未接受过内分泌治疗的ER+局部晚期或转移性绝经后乳腺癌患者,成为内分泌治疗的一线选择。中国抗癌协会乳腺癌诊治指南与规范2021版[10]推荐氟维司群作为绝经后复发转移性乳腺癌的首选药物。伴随着氟维司群在临床上的广泛应用,部分患者由于先天性或继发性内分泌抵抗限制了其治疗获益。研究[11-13]表明,ER信号传导的下调,雌激素非依赖性生长、细胞分裂蛋白激酶6(CDK6)的高表达和雌激素受体的突变等是氟维司群耐药的重要机制。因此本研究通过对氟维司群耐药细胞数据集的挖掘,筛选出氟维司群耐药的关键基因,包括PDZK1、GREB1、PGR、TFF1和CDK6,分析出PDZK1在氟维司群耐药中的重要作用。既往研究[11, 14]证明GREB1和CDK6与内分泌抵抗相关。此外利用在线乳腺癌数据库,我们发现PDZK1的高表达是内分泌治疗患者的有益因素。体外实验阐明PDZK1高表达有助于提升氟维司群治疗的敏感度。
PDZK1也称为Na(+)/H(+)交换调节因子(NHERF3),是由Kocher等[15]鉴定发现的一种含有四个PDZ相互作用结构域的63 kDa接头蛋白,主要在肝、肾和小肠的上皮细胞和内皮细胞中表达。PDZ结构域包含大约90个氨基酸和一个3级褶皱,包括六个β链(β1-β6)和两个α螺旋(α1和α2)。PDZ结构域的蛋白在调节蛋白质的运输、信号的转导、细胞-细胞的连接、细胞的极性和粘附性等发挥着重要的功能,特别是作为从膜内在蛋白到细胞内信号传导的介质[16]。此外,PDZ结构域还是极其重要的抑制剂开发靶点,涵盖神经类疾病,癌症和病毒感染等方面[17]。PDZK1/NHERF3与离子转运蛋白和多种GPCR(G蛋白偶联受体)相互作用[18]。比如,PDZK1增加人前列环素受体(Human prostacyclin receptor,hIPR)在细胞表面的功能表达,增强配体结合和环前列素诱导的环磷酸腺苷(cAMP)生成,诱导内皮迁移和血管生成[19]或与生长抑素受体(Somatostatin receptor,SSTRs)[20]、促肾上腺皮质激素释放因子受体(1CRFR1)和5-羟色胺2A受体(5-HT2AR)等相互作用[21]。PDZK1同样参与肿瘤的发生发展,研究[22-23]表明,PDZK1的高表达抑制胃癌或肾细胞癌的增殖。PDZK1还参与乳腺癌的进展,一项临床试验[24-25]证明PDZK1的表达与血浆E2的水平存在相关性,E2刺激PDZK1的表达。但PDZK1与ERα表达水平无相关性,可能通过与EGFR和Src的相互作用影响ERα的功能[26]。
结合既往文献,PDZK1可能从多方面调控内分泌药物的疗效。一方面PDZ结构域相对较小,PDZK1可以与多种药物转运蛋白的C端结合,如小鼠乳腺癌耐药蛋白(Breast cancer resistant protein,BCRP)、寡肽转运蛋白PEPT1和肉碱/有机阳离子转运体OCTN2等,调控药物或离子的膜转运[27]。另一方面,本研究发现PDZK1表达与内肽酶活性调节相关,提示参与ERα的降解途径,并且与药物代谢酶P450通路相关。这些结果提示PDZK1可能通过与药物转运蛋白结合影响氟维司群药物的主动吸收,或调控内肽酶和药物代谢酶的功能,影响药物的降解活性。因此,有必要在后续研究中探寻PDZK1影响氟维司群治疗的主要途径。
本研究中使用的微阵列数据集的样本量相对较小,并缺少氟维司群治疗抵抗患者的临床数据。计划在未来进一步收集氟维司群治疗信息,以便更充分地认识PDZK1在氟维司群耐药中的机制。
4 结论
本研究结果提示,PDZK1表达有助于提升氟维司群治疗的敏感性,对内分泌治疗耐药的机制研究与临床治疗方案选择具有重要的价值。

