PTC-209诱导体外螺旋神经元损伤作用及机制*
朱国霞 罗家胜 张霞婧 吴永翔
(1.西安市人民医院·西安市第四医院耳鼻咽喉头颈外科,陕西 西安 710004;2.西北工业大学医学研究院,陕西 西安 710004; 3.新疆军区总医院耳鼻咽喉头颈外科,新疆 乌鲁木齐 830099)
Bmi1是一种Polycomb group(PcG)蛋白,其参与H2A泛素化相关转录沉默[1],且在很多种肿瘤中异常增高[2]。Bmi1(-/-)小鼠食管癌的辐射敏感性增加,以及细胞活力显著抑制,这可能导致G0/G1期细胞比例增加,并通过抑制PI3K/Akt信号通路导致细胞凋亡[3]。在鼻咽癌CNE2细胞株中通过转染慢病毒重组载体来敲低Bmi1表达可提高细胞的放射敏感性[4]。研究发现Bmi1在同源重组(HR)修复DNA双链断裂中的作用中促进DNA末端切除;机制上,Bmi1通过促进CtIP的募集介导DNA末端切除,从而使RPA和RAD51在DNA损伤部位积累[5]。Bmi1在耳蜗的生理和病理情况也有相关研究。Bmi1通过Wnt信号通路启动新生小鼠耳蜗支持细胞(Supporting cells,SCs)和lgr5阳性祖细胞的增殖程序[6]。在耳蜗螺旋韧带纤维细胞中,D-半乳糖可能是通过降低Bmi1的表达,使Bmi1抑制p16INK4a表达的作用减弱,从而促进纤维细胞的衰老[7]。另外,Bmi1(-/-)小鼠体内体外耳毒药物诱导的毛细胞(Hair cells, HCs)损失显著增加,以及HCs的自由基和线粒体ROS水平明显升高,乙酰半胱氨酸(Acetylcysteine,NAC)可以减轻上述药物所致的损伤[8]。以及在噪声暴露前予低频声预处理可以提高机体内源性抗氧化水平,可一定程度减轻噪声暴露所致的氧化损伤,且Bmi1-SOD参与了这一过程[9]。那么Bmi1在体外耳蜗器官培养SGNs中起到如何的作用,目前尚少相关研究。为此本研究使用Bmi1的特异性抑制剂PTC-209诱发SGNs损伤,进而探讨其可能的调控机制。
1 材料与方法
1.1 实验动物 80只P3新生SD 仔鼠,均购于空军军医大学实验动物中心。动物的领取和使用受到学校实验动物伦理委员会的监督和管理。
1.2 主要试剂 PTC-209(A specific inhibitor of Bmi1)购自美国Selleckchem公司;谷胱甘肽(glutathione, GSH)购自美国Sigma-Aldrich公司;β-Tubulin购自德国Millipore 公司、美国Abcam公司;二抗驴抗鼠IgG H&L购自美国Life technology公司、美国Abcam公司;MitoSOXTMRed mitochondrial superoxide indicator购自美国ThermoFisher Scientific公司;Hoechst 33258 trihydrochloride 购自美国MCE公司。
1.3 耳蜗器官培养方法
1.3.1 制备鼠尾胶 将90 μL 0.02N CH3COOH、(50×) Collagen gel溶液、10 μL 10× Basal Medium Eagle溶液以及10 μL 2% NaHCO3分别加入无菌离心管。在每个培养皿皿底正中滴入混匀的鼠尾胶,静置30 min,待胶凝固后,于鼠尾胶周围加入1 mL无血浆培养基。
1.3.2 SFM培养液制备 牛血清蛋白(Bovine Serum Albumin) 2 g;Serum-free Supplement 2 mL;20%葡萄糖4.8 mL;青霉素G 0.2 g;200 mmol/L 谷氨酰胺2 mL;碳酸氢钠0.2 g;1X BME190.8 mL。
1.3.3 耳蜗基底膜和螺旋神经节的显微解剖 将P3仔鼠用酒精消毒、处死,快速取出耳蜗。无菌生理盐水冲洗后,放置于预冷的Hank′s液中,在解剖显微镜下保留耳蜗基底膜,并于耳蜗底转,从 hook region延耳蜗螺旋方向轻柔分离基底膜和螺旋神经节,并将分离出的耳蜗基底膜和螺旋神经节组织平铺于凝固的胶上。将其放置于培养箱中培养4 h后加入1 mL无血浆培养基,继续培养过夜。次日在倒置显微镜下观察耳蜗器官有无漂浮或者形态变化,选择形态完整以及贴附良好的作为实验组。该培养方法技术成熟,具体步骤据文献[10-11]的研究内容。
1.4 PTC-209诱导体外培养耳蜗器官损伤模型的建立 PTC-209的储存浓度为5 mM,用无血清培养液(Serum-free medium,SFM)分别稀释至10、20、50 μM。取P3仔鼠耳蜗器官,培养箱中培养12 h,每组分别加入对应浓度的PTC-209,分别继续培养24、48、72 h。每个时间段均分为四组,第一组:Ctrl组(培养液仅添加SFM);第二组:10 μM PTC-209组;第三组:20 μM PTC-209组;第四组:50 μM PTC-209组。
1.5 GSH预处理对PTC-209诱导体外培养耳蜗器官损伤的保护模型的建立 经前期的实验验证,PTC-209的最终工作浓度为10 μM,作用时间为48 h。此外,在GSH对PTC-209诱导体外培养耳蜗器官损伤的保护模型,其工作浓度为5 mM。取P3仔鼠耳蜗器官,待耳蜗器官培养稳定后,加入GSH在培养箱中先培养1~24 h不等,再经PTC-209处理后48 h结束培养。实验共分为PTC-209 10 μM组、Pre1 h GSH 5 mM+ PTC-209 10 μM(pre1h)组、Pre2 h GSH 5 mM+ PTC-209 10 μM(pre2 h)组、Pre4 h GSH 5 mM+ PTC-209 10 μM(pre4 h)组、Pre6 h GSH 5 mM+ PTC-209 10 μM(pre6 h)组、Pre8 h GSH 5 mM+ PTC-209 10 μM(pre8 h)组、Pre12 h GSH 5 mM+ PTC-209 10 μM(pre12 h)组、Pre24 h GSH 5 mM+ PTC-209 10 μM(pre24 h)组8组。
1.6 机制研究实验分组 根据前期的预实验,确定损伤模型(PTC-209组),即10μM PTC-209与耳蜗器官共培养48 h;最佳保护模型(GSH+PTC-209组),即Pre6 h 5 mM GSH对10 μM PTC-209培养48 h。故将实验分为Ctrl组、GSH组、PTC-209组及GSH+PTC-209组4组,其中Ctrl组耳蜗器官仅使用培养液SFM,GSH组使用SFM稀释的GSH作为培养液进行培养。PTC-209组、GSH+PTC-209组培养方法同上。培养结束后予MitoSOXRed 进行组织染色,激光共聚焦显微镜观察。
1.7 免疫荧光染色 吸弃培养皿上清,MitoSOX Red mitochondrial superoxide indicator 着染耳蜗活体组织,孵育30 min,0.01 M PBS清洗3次(5 min/次),4%多聚甲醛固定20 min,PBS清洗3次;随后0.5% Triton X-100,37 ℃打孔10 min,PBS清洗3次。尔后5% BSA封闭液室温封闭1 h,遂后滴加合适浓度的一抗β-Tubulin(1:200),置于湿盒内4 ℃过夜。取片后PBS清洗4次。避光加入稀释好的二抗驴抗小鼠IgG H&L(1:200),并将切片置于湿暗盒内4 ℃过夜。次日PBS清洗4次后,避光加入Hoechst 33258(1:1000)室温10 min,PBS清洗4次,甘油封片,激光共聚焦显微镜下观察并摄片。
2 结果
2.1 PTC-209诱导耳蜗螺旋神经元(Spiral ganglion neuronl,SGNs)损伤随浓度增高和时间延长而加重 用标记SGNs和听觉神经纤维(Anditory nervs fibers,ANFs)的β-Tubulin进行免疫荧光检测,结果提示:PTC-209对SGNs和ANFs的损伤作用呈时间和浓度依赖性,当PTC-209低浓度时,如低于20 μM,时间的影响因素对损伤的作用更为显著;当提高PTC-209浓度时,如50 μM,浓度依赖性的作用因素则更为明确。为此,损伤模型(PTC-209)确定为10 μM PTC-209与耳蜗器官共培养48 h。见图1。
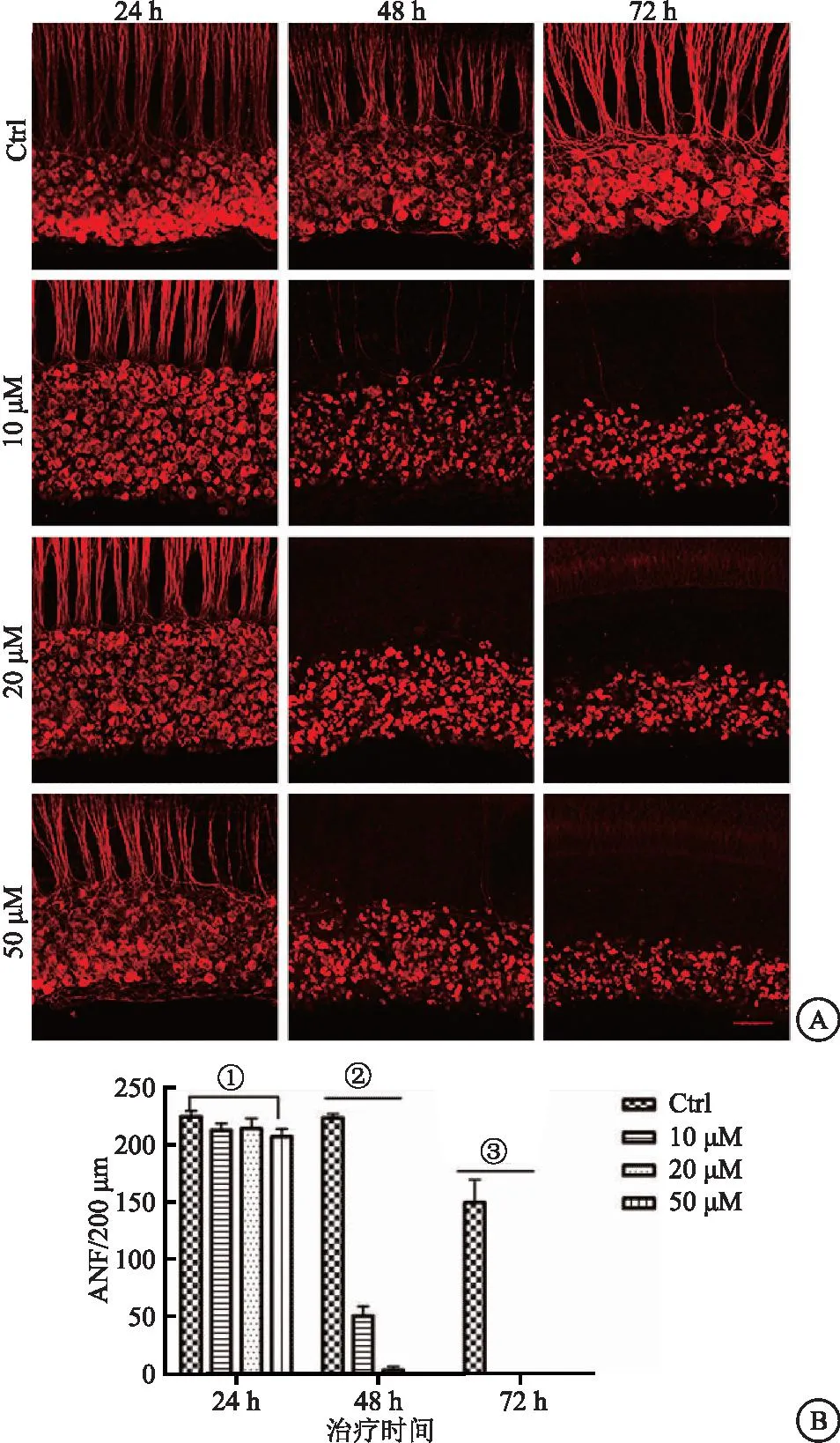
图1 PTC-209在体外对SGNs和ANFs的损伤作用(n=6)Figure 1 The damaging effect induced by PTC-209 on SGNs and ANFs in vitro注:A.耳蜗SGNs和ANFs数量随着PTC-209浓度增加和培养时间延长而逐步减少(比例尺=50 μm); B.PTC-209对耳蜗损伤作用的统计分析。50 μM PTC-209 24 h组与Ctrl组24 h比较,①P<0.05;10、20、50 μM PTC-209 48 h组与Ctrl组48 h比较, ②P<0.01; 10、20、50 μM PTC-209 72 h组与Ctrl组72 h比较, ③P<0.05。
2.2 不同时间预处理GSH对PTC-209诱导耳蜗SGNs损伤存在差异保护作用 前期实验证实10 μM PTC-209 在作用48 h后SGNs有明确损伤,同时在预实验中使用5 mM GSH 预处理体外培养耳蜗器官,发现不同时间预处理GSH对10 μM PTC-209诱导SGNs损伤有不同的保护作用。实验将8组的ANFs进行统计分析,以明确最佳预处理GSH时间。结果提示,Pre 6 h GSH 5 mM+ PTC-209 10 μM组与其余各组ANFs差异均有统计学意义(P<0.01),提示Pre 6 h 5 mM GSH对10μM PTC-209培养48 h诱导SGNs和ANFs的损伤有显著保护作用。见图2。
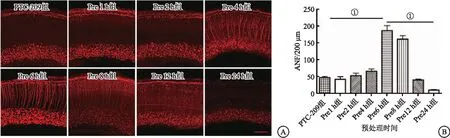
图2 GSH对10μM PTC-209诱导SGNs和ANFs的损伤有保护作用(n=6)Figure 2 Pretreatment with GSH had protective effect on SGNs and ANFs induced by 10μM PTC-209注:A.提前6 h预处理GSH对10 μM PTC-209诱导的损伤呈最佳的保护作用(标尺=100 μm); B.GSH对10 μM PTC-209诱导的损伤保护作用的统计分析。Pre6 h组与其余各组比较,①P<0.01。
2.3 GSH预处理和PTC-209诱导耳蜗SGNs ROS的影响 收集四组耳蜗器官行MitoSOXTMRed染色,其中绿色荧光β-Tubulin标记SGNs和ANFs,蓝色荧光Hoechst标记细胞核。结果提示,Ctrl组、GSH组以及GSH+PTC-209组均未见红色荧光标记的ROS在SGNs和SCs蓄积。PTC-209组红色荧光标记的ROS在该处有大量蓄积。同时对各组ROS的红色荧光光密度值测定并行统计分析,发现PTC-209组和Ctrl组、GSH+PTC-209组ROS的红色荧光光密度值差异均有统计学意义(q=343.5/349.3,P<0.01)。见图3。
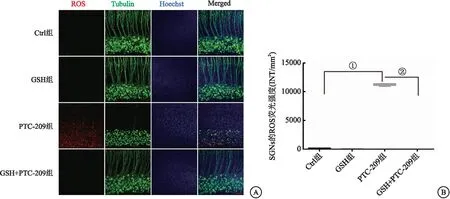
图3 GSH预处理和PTC-209对SGNs和ANFs ROS的影响(n=6)Figure 3 Effects of GSH pretreatment and PTC-209 on ROS in SGNs and ANFs注:A.PTC-209诱导ROS在SGNs和ANFs蓄积,而GSH预处理可明显减轻ROS蓄积(比例尺=50μm); B.各组耳蜗SGNs ROS荧光光密度值测定及分析。PTC-209组与Ctrl组比较, ①P<0.01; PTC-209组与GSH+PTC-209组比较, ②P<0.01。
3 讨论
GSH作为一种广谱抗氧化剂,其生化结构决定其生物学特点。GSH分子结构中半胱氨酸侧基团上巯基可保护细胞内蛋白巯基不被氧化,与自由基结合,加速自由基的清除,减少自由基对机体的氧化损伤,是GSH抗氧化功能的结构基础[12]。研究[13]表明鉴定/发现诱导激活SIRT3或谷胱甘肽还原酶,或者增加线粒体GSH水平的化合物在通过模拟能量限制在人内耳细胞对预防老年性聋的发生。另有研究[14]认为乙酰半胱氨酸通过刺激GSH的产生对顺铂诱导的耳蜗损伤有明确保护作用。这进一步表明氧化还原状态的失衡导致氧化产物的蓄积以及随后发生的生化级联反应在听力损失的发生和发展进程中起着重要作用。在本研究中发现5 mM GSH 在Pre6 h、Pre8 h 预处理10 μM PTC-209 共培养48 h对SGNs和ANFs有显著的保护作用,即预处理时间越小或越大于6~8 h,GSH的保护效应越弱,尚存的SGNs和ANFs就越少。为此,分析可能原因为GSH在培养液中维持较高浓度时,便可抵消部分由PTC-209诱导SGN和ANF损伤产生的自由基和ROS,从而达到最大的保护效应。
回顾文献[8-9]发现Bmi1无论在耳蜗HCs还是在SGNs中,其反应氧化还原状态以及ROS水平。Bmi1(-/-)小鼠耳蜗HCs在体内外对耳毒药物损伤敏感性显著增加,并进一步证实其HCs的自由基和线粒体ROS水平升高导致氧化还原状态失衡,进而促进凋亡的发生[8]。
在大鼠噪声暴露前予低频声预处理可提高SGNs Hsp70、Bmi1、FoXO1以及SOD1/2的表达水平。当在体外培养SGNs中过表达Hsp70时,可进一步提高上述分子表达水平、降低ROS蓄积,因此初步证实Hsp70/Bmi1-FoxO1-SOD参与声预处理提高机体内源性抗氧化能力的这一过程[9]。本研究中10 μM PTC-209与体外耳蜗器官共培养48 h后,SGNs和ANFs有明显损伤作用。随后研究对各组的耳蜗器官进行MitoSOX Red染色,发现PTC-209组SGNs和SCs可见大量ROS蓄积,GSH+PTC-209组均未见ROS蓄积。因此推测,PTC-209作为Bmi1的特异性抑制剂,可能通过抑制Bmi1的表达,促进了耳蜗器官局部的氧化还原状态失衡的发生,进而引发SGNs和ANFs的死亡。
Bmi1作为Polycomb群蛋白之一,是抑制基因表达的表观遗传因子,其因促进细胞增殖和减少凋亡参与多种肿瘤的发生,在生物网络受多种分子和信号通路的调控,其中与PI3K/Akt关系密切。研究[15]发现阻断PI3K/Akt信号通路增加噪声引起的暂时性阈移的敏感性,内源性PI3K/Akt信号通路被认为是内耳内在的保护机制。另外,Bmi1通过PTEN-PI3K/Akt-mTOR 信号通路促进缺血性心力衰竭的心肌纤维化[16]。在骨肉瘤细胞中过表达Bmi1时可通过增加PI3K/AKT活性来提高其对顺铂的耐药性[17]。在急性髓系白血病中,缺氧暴露通过激活HIF-1α/BMI-1信号通路调控白血病干细胞,进而调控PI3K/Akt信号通路和促进上皮-间质转化的进程[18]。MiR-15通过PI3K/Akt信号通路靶向调控Bmi1进而抑制膀胱癌细胞进展[19]。研究[20]显示Bmi1通过调控PHLPP(PH结构域和富含亮氨酸的重复蛋白磷酸酶)表达水平来影响AKT的磷酸化水平,即Bmi1缺失导致PHLPP1和PHLPP2表达增加,pAKT水平降低。
4 小结与展望
PTC-209和耳蜗器官共培养后发现SGNs和SCs中自由基和ROS大量蓄积,促进SGNs和ANFs死亡的发生,但是调控机制尚不明确。在后续研究中,将进一步检测PI3K/Ak的底物p85α、p-Akt (S473)等表达水平,以及使用PI3K/Akt特异性抑制剂LY294002,深入探索PI3K/Akt信号通路是否参与调控这一过程。

