miR-126-3p.1通过SLC7A5调控间变性甲状腺癌细胞糖酵解的作用机制*
丁雯钰 高杨丽 杨一飞
(河北工程大学附属医院,河北 邯郸 056000)
甲状腺癌是世界上最常见的内分泌肿瘤,其发病率逐年上升[1]。其中80%~85%的甲状腺癌为甲状腺乳头状癌(Papillary thyroid cancer,PTC),其5年生存率达94%,而间变性甲状腺癌(Anaplastic thyroid cancer,ATC)占2%左右,其侵袭性较强,1年生存率约为20%[2-3]。随着医学技术的不断进步,甲状腺癌发病机制的研究也取得较大发展,但其发病率仍在增长。因此,探索ATC的发病机制,提高ATC的存活率具有重要意义。微小核糖核苷酸(MicroRNAs,miRNAs)是一类长度约22个核苷酸的非编码RNA片段,在PTC的预后和治疗中起着至关重要的作用[4-5]。miR-126在很多癌症中扮演抑癌基因的角色,抵抗癌症的恶化[6]。近两年,有研究[7]报道,miR-126在甲状腺癌中表达失调,与癌症的进展存在联系,但是其在ATC糖酵解中的作用及机制尚少有人研究。溶质运载家族7成员5(Solute carrier family 7 member 5,SLC7A5)是必需氨基酸(如亮氨酸和苯丙氨酸)的膜转运蛋白,其在细胞增殖所需蛋白的合成中起关键作用[8]。SLC7A5在人类的多种实体肿瘤中过度表达,其中包括甲状腺癌[9]。但是,SLC7A5是否参与miR-126-3p.1在甲状腺癌进展中的作用尚未可知。本研究旨在探讨miR-126-3p.1调控甲状腺癌细胞糖酵解的作用机制及其与SLC7A5之间的关系。
1 材料与方法
1.1 实验材料 人正常甲状腺细胞Htori-3、人间变性甲状腺癌细胞SW1736、人乳头瘤状甲状腺癌细胞TPC-1(中国科学研究院上海细胞库);TRIzol液、逆转录酶、BCA蛋白检测试剂盒(美国Invitrogen);ReadyPrep 蛋白质萃取试剂盒(总蛋白)(美国Bio-Rad);SLC7A5一抗、GAPDH一抗、HRP标记的IgG二抗体(Abcam);BeyoECL Plus试剂盒、增强型CCK-8试剂盒、EdU试剂盒(中国上海碧云天生物科技公司);葡萄糖含量检测试剂盒(微量法)、乳酸含量(LA)检测试剂盒(可见分光光度法)(北京索莱宝生物科技有限公司);CKX31型奥林巴斯倒置显微镜(上海普赫光电科技有限公司)。
1.2 方法
1.2.1 细胞培养、转染及分组 Htori-3、SW1736、TPC-1均使用DMEM培养基(10%胎牛血清+100 μg/mL青霉素+0.1 mg/mL链霉素)培养。在37 ℃、5%CO2饱和湿度空气的恒温细胞培养箱中常规传代培养。TPC-1细胞分为agomiRNA(转染agomiRNA)组、agomiR-126-3p.1(转染agomiR-126-3p.1)组、si-NC(转染si-NC)组、si-SLC7A5(转染si-SLC7A5)组、agomiR-126-3p.1+pcDNA(共转染agomiR-126-3p.1和pcDNA)组、agomiR-126-3p.1+ pcDNA-SLC7A5(共转染agomiR-126-3p.1和pcDNA-SLC7A5)组,各组细胞用脂质体法转染至SW1736。RT-qPCR确定转染是否成功。
1.2.2 RT-qPCR实验检测miR-126-3p.1、SLC7A5的表达 TRIzol液提取细胞总RNA,逆转录酶合成cDNA。分别使用TaqMan miRNA检测试剂盒、SYBR®预混料Ex TaqTMII进行miR-126-3p.1、SLC7A5的qPCR分析。条件为(95 ℃,10 min与95 ℃,15 s和60 ℃,1 min,40循环)。U6、GAPDH分别用作miR-126-3p.1、SLC7A5的内部参照,2-△△Ct法计算结果。
1.2.3 CCK8法检测细胞增殖 使用增强型CCK-8试剂盒检测细胞的增殖。将细胞以每孔100 μL(1×104个细胞)接种96孔板,每孔加入10 μLCCK-8溶液,孵育30 min。450 nm波长处检测细胞的吸光度(OD450)。增殖率(%)=OD450实验/OD450对照×100%。
1.2.4 EdU法检测细胞增殖 将待测细胞以每孔500 μL(5×104个细胞)接种24孔板,培养过夜。再用250 μL含有20 μM EdU的新鲜培养液替换一半的培养液,继续培养8 h。4%多聚甲醛固定细胞15 min,并用0.5%Triton X-100渗透细胞20 min。用3%牛血清白蛋白冲洗后,添加500 μL 1×Click反应液,室温避光孵育30 min。加入5 μg/mL Hoechst 33342对细胞核染色30 min。荧光显微镜观察,拍照。Hoechst 33342核染为蓝色,EdU染色为红色。用红色细胞数/蓝色细胞数×100%表示EdU阳性率。
1.2.5 ELISA法检测细胞葡萄糖、乳酸 通过葡萄糖摄取和乳酸生成评估细胞的糖酵解水平。使用葡萄糖含量检测试剂盒(微量法)、乳酸含量(LA)检测试剂盒(可见分光光度法)检测细胞葡萄糖含量、乳酸含量。操作步骤严格按照试剂盒说明书要求操作、计算。以对照组细胞葡萄糖含量、乳酸含量最为单位,实验组葡萄糖含量、乳酸含量占对照组葡萄糖含量、乳酸含量的百分比表示相对葡萄糖消耗率、相对乳酸生成率。
1.2.6 WB实验检测细胞SLC7A5蛋白 使用ReadyPrep 蛋白质萃取试剂盒(总蛋白)从各组细胞中提取总蛋白,BCA蛋白浓度检测试剂盒测定蛋白浓度。通过SDS-PAGE分离蛋白,再转移到PVDF膜。PVDF膜封闭处理后,使用SLC7A5(1∶2000)、GAPDH(1∶3000)一抗孵育(4 ℃,12 h)。然后用HRP标记的IgG二抗(1∶1000)孵育(37 ℃,2 h)。ECL显色,Image J软件分析每个蛋白条带的灰度。使用目的蛋白灰度值与内参蛋白灰度值之间的比值表示蛋白的相对表达量。
1.2.7 双荧光素酶报告基因实验检测细胞荧光活性 生物信息学靶标预测网站Targetscan(https://www.targetscan.org)、starbase(https://starbase.sysu.edu.cn)预测miR-126-3p.1的靶标,发现SLC7A5为其下游靶基因之一。根据结合位点合成野生型SLC7A5(含SLC7A5 3′ UTR-WT结合序列)、突变型SLC7A5(不含SLC7A5 3′ UTR-MUT结合序列),克隆至荧光载体psiCHECK2,形成荧光报告基因(SLC7A5 3′ UTR-WT、SLC7A5 3′ UTR-MUT)。Lipofectamine 2000将荧光报告基因与agomiRNA、agomiR-126-3p.1、antagomiRNA、antagomiR-126-3p.1共转染SW1736细胞。双荧光素酶报告基因检测试剂盒检测细胞的荧光活性。
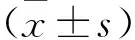
2 结果
2.1 miR-126-3p.1在甲状腺癌中的表达 TCGA数据库显示,miR-126-3p.1在甲状腺癌组织中表达水平显著降低(见图1A),作为癌症诊断指标的AUC值为0.68(见图1B),高表达患者的存活率明显升高(见图1C)。Htori-3、SW1736、TPC-1细胞miR-126-3p.1表达分别为0.98±0.07、0.31±0.03、0.46±0.04,与Htori-3相比,SW1736、TPC-1细胞miR-126-3p.1表达显著降低(F=451.095,P<0.001)。
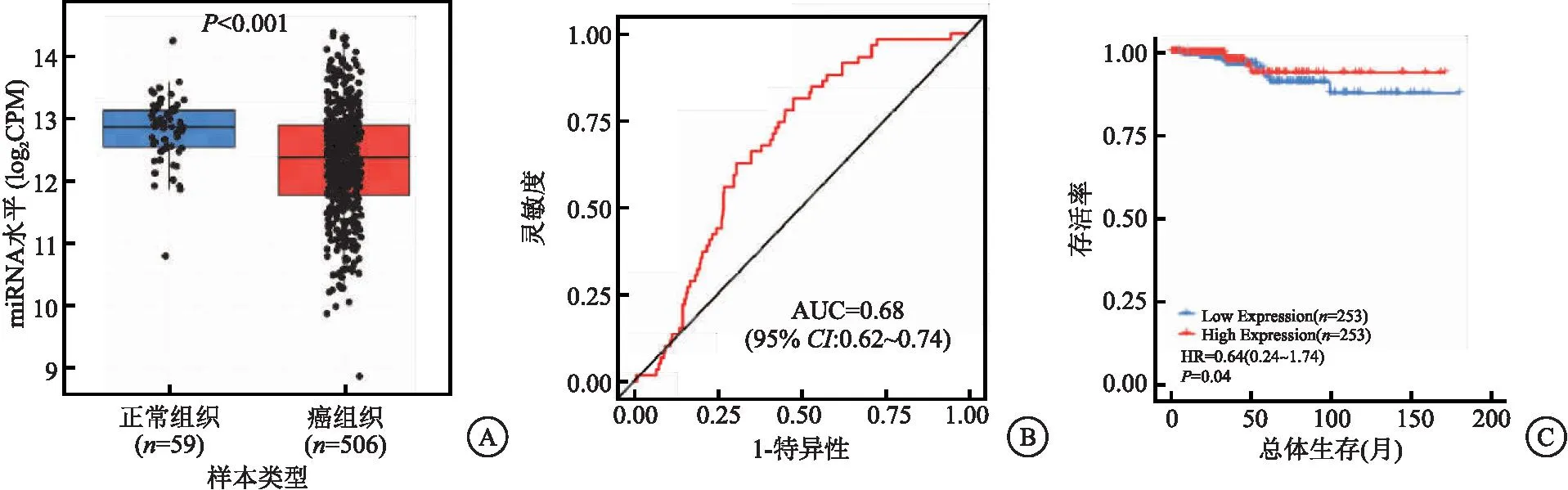
图1 miR-126-3p.1与甲状腺癌之间的关系分析Figure 1 Analysis of the relationship between miR-126-3p.1 and thyroid cancer注:A.miR-126-3p.1在癌组织中的表达;B.miR-126-3p.1在甲状腺癌中的ROC分析;C.miR-126-3p.1与甲状腺癌患者的生存分析。
2.2 过表达miR-126-3p.1对TPC-1细胞糖酵解的调控 与agomiRNA组相比,agomiR-126-3p.1组细胞miR-126-3p.1表达显著升高,细胞增殖率、EdU阳性率、相对葡萄糖消耗率、相对乳酸生成率均显著降低(均P<0.05), 见表1。

表1 过表达miR-126-3p.1的SW1736细胞增殖、糖酵解Table 1 Proliferation and glycolysis of SW1736 cells overexpressing miR-126-3p.1
2.3 miR-126-3p.1靶向SLC7A5 Targetscan(https://www.targetscan.org)发现,SLC7A5 3′UTR与miR-126-3p.1之间存在连续的6个互补结合位点。转染agomiR-126-3p.1和SLC7A5 3′UTR-WT的TPC-1细胞荧光活性显著降低,转染antagomiR-126-3p.1和SLC7A5 3′UTR-WT的TPC-1细胞荧光活性显著升高(均P<0.05)。在甲状腺癌组织中miR-126-3p.1与SLC7A5之间呈显著的负相关(R=-0.266,P<0.05)。与agomiRNA组相比,agomiR-126-3p.1组TPC-1细胞SLC7A5蛋白表达量显著降低,与antagomiRNA组相比,antagomiR-126-3p.1组TPC-1细胞SLC7A5蛋白表达量显著升高,差异有统计学意义(均P<0.05)。见图2。
图2 miR-126-3p.1靶向SLC7A5Figure 2 miR-126-3p.1 targets SLC7A5注:A.互补结合位点;B.双荧光素酶报告实验结果;C.miR-126-3p.1与SLC7A5在甲状腺癌中的相关性;D.miR-126-3p.1负向调控SLC7A5蛋白。与agomiRNA组比较,①P<0.05;与agomiR-126-3p.1组比较,②P<0.05。
2.4 SLC7A5在甲状腺癌中的表达 SLC7A5在甲状腺癌组织中的表达显著高于正常组织(见图3A),在SW1736、TPC-1细胞中的表达显著高于Htori-3细胞(见图3B)。与Htori-3相比,SW1736、TPC-1细胞SLC7A5表达显著升高(P<0.05),见表2。

表2 SLC7A5在Htori-3、SW1736、TPC-1细胞中的表达Table 2 SLC7A5 expression in Htori-3, SW1736 and TPC-1 cells

图3 SLC7A5在甲状腺癌中的表达Figure 3 SLC7A5 expression in thyroid carcinoma注:A.SLC7A5在甲状腺癌组织中的表达;B.SLC7A5在甲状腺癌细胞中的表达。
2.5 敲减SLC7A5对SW1736细胞糖酵解的调控 与si-NC组相比,si-SLC7A5组SW1736细胞SLC7A5表达、细胞增殖率、EdU阳性率、相对葡萄糖消耗率、相对乳酸生成率均显著降低(P<0.05),见图4、表3。

表3 敲减SLC7A5的SW1736细胞的增殖、糖酵解Table 3 Proliferation and glycolysis of SW1736 cells knockdown SLC7A5
图4 SLC7A5蛋白表达Figure 4 SLC7A5 protein expression
2.6 过表达SLC7A5逆转miR-126-3p.1对SW1736细胞糖酵解的作用 与agomiR-126-3p.1+pcDNA组相比,agomiR-126-3p.1+pcDNA-SLC7A5组SW1736细胞SLC7A5表达显著升高,miR-126-3p.1表达显著降低,细胞增殖率、EdU阳性率、相对葡萄糖消耗率、相对乳酸生成率显著升高(均P<0.05)。见图5、表4。

表4 过表达SLC7A5和miR-126-3p.1的SW1736细胞增殖、糖酵解Table 4 Proliferation and glycolysis of SW1736 cells overexpressing SLC7A5 and miR-126-3p.1
图5 SLC7A5蛋白表达Figure 5 SLC7A5 protein expression
3 讨论
miR-126表达广泛,在人类癌症中具有诊断价值,其在某些癌症中作为肿瘤抑制因子发货作用,包括肺癌、胃癌、胰腺癌及恶性甲状腺癌[10-11]。Tao等[12]报道,miR-126作为circPVT1的靶点,在甲状腺癌组织、细胞中低表达,并且下调miR-126可逆转沉默circPVT1对癌细胞增殖、迁移侵袭的抑制和凋亡的促进作用。Zeng等[13]在甲状腺癌的研究中报道,miR-126在PTC-1、ATC细胞SW1736中低表达,与NEAT1、VEGFA存在靶向关系,调控甲状腺癌细胞的增殖、迁移侵袭及凋亡,暗示miR-126在甲状腺癌中的潜在作用。本课题组的此研究发现,miR-126-3p.1在甲状腺癌组织、细胞中表达下调,这也与上述研究结果相一致。进一步研究发现,过表达miR-126-3p.1抑制了癌细胞的增殖、葡萄糖消耗率、乳酸生成,表现出抑制癌细胞糖酵解的抑癌功能。深入研究发现,miR-126-3p.1可靶向SLC7A5,并且他们在癌组织中的表达水平呈明显的负相关性,这也许可能与miR-126-3p.1在甲状腺癌中发挥调控作用存在一定联系。
据报道[14-15],在PTC中,SLC7A3、SLC7A5和SLC7A11表达水平的升高预示着患者的生存率较低或预后不良。在ATC的研究[16-17]中报道,SLC7A5在ATC小鼠肿瘤模型、ATC患者组织样本中的表达均上调,SLC7A5阻断剂JPH203给药后,模型小鼠肿瘤生长停滞,这些临床前的研究结果表明,SLC7A5抑制剂在甲状腺癌中的治疗前景。体外研究[18-20]显示,JPH203通过抑制mTOR信号,阻断细胞从G0/G1期到S期的进展,抑制ATC细胞的增殖,肿瘤生长,再次表明SLC7A5抑制剂是控制ATC的候选药物。但是,SLC7A5对甲状腺癌糖酵解过程是否有影响尚未可知。本研究结果显示:SLC7A5在甲状腺癌组织、细胞中表达升高,敲减SLC7A5不但抑制癌细胞的增殖,更抑制了癌细胞的糖酵解,这再次证实了SLC7A5在甲状腺癌恶化过程中的关键作用,也说明其作为miR-126-3p.1靶标在miR-126-3p.1调控甲状腺癌过程中的重要性。过表达SLC7A5逆转了miR-126-3p.1对癌细胞增殖、糖酵解的抑制作用。
4 结论
miR-126-3p.1抑制甲状腺癌细胞增殖、糖酵解,这种抗癌作用的潜在机制与靶向SLC7A5有联系,可为甲状腺癌的治疗提供新靶点。

