miR-449a下调TGIF2抑制甲状腺癌细胞CAL-62恶性增殖的研究*
岳秀杰 杨崔航 单妍 赵月 樊静
(秦皇岛市第四医院北区病理科,河北 秦皇岛 066000)
甲状腺癌是一种常见的内分泌恶性肿瘤,好发于中老年女性,其发生和发展是一个复杂的过程。尽管甲状腺癌患者的治疗方法不断发展,但5年癌症特异性生存率仍欠满意[1-2]。研究[3]表明,转移和肿瘤复发的高比例是甲状腺癌高发的主要原因。因此,抑制甲状腺癌细胞增殖、转移等特性在甲状腺癌治疗过程中至关重要。TGIF2(TGF-β-induced factor homeobox 2)是同源结构域蛋白的三个氨基酸环延伸(Three-amino acid loop extension,TALE)超家族的成员,在细胞增殖和转移等过程中起着重要的调控作用[4-5]。miRNA可通过与mRNA的3′非翻译区结合诱导mRNA切割或抑制基因翻译,调节基因的表达[6]。miRNA已被证明参与多种癌症调控,包括甲状腺癌[4, 7]。研究[8-9]发现miR-449a具有优异的抗肿瘤特性,但其对甲状腺癌的作用效果还未被阐明。本研究探讨miR-449对CAL-62细胞中TGIF2的调控作用以及对CAL-62恶性增殖、氧化应激和上皮间质转换(Epithelial-mesenchymal transition, EMT)的抑制作用,以期为甲状腺癌的预防和治疗提供新的依据和策略。
1 材料与方法
1.1 细胞与试剂 甲状腺癌细胞CAL-62(https://web.expasy.org/cellosaurus/CVCL_1112)来自美国ATCC。主要试剂:miR-NC,miR-449a mimic,pcDNA,pcDNA-TGIF2,pMIR报告质粒载体及试验所用序列购自RiboBio公司;DMEM培养基、胎牛血清均购自Sigma公司;Lipofectamine 2000试剂购自Invitrogen公司;反转录试剂盒购自TaKaRa公司;BCA试剂盒、SOD、MDA检测试剂盒购自合肥莱尔生物科技有限公司;细胞蛋白提取试剂盒购自Foregene公司;逆转录酶、TRIzol试剂盒、荧光素酶检测试剂盒购自美国普洛麦格公司。试验所用抗体均购自上海艾博抗生物科技有限公司。
1.2 方法
1.2.1 细胞培养 将CAL-62细胞培养于含10%胎牛血清、1×105U/L青霉素和1×105U/L链霉素的培养基中,置于5%二氧化碳、37 ℃的恒温培养箱中培养。培养基每2 d更换一次,每3 d传代一次,实验用细胞为对数生长期细胞。
1.2.2 细胞分组和转染 细胞分组:①为探索miR-449a能否在CAL-62细胞种过表达,将CAL-62细胞分为mimic-NC组(阴性对照组)和miR-449a mimic(过表达miR-449a)组、对照组,按照分组分别通过质粒转染技术转染 mimic-NC、miR-449a mimic,对照组不进行转染,RT-PCR用以检测miR-449a的过表达效率。②探索过表达TGIF2能否在CAL-62细胞实现,将细胞分为pcDNA(阴性对照)组、pcDNA-TGIF2(过表达TGIF2)组、对照组,按照分组分别转染pcDNA、pcDNA-TGIF2,对照组不进行转染,RT-PCR用以检测TGIF2的过表达效率。③分别过表达miR-449a、TGIF2以及同时二者过表达对于肿瘤细胞生物学行为的影响,将细胞分为miR-449a mimic组、pcDNA-TGIF2组和mimic+TGIF2组、对照组,按照分组分别转染 miR-449a mimic、pcDNA-TGIF2以及共转染pcDNA-TGIF2和miR-449a mimic,后续进行细胞功能实验。细胞转染:以5×105/mL的密度将CAL-62细胞接种于12孔板中,约80%汇合度时,按照上述分组使用Lipofectamine 2000分别将上述载体转染至CAL-62细胞。
1.2.3 RT-PCR检测方法 用TRIzol试剂提取CAL-62细胞的总RNA,使用SMA 400 UV检测分离RNA的浓度和纯度。使用逆转录系统试剂盒从RNA样品中合成cDNA。TGIF2和miR-449a的实时PCR分别使用标准的SYBR Green PCR试剂盒和TaqMan miRNA检测在实时PCR系统上进行。将以GAPDH或U6为内参,并通过2-ΔΔCt方法计算。定量PCR的反应条件为:95 ℃10 min,95 ℃20 s,60 ℃30 s,72 ℃20 s循环45次。
1.2.4 CCK-8检测细胞活力 四组细胞分别以5×103个细胞/孔的密度接种到96孔板,在37 ℃和5% CO2的培养箱中培养24 h。然后,加入CCK-8,在相同条件下孵育4 h。每组由5口平行组成。然后,添加10 μL/孔的CCK-8染料(5 mg/ml),然后在37 ℃下在5%的CO2气氛中再培养4 h。然后用酶标仪在450 nm测量吸光度。
1.2.5 BrdU检测细胞活力 用5-溴脱氧尿嘧啶核苷(BrdU)试剂盒测定细胞的增殖。简单地说,将四组CAL-62细胞接种到96孔板(5×103个细胞/孔)中,在37 ℃孵育过夜。然后用1 mg/mL BrdU溶液标记细胞3 h。此外,使用fixtenta溶液使细胞变性30 min,然后用过氧化物酶结合的抗BrdU抗体培养90 min[10]。细胞核用DAPI复染。在荧光显微镜下观察BrdU阳性细胞的数量。
1.2.6 双重荧光素酶实验 收集生长至对数期的CAL-62细胞,接种于24孔板中,并在37 ℃、5%CO2条件的培养箱培养24 h。然后,将1 g PGL3-TGIF2-WT(SP1野生型)或PGL3-TGIF2-MUT(SP1突变型)以及miR-NC或miR-449a mimic和PRL-CMV质粒共转染入CAL-62细胞,转染48 h后,CAL-62细胞裂解15 min,双荧光素酶检测系统测量荧光素酶的相对活性,荧光素酶的相对活性(R/F)=萤火虫荧光素酶活性/肾荧光素酶活性。
1.2.7 试剂盒检测氧化应激 通过试剂盒检测细胞上清液中SOD、MDA含量,实验严格按照试剂盒说明书进行操作。
1.2.8 DCF染色 参照相关文献[12]方法测量ROS含量。CAL-62细胞在含5 mM H2DCFDA的Hank平衡盐溶液中培养1 h。氧化后,非荧光H2DCFDA转化为高荧光2′,7′-二氯荧光素(DCF)。用Olympus共焦显微镜在488 nm的激发波长和515-540 nm的发射波长下测量了DCF的荧光。用数字干涉对比法(DIC)获得细胞图像。用Image J软件分析每个细胞的平均荧光强度和每个视野中ROS阳性细胞的数量。
1.2.9 蛋白免疫印迹(Western blot) 将各组CAL-62细胞加裂解液后提取总蛋白,用BCA试剂盒检测蛋白含量。SDS-PAGE凝胶电泳分离蛋白转移至PVDF膜,加入一抗(TGIF2,E-cadherin, N-cadherin,Fibronectin),4 ℃孵育过夜,TBST洗膜,加入二抗HRP-IgG,室温孵育1 h,TBST洗膜。通过Image LabTM软件行灰度值分析。
2 结果
2.1 CAL-62细胞转染 与Control组相比,mimic-NC组CAL-62细胞中miR-449a和TGIF2相对水平变化差异无统计学意义(P>0.05),miR-449a mimic组miR-449a相对水平显著提升,TGIF2相对水平显著降低(均P<0.05)。与Control组比较,pcDNA组CAL-62细胞中TGIF2蛋白相对表达水平差异无统计学意义(P>0.05),pcDNA-TGIF2组TGIF2蛋白相对表达水平显著升高(P<0.05)。与pcDNA-TGIF2组比较,mimic+TGIF2组CAL-62细胞中TGIF2 mRNA和蛋白表达水平显著降低(P<0.05)。见图1。
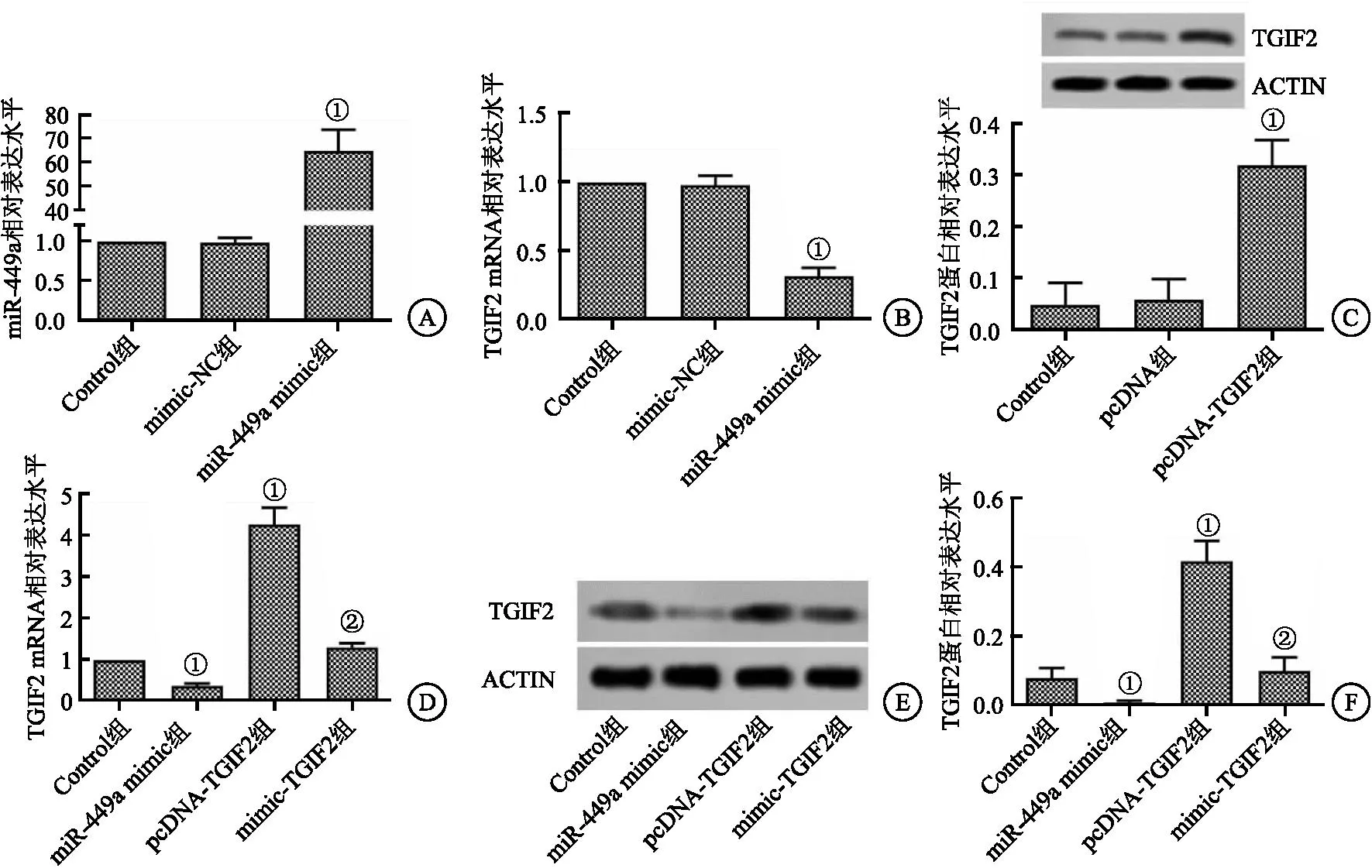
图1 CAL-62细胞转染结果Figure 1 Transfection results of CAL-62 cells注:A.miR-449a mimic成功转染CAL-62细胞;B.miR-449a mimic转染CAL-62细胞中TGIF2的表达;C.pcDNA-TGIF2成功转染CAL-62细胞;D、E.miR-449a mimic与pcDNA-TGIF2共转染CAL-62细胞中TGIF2的表达。与Control相比,①P<0.05;与pcDNA-TGIF2组相比,②P<0.05。
2.2 miR-449a与TGIF2靶向关系 运用TargetScan软件对二者的关系进行预测。提示miR-449a可与TGIF2基因的3′-UTR区直接结合(见图2A)。为了进一步确定CAL-62细胞中miR-449a与TGIF2的表达关系,用双荧光素酶报告基因检测法进一步确认。结果显示miR-449a可以显著抑制TGIF2 3′-UTR-wt载体的荧光强度(P<0.05),但对TGIF2 3′-UTR-mut载体的荧光强度几乎无影响(见图2B)。结果表明,miR-449a和TGIF2具有良好的靶向关系。
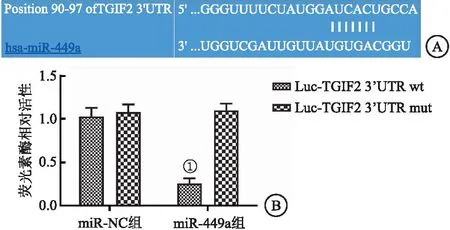
图2 miR-449a与TGIF2靶向关系Figure 2 The targeting relationship between miR-449a and TGIF2注:A.TargetScan软件预测结果;B.双重荧光素酶报告基因检测结果。与Luc-TGIF2 3’UTR wt相比,①P<0.05。
2.3 miR-449a过表达对CAL-62细胞活力的影响 与Control相比,pcDNA-TGIF2组CAL-62细胞活力显著增强,miR-449a mimic组细胞活力显著下降(P<0.05)。而与pcDNA-TGIF2组相比,mimic+TGIF2组的细胞活力显著下降(P<0.05)。表明miR-449a过表达可抑制TGIF2过表达引起的CAL-62细胞活力提升。见图3。
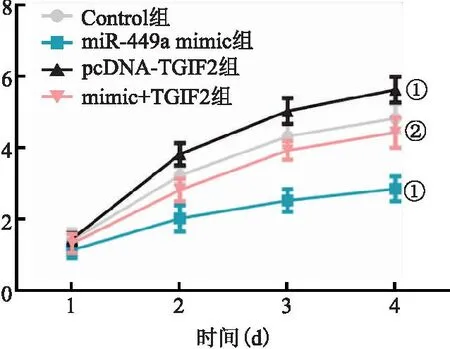
图3 miR-449a过表达对CAL-62细胞活力的影响Figure 3 The effect of miR-449a overexpression on CAL-62 cell viability注:与Control相比,①P<0.05;与pcDNA-TGIF2组相比,②P<0.05。
2.4 miR-449a过表达可抑制CAL-62细胞增殖 与Control组相比,pcDNA-TGIF2组BrdU阳性细胞百分率显著提升,miR-449a mimic组BrdU阳性细胞百分率显著下降(均P<0.05)。与pcDNA-TGIF2组相比,mimic+TGIF2组的BrdU阳性细胞百分率显著下降(P<0.05)。这些结果表明miR-449a过表达可抑制TGIF2过表达引起的CAL-62细胞增殖。见图4。
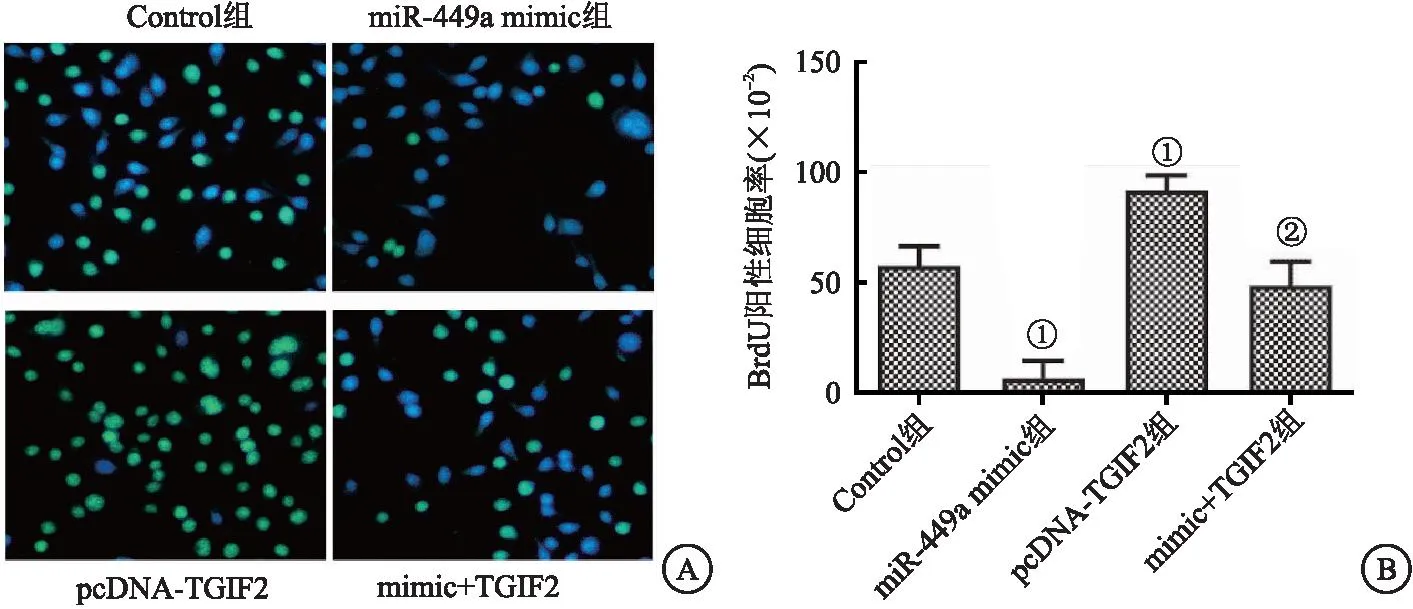
图4 BrdU染色检测细胞增殖Figure 4 BrdU staining was used to detect cell proliferation注:A.BrdU染色典型图像(×100);B.BrdU阳性细胞百分率。与Control组相比,①P<0.05;与pcDNA-TGIF2组相比,②P<0.05。
2.5 miR-449a过表达对CAL-62细9胞氧化应激的影响 与Control组相比,pcDNA-TGIF2组CAL-62细胞中SOD的含量显著增加,MDA的含量显著降低(P<0.05),miR-449a mimic转染起到了相反的作用。与pcDNA-TGIF2组相比,mimic+TGIF2组细胞中SOD的含量显著降低,MDA积累显著增加(P<0.05)。运用DCF染色检测了ROS的产生。pcDNA-TGIF2组ROS的产生量显著减少,miR-449a mimic组ROS含量显著提升(P<0.05)。与pcDNA-TGIF2组相比,mimic+TGIF2组细胞中ROS的含量显著增加(P<0.05)。这些结果表明miR-449a过表达可加剧CAL-62细胞氧化应激。见图5。
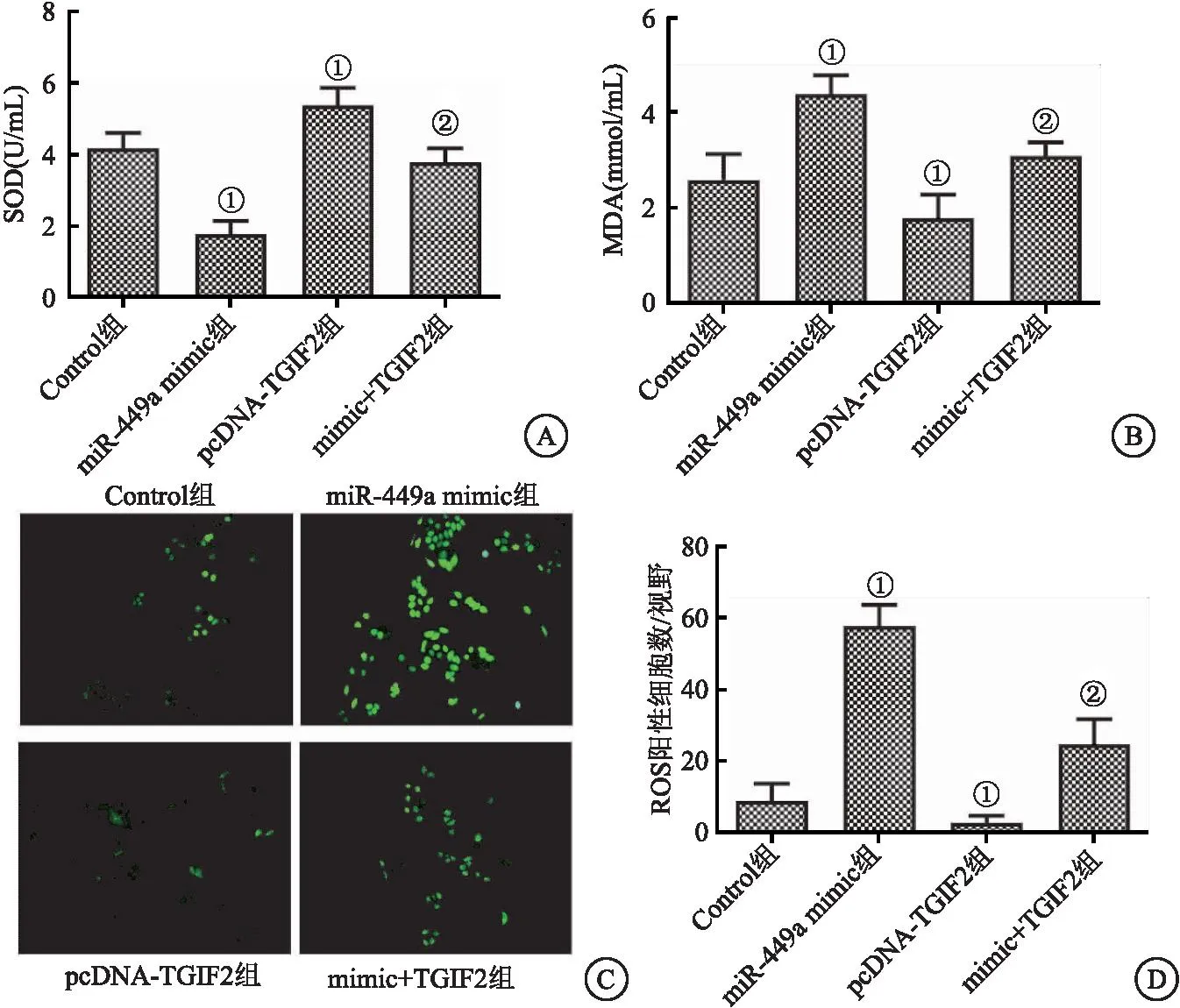
图5 各组细胞氧化应激指标水平Figure 5 Levels of oxidative stress indexes in each group 注:A.各组细胞中SOD水平;B.各组细胞中MDA水平;C.DCF染色典型图像;D.各组细胞中ROS阳性细胞数量。与Control组相比,①P<0.05;与pcDNA-TGIF2组相比,②P<0.05。
2.6 miR-449a过表达对CAL-62细胞上皮间质转换的影响 观察各组细胞形态可以看出,pcDNA-TGIF2组CAL-62细胞EMT程度明显增强,miR-449a mimic组CAL-62细胞EMT情况有所缓解。与pcDNA-TGIF2组相比,mimic+TGIF2组细胞中EMT情况显著缓解(P<0.05)。为了进一步证实上述结果,用Western Blot实验检测了EMT相关蛋白E-cadherin、N-cadherin和Fibronectin在各组细胞中的表达。与Control组相比,pcDNA-TGIF2组CAL-62细胞中N-cadherin和Fibronectin的表达水平显著提升,E-cadherin表达水平显著降低,miR-449a mimic组CAL-62细胞中N-cadherin和Fibronectin的表达水平显著降低,E-cadherin表达水平显著提升(均P<0.05)。与pcDNA-TGIF2组相比,mimic+TGIF2组CAL-62细胞中N-cadherin和Fibronectin的表达水平显著降低,E-cadherin表达水平显著提升(均P<0.05)。这些结果表明miR-449a过表达可抑制CAL-62细胞EMT情况。见图6。
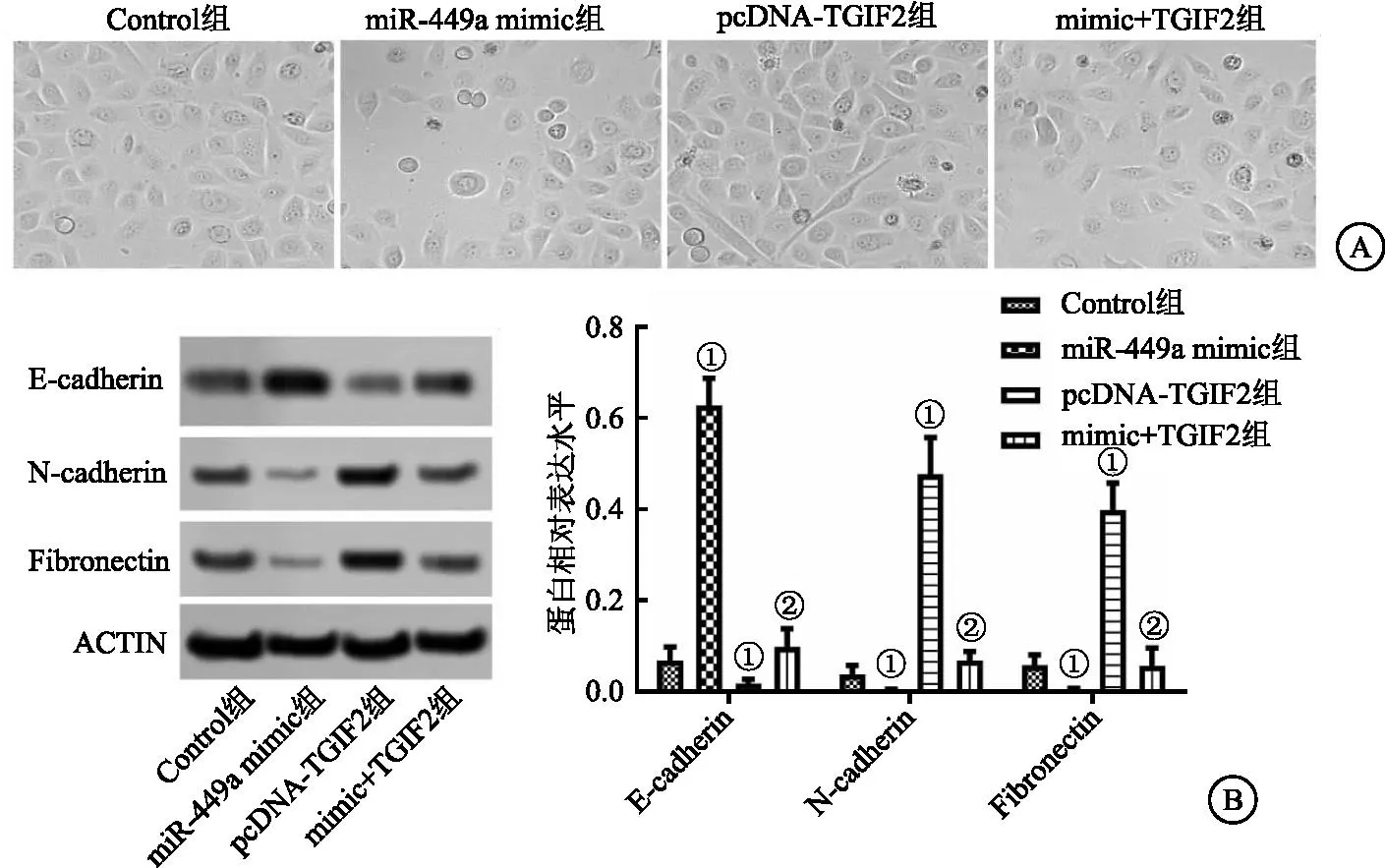
图6 各组细胞上皮间质转换情况Figure 6 EMT in each group 注:A.EMT典型图像;B.Western Blot检测相对蛋白水平。与Control相比,①P<0.05;与pcDNA-TGIF2组相比,②P<0.05。
3 讨论
随着医学研究和科学技术的发展,甲状腺癌治疗方法不断创新,有所突破,超声引导下细针穿刺细胞学检查是良恶性疾病诊断的主要手段,但5年癌症特异性生存率仍不令人满意[13-14]。因此,继续寻找新型甲状腺治疗方法和药物势在必行。
近年来,生物医学研究成为热点,在甲状腺癌治疗研究领域也得到了应用。其中最常见的是以miRNAs为靶点或调控因子的研究[15]。Lei 等[16]发现lncRNA TUG1通过靶向miR-145可抑制甲状腺乳头状癌细胞增殖、迁移和EMT的形成。Nixon 报道[17]称一系列miRNAs可以作为甲状腺球蛋白(Thyroglobulin,Tg)的替代性标志物用于诊断和术后监测。当机体产生的活性物质超出机体的清除能力时,则导致氧化与抗氧化系统之间的平衡失调,会对正常细胞结构和功能造成不可逆的损伤,进一步导致体细胞突变和转化,激活致癌通路促进细胞癌变[18]。EMT关键蛋白E-cadherin介导了细胞间黏附,在多种恶性肿瘤中被检测到表达降低[19]。N-cadherin和Fibronectin在肿瘤转移中扮演了关键角色,其表达高低可判定EMT的进展[20]。本研究将miR-449a运用于甲状腺癌细胞CAL-62恶性增殖,氧化应激和上皮间质转换抑制的研究,结果令人鼓舞。结果显示miR-449a转染可降低CAL-62细胞中BrdU阳性细胞百分率,降低SOD含量,增加MDA和ROS含量,并且抑制N-cadherin和Fibronectin表达水平,提升了E-cadherin表达水平。上述结果预示miR-449a可抑制甲状腺癌细胞CAL-62的增殖和EMT,促进其氧化应激损伤。为了进一步探讨这些成果背后的潜在机制,本研究分析了实验过程中TGIF2的调控水平。
TGIF2是一种重要的转录调节因子,其异常表达已在多种癌症中得到显现[21-22]。Du等[5]研究发现TGIF2可通过介导EGFR/RAS/ERK信号通路加速肺腺癌的发展进程。Lu 等[23]报道称miR-541-3p可通过直接靶向TGIF2逆转非小细胞肺癌的恶化。在本研究中,TGIF2在CAL-62细胞中的异常之高,pcDNA-TGIF2转染可诱发细胞恶性增殖,降低其氧化应激水平,促进细胞EMT发生。先前的研究人员所得结论与我们的相似。杨亚丽等[24]发现TGIF2可以通过促进细胞增殖、抑制细胞凋亡和促进细胞迁移而参与胶质瘤的发生。尹希燕等[25]报道称沙利度胺通过调控miR-29c-3p/TGIF2途径抑制血管内皮细胞增殖并促进其凋亡。本研究发现miR-449a和TGIF2具有良好的靶向关系。miR-449a mimic和pcDNA-TGIF2共转染显著降低了TGIF2水平并抑制细胞恶性增殖和EMT水平,加剧氧化应激。这些结论表明TGIF2是调控甲状腺癌细胞恶性生物学行为的靶点,而miR-449a过表达对其具有很好的调控作用。
鉴于近年来甲状腺癌的全球发病率有增无减,深入了解和揭示甲状腺癌的发病机制,并寻求有效的预防、诊断和治疗方法与策略是必不可少的,也是刻不容缓的。在本研究中miR-449a过表达可以通过下调TGIF2水平抑制CAL-62细胞增殖和EMT,促进其氧化应激损伤。这预示miR-449a靶向TGIF2水平的调控可能是有前途的甲状腺癌的治疗策略。由于本研究在有限的样本和局限的实验环境下进行,切实的实验效果还需在更进一步的验证。
4 结论
本研究结果提示,miR-449a过表达可通过靶向TGIF2抑制甲状腺癌细胞CAL-62恶性增殖,加剧其氧化应激和上皮间质转换。

