高胰岛素血症对糖尿病伴心力衰竭作用机制的中西医研究进展
任启珣 丛丛 白玉涵 王咏 曹斌


摘要 对中西医对高胰岛素血症在糖尿病伴心力衰竭进展中的作用机制及相关治疗的文献进行综述。高胰岛素血症导致营养物质代谢紊乱,包括蛋白质代谢异常——自噬的抑制;水和电解质代谢紊乱——氢钠交换异构体(NHE)的激活;葡萄糖与脂肪的代谢紊乱——心外膜脂肪组织的扩张,产生蛋白激酶B/哺乳动物雷帕霉素靶蛋白复合物1、NHE1、NHE3、葡萄糖转运蛋白(GLUT)4、脂肪酸、促炎细胞因子、神经酰胺等物质导致心脏毒性和心肌细胞氧化应激、钠滞留和血浆容量扩张、全身炎症、心肌细胞凋亡、心肌肥大和纤维化、冠状动脉微循环异常、血管僵硬等过程,从而促进心力衰竭的发展。现代研究发现,多个中药单体和复方及针灸、穴位敷贴等中医特色治疗可通过抑制氧化应激、抵抗炎症反应、调控葡萄糖转运通路、促进脂肪酸分解等途径减轻高胰岛素血症并保护心脏功能。
关键词 高胰岛素血症;糖尿病;心力衰竭;作用机制;中西医;综述
doi:10.12102/j.issn.1672-1349.2024.01.020
高胰岛素血症是由于各种原因导致机体胰岛素所产生的生理效应低于正常水平,机体代偿性分泌过多胰岛素而导致的疾病。心力衰竭(HF)是指心脏收缩或舒张功能障碍的一种心血管终末疾病,其中高血压、冠状动脉疾病、糖尿病等疾病都与心力衰竭的发生发展有一定关系。一项测量心功能和心力衰竭生物标志物的1型糖尿病前瞻性研究发现,1型和2型糖尿病病人发生心力衰竭的表型不同,除非1型糖尿病病人出现明显的高血压或冠状动脉疾病,否则在7年的随访期内心力衰竭的发生率很低;而2型糖尿病病人心力衰竭发病率和死亡率明显升高[1]。说明2型糖尿病与心力衰竭之间存在更加密切的联系,推测这种联系可能是由高胰岛素血症而不是高血糖引起的。因为在2型糖尿病与心力衰竭病人中,只有心力衰竭病人存在持续高胰岛素血症。有研究表明,降血糖的治疗方法对糖尿病病人发生心力衰竭的风险并未有一个长期的有利疗效[2]。相反,使用一些降血糖药物如胰岛素增敏剂噻唑烷二酮(TZD)以及较小程度的胰岛素会导致液体滞留,这会在既往有或不存在心功能不全的病人中引发心力衰竭[3]。一项在瑞典完成的为期9年的前瞻性研究[4]也发现高胰岛素血症发生于心力衰竭之前,是心力衰竭的危险因素,且独立于包括糖尿病在内的其他危险因素。由此推断高胰岛素血症本身对心脏功能有深远的不利影响。探讨高胰岛素血症引起心力衰竭的作用机制,中西医结合多途径、多靶点降低胰岛素含量,对于改善胰岛素抵抗,优化血糖控制,从而真正降低发生心力衰竭的风险有重要意义。
1 高胰岛素血症对糖尿病伴心力衰竭的作用机制
1.1 高胰岛素血症抑制自噬
自噬发生在大多数细胞中,通过溶酶体与自噬空泡的融合以清除蛋白质聚集体和异常细胞器,否则会导致细胞毒性和肌肉功能障碍。而自噬的丧失导致受损细胞器和错误折叠的蛋白质的积累,这是心肌细胞氧化和内质网应激的主要来源[5]。有研究证明胰岛素通过抑制由营养剥夺信号介导的组蛋白脱乙酰酶1(SIRT1)并激活由营养过剩信号介导蛋白激酶B/哺乳动物雷帕霉素靶蛋白复合物1(AKT/mTORC1)信号通路直接抑制心肌细胞的自噬[6-7]。2型糖尿病病人中升高的胰岛素激活AKT/mTORC1信号通路。AKT/mTORC1的激活会限制细胞对氧化和内质网应激的抵抗能力,从而引起心肌细胞功能障碍和死亡的发生。在实验模型中,心脏特有的AKT/mTOR通路过度激活会导致心力衰竭,而抑制AKT/mTOR信号可缓解不良适应的肥大和纤维化,并延缓心力衰竭的发展[8]。SIRT1的作用与AKT/mTORC1通路的作用相反,可以减少氧化应激,增强线粒体的健康和生物作用的发生,并减少促炎途径,而炎性小体抑制物具有减轻心肌肥厚和减少心脏损伤后细胞衰老和死亡的能力。在培养的新生大鼠心肌细胞中,胰岛素可抑制血清/葡萄糖剥夺诱导的营养应激触发的自噬相关基因的表达[7]。以上说明2型糖尿病病人中升高的胰岛素可以激活AKT/mTORC1,抑制SIRT1从而抑制自噬,进一步促进心肌细胞的内质网和线粒体氧化应激功能障碍并产生心脏毒性,以促进心力衰竭的发展,详见图1。
1.2 高胰岛素血症激活心脏与肾脏中的氢钠交换异构体(NHE)
NHE是存在于哺乳动物各组织器官中的质膜异构体,其中NHE1是唯一存在于心肌中的质膜异构体,通过介导Na+和H+的跨膜转运,用于中和代谢活动增加或缺血后发生的细胞酸性。当心肌细胞被依赖于磷脂酰肌醇3-激酶(PI3K)的胰岛素刺激时,可导致NHE1的易位和腺苷酸活化蛋白激酶(AMPK)介导的葡萄糖转运蛋白(GLUT)4易位,并通过以下途径影响心功能:首先,NHE1活性的增加直接导致糖尿病病人的心肌肥大和功能障碍[9];细胞内钠的升高导致异常的钙瞬变、心肌细胞损伤和心肌病[10-11];还会导致包括内皮功能障碍、中膜肥厚和新生内膜增生在内的糖尿病血管异常[11]。这些作用可能会增强糖尿病病人由其他原因引起的功能障碍,并足以引发心力衰竭。其次,GLUT4易位可以引起细胞葡萄糖转运的增加并导致心肌细胞葡萄糖代谢和三磷酸腺苷(ATP)水平的重新调整和补充。NHE抑制剂可以阻止胰岛素诱导的胞浆碱化以及与之相关的胰岛素刺激的GLUT4易位和葡萄糖摄取[12]。存在于肾和胃肠上皮细胞中的NHE3同样受胰岛素刺激,其介导了肾小球滤过后的大部分钠再摄取,并与液体滞留以及对利尿剂和内源性钠尿肽的抵抗有关[13-14]。总之,2型糖尿病病人体内升高的胰岛素激活心肌细胞中的NHE1(导致心肌肥大和功能障碍、心肌损伤和丢失、血管异常)和近端肾小管中的NHE3(导致钠滞留和血浆容量扩张)来促进心力衰竭的发展,详见图2。
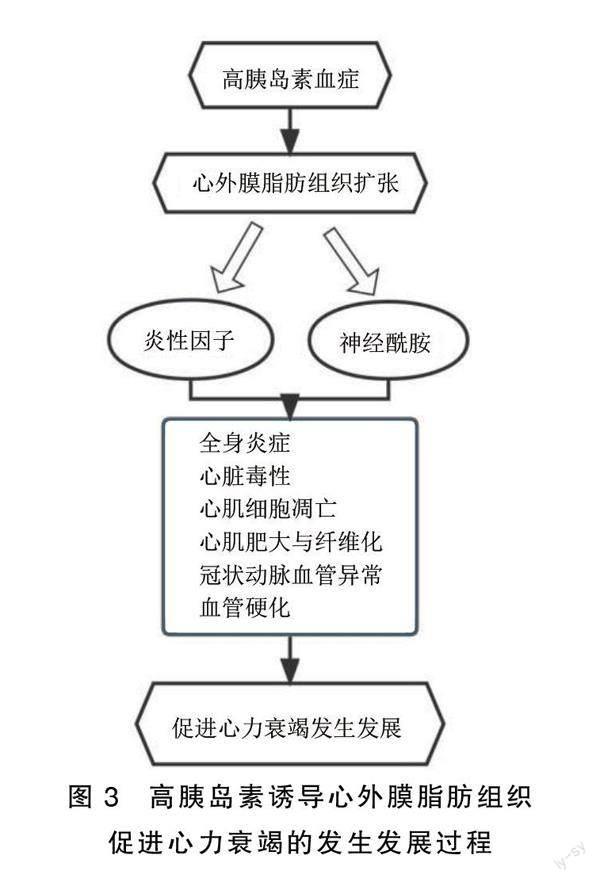
1.3 高胰岛素血症导致心外膜脂肪组织扩张(EAT)
胰岛素负责通过GLUT将葡萄糖从血液输送到细胞,特别是GLUT4,当葡萄糖进入细胞时,要么通过葡萄糖氧化被用作能量,要么通过糖异生转化为脂肪用于储存。有研究表明,具有高胰岛素血症特征的糖尿病病人伴有心包和心外膜脂肪的堆积[15]。当心外膜脂肪细胞充满过多的脂肪时,容易发生脂肪分解,分解过程中脂肪酸的释放触发巨噬细胞的渗透和促炎细胞因子[瘦素、肿瘤坏死因子-α(TNF-α)、白介素6(IL-6)、白介素1β(IL-1β)和抵抗素]的分泌[16-17]。心外膜的这些紊乱可进一步通过微循环影响心肌。如瘦素可以通过影响心肌细胞的钙处理、刺激胶原的合成、促进醛固酮的分泌、增强肾交感神经的活性、刺激钠/钾-三磷酸腺苷酶来刺激钠管重吸收等方式损害心肌松弛并导致心脏和血管纤维化[18-19]。TNF-α在激活中性粒细胞、调节炎症和免疫反应、介导内毒素性休克等过程中发挥一定的生物学活性,并通过促进一氧化氮合成,产生心脏毒性;激活心肌细胞金属蛋白酶,改变心肌細胞基质并诱导凋亡;影响心肌细胞钙处理等机制介导有害的心脏重塑和负性变力作用来影响心脏功能。此外,脂肪酸非氧化途径产生的神经酰胺等中间产物会影响心肌细胞的信号传导、自噬及线粒体功能,从而导致心肌收缩障碍和心律失常的发生。总之,心外膜脂肪扩张参与了全身炎症、心脏毒性、心肌细胞凋亡、心肌纤维化和冠状动脉微循环异常、血管僵硬等过程,从而促进心力衰竭的发展,详见图3。
2 糖尿病伴心力衰竭的治疗
临床针对糖尿病伴心力衰竭的治疗,除了考虑其降糖力度,还应考虑其对心血管风险的影响,采取合理、个性化的治疗方法。以往的研究发现,促胰岛素分泌剂磺脲类[20]、胰岛素增敏剂噻唑烷二酮[3]和胰岛素[21]会增加心力衰竭的风险或恶化临床病程,而二甲双胍[20]和钠-葡萄糖共转运体2(SGLT2)抑制剂[22]则降低心力衰竭的风险。相比之下,磺脲类、噻唑烷二酮等直接或间接增加胰岛素的降糖策略没有改善心力衰竭或潜在的有害影响的报道,这可能与直接或间接增加血液中胰岛素含量会使钠重吸收增加,胰岛素诱导的钠和水滞留会加剧心脏充血有关。而二甲双胍和SGLT2抑制剂的降糖效应不是胰岛素介导的,相反还会降低胰岛素含量[23-24],所以能降低心力衰竭的风险。另外血管紧张素转换酶抑制剂、血管紧张素受体拮抗剂和他汀类药物、生活方式干预等不增加胰岛素浓度的策略,也有利于糖尿病及心力衰竭病人的预后。由此从侧面证明了高胰岛素血症对心脏功能存在不利影响。
3 中医对高胰岛素血症的认识
中医古籍无高胰岛素血症病名记载,根据其临床表现可归属于“消渴”“脾瘅”等范畴[25]。中医学认为,胰岛素是人体“血气”的一部分,而高胰岛素血症的发生是脾运化水谷精微功能失调,则脏腑病,津液败,而血气即成痰涎的形成过程[26]。高胰岛素血症导致心力衰竭的发生与中医“痰生百病”相一致。脾运化水谷精微不利,导致痰湿内生,痰湿随气升降,上侵于心,又因痰湿重浊黏腻,病程长久,“久病必虚,久病必瘀”或痰湿“壅阻脉道,使气血不畅”致虚、痰、瘀互结并影响心功能。根据现代研究,水谷精微正是水、电解质、葡萄糖、脂肪、蛋白质等营养物质。脾运化水谷精微不利,指营养物质代谢紊乱,包括蛋白质代谢异常——自噬的抑制(清除蛋白质聚集体和异常细胞器);水和电解质代谢紊乱——NHE的激活;葡萄糖与脂肪的代谢紊乱——心外膜脂肪组织的扩张,产生AKT/mTORC1、NHE1、NHE3、GLUT4、脂肪酸、促炎细胞因子、神经酰胺等导致心脏毒性和心肌细胞氧化应激功能障碍、钠滞留和血浆容量扩张、全身炎症、心肌细胞凋亡、心肌纤维化和冠状动脉微循环异常、血管僵硬等过程,从而促进心力衰竭的发展。
4 中医治疗高胰岛素血症的机制
4.1 抑制氧化应激
氧化应激是伴有活性氧(ROS)、活性氮(RNS)等自由基大量蓄积的机体内氧化与抗氧化作用失衡的一种状态。其中超氧化物歧化酶(SOD)、谷胱甘肽过氧化物酶体(GSH-Px)在体内发挥抗氧化作用,而丙二醛(MDA)水平与机体氧化应激水平呈正相关。许多中药中的有效成分都可以通过提高血清SOD的含量或降低MDA含量拮抗线粒体、内质网的氧化应激反应,如三七总皂苷[27]、复方北冬虫夏草[28]、泽泻多糖[29]、何首乌二苯乙烯苷[30]、山楂叶总黄酮[31]、黄芪多糖[32]等。由人参、麦冬、丹参等组成的中药复方加味生脉补心丹[33]也能提高SOD、GSH-Px,降低MDA含量以有效抗氧化,减少心肌细胞凋亡从而保护心肌。
4.2 抵抗炎症反应
瘦素、抵抗素、TNF-α、白介素1(IL-1)、IL-6等炎性因子分泌失衡与心肌损害密切相关。中药活性成分黄连素[34]、枸杞多糖[35]、人参糖肽[36]、吴茱萸次碱[37]及来源于中药虎杖中的多酚类化合物白藜芦醇[38]等对这些炎性因子的分泌具有明显的调节作用,并拮抗炎症反应与细胞自噬反应从而改善心功能。由黄芪、丹参、山药等组成的补气健脾化痰方[39]、参芪降糖颗粒可降低超敏C反应蛋白(hs-CRP)、IL-6等炎性因子水平。防己黄芪汤可通过抑制脂肪细胞中单核细胞化学趋化因子-1(MCP-1)、TNF-α mRNA炎性因子介导的“微炎症状态”抵抗心肌损害[40]。
4.3 调控葡萄糖转运通路
通过调控葡萄糖转运摄取过程中的胰岛素受体(INSR),磷酸化的胰岛素受体底物(IRS),信号通路(PI3K、AKT)、GLUT等从而调控心肌细胞自噬保护心功能。氧化苦参碱通过激活PI3K/AKT通路,诱导胰岛素受体底物磷酸化,促进GLUT2表达,完成其改善胰岛素抵抗的作用[41]。麦冬寡糖通过上调IRS-1、INSR、PI3K、AKT、GLUT2的mRNA表达水平改善2型糖尿病大鼠缺血再灌注损伤[42]。黄葵胶囊干预伴有缺血再灌注足细胞损伤大鼠IRS1/PI3K/AKT信号通路的活性,增强其蛋白磷酸化的水平。加味水陆二仙丹可提高外周组织对葡萄糖的利用率,具体表现为抑制IRS-1丝氨酸307信号通路(Ser307)磷酸化,并通过IRS-1/PI3K/GLUT4介导的信号途径,促进GLUT4转位至细胞膜上,增加细胞膜GLUT4含量[43]。
4.4 促进脂肪酸分解
机体游离脂肪酸(FFA)水平过高是导致高胰岛素血症及心脏功能损害的危险因素之一,调控脂质合成[脂肪酸合成酶(FAS)]、转运[脂肪酸转位酶(FAT)/CD36和长链脂酰辅酶A(LccoAs)]和氧化[肉碱脂酰转移酶(CPT-1)]等脂解过程中有关酶的活性以及相关因子的表达可降低高胰岛素血症及心脏功能损害。氧化苦参碱从抑制脂质合成、转运、氧化3个方面减少FFA含量[44]。此外内源性三酰甘油也可分解成FFA,而氧化苦参碱还可以通过上调β-klotho蛋白、成纤维细胞生长因子21(FGF-21)受体1的mRNA及蛋白表达,进而减少三酰甘油向FFA的转化。黄连素可上调2型糖尿病模型大鼠內脏脂肪组织解偶联蛋白1(UCP-1)的mRNA表达,下调FAS、乙酰辅酶 A 羧化酶(ACC)和CPT-1 mRNA的表达促进脂解过程[45]。糖脉康可降低病人体内的FFA,调节血脂代谢。脂肪酸氧化增强又可促进PKC及GIUT4摄取葡萄糖的能力,从而加强心脏能供,改善心功能[46]。
4.5 其他
除了單用或联合使用中药治疗外,针灸、穴位贴敷治疗在改善高胰岛素血症及心力衰竭方面也有显著效果。Yu等[47]研究发现,针刺三阴交、血海等可以提高胰岛素的敏感性。肖凤英等[48]报道,电针内关穴可降低线粒体钙离子转运,有效减少心肌细胞凋亡。有研究表明,电针足三里、关元、中脘和丰隆可以减少TNF-α、IL-6等炎症介质介导的炎症反应,从而保护心功能[49]。灸法可通过对下丘脑-垂体-肾上腺轴调控胰岛素的分泌。
5 小 结
人们长期不良的生活方式及饮食习惯导致糖尿病现已成为损害国人身体健康的四大慢性疾病之一。众所周知糖尿病可引发累及全身多个系统微血管和大血管的并发症,对医疗系统造成极大的负担,因此,糖尿病的治疗追求综合管理,不仅要防止微血管病变,更要预防心脑血管等危及生命的大血管并发症的形成。现代医学证明在糖尿病导致心力衰竭的发病过程中高胰岛素血症引发的一系列不良影响起着主要作用,而不是既往认为的高血糖。这表明不考虑高胰岛素血症的影响而单纯降低血糖的治疗会增加并发心力衰竭的风险,这违背了糖尿病治疗综合管理的要求。基于高胰岛素血症的机制研究为中西医针对相应途径、靶点进行精准治疗提供了新的方向,但目前关于高胰岛素血症在糖尿病伴心力衰竭中的研究较少,很多研究并未区分是高血糖还是高胰岛素导致的具体生理病理改变,而且各个环节的作用及分子机制并未完全阐明。加之中医研究主要是基于临床观察与实验研究提出的,缺乏明确的具体微观分子方面的研究,所以完全实现中西医针对相关靶点的治疗有一定的难度。立足于现代医学技术,进一步研究高胰岛素血症在心力衰竭中的作用机制,从微观层面探析中西药与相关途径靶点的关联性,是早日实现精准治疗、降低毒副作用的关键。
参考文献:
[1]KONDURACKA E,CIESLIK G,GALICKA-LATALA D,et al.Myocardial dysfunction and chronic heart failure in patients with long-lasting type 1 diabetes:a 7-year prospective cohort study[J].Acta Diabetologica,2013,50(4):597-606.
[2]CASTAGNO D,BAIRD-GUNNING J,JHUND P S,et al.Intensive glycemic control has no impact on the risk of heart failure in type 2 diabetic patients:evidence from a 37,229 patient meta-analysis[J].American Heart Journal,2011,162(5):938-948.e2.
[3]LAGO R M,SINGH P P,NESTO R W.Congestive heart failure and cardiovascular death in patients with prediabetes and type 2 diabetes given thiazolidinediones:a meta-analysis of randomised clinical trials[J].The Lancet,2007,370(9593):1129-1136.
[4]INGELSSON E,SUNDSTRM J,RNLV J,et al.Insulin resistance and risk of congestive heart failure[J].JAMA,2005,294(3):334.
[5]DUTTA D,XU J Z,KIM J S,et al.Upregulated autophagy protects cardiomyocytes from oxidative stress-induced toxicity[J].Autophagy,2013,9(3):328-344.
[6]KRZYSIAK T C,THOMAS L,CHOI Y J,et al.An insulin-responsive sensor in the SIRT1 disordered region binds DBC1 and PACS-2 to control enzyme activity[J].Molecular Cell,2018,72(6):985-998.e7.
[7]PAULA-GOMES S,GONALVES D A,BAVIERA A M,et al.Insulin suppresses atrophy- and autophagy-related genes in heart tissue and cardiomyocytes through AKT/FOXO signaling[J].Hormones et Metabolisme,2013,45(12):849-855.
[8]SU M,CHEN Z G,WANG C X,et al.Cardiac-specific overexpression of miR-222 induces heart failure and inhibits autophagy in mice[J].Cellular Physiology and Biochemistry,2016,39(4):1503-1511.
[9]ANZAWA R,SEKI S,NAGOSHI T,et al.The role of Na+/H+ exchanger in Ca2+ overload and ischemic myocardial damage in hearts from type 2 diabetic db/db mice[J].Cardiovascular Diabetology,2012,11:33.
[10]NAKAMURA T Y,IWATA Y,ARAI Y,et al.Activation of Na+/H+ exchanger 1 is sufficient to generate Ca2+ signals that induce cardiac hypertrophy and heart failure[J].Circulation Research,2008,103(8):891-899.
[11]BAARTSCHEER A,SCHUMACHER C A,VAN BORREN M M G J,et al.Chronic inhibition of Na+/H+-exchanger attenuates cardiac hypertrophy and prevents cellular remodeling in heart failure[J].Cardiovascular Research,2005,65(1):83-92.
[12]YANG J,GILLINGHAM A K,HODEL A,et al.Insulin-stimulated cytosol alkalinization facilitates optimal activation of glucose transport in cardiomyocytes[J].American Journal of Physiology Endocrinology and Metabolism,2002,283(6):E1299-E1307.
[13]INOUE B H,DOS SANTOS L,PESSOA T D,et al.Increased NHE3 abundance and transport activity in renal proximal tubule of rats with heart failure[J].American Journal of Physiology-Regulatory,Integrative and Comparative Physiology,2012,302(1):R166-R174.
[14]LTKEN S C,KIM S W,JONASSEN T,et al.Changes of renal AQP2,ENaC,and NHE3 in experimentally induced heart failure:response to angiotensin Ⅱ AT1 receptor blockade[J].American Journal of Physiology Renal Physiology,2009,297(6):F1678-F1688.
[15]ZHU A H,CUI B,DANG H D,et al.Correlation of abdominal fat distribution with different types of diabetes in a Chinese population[J].Journal of Diabetes Research,2013,2013:1-5.
[16]GRANT R W,DIXIT V D.Adipose tissue as an immunological organ[J].Obesity,2015,23(3):512-518.
[17]PACKER M.Leptin-aldosterone-neprilysin axis:identification of its distinctive role in the pathogenesis of the three phenotypes of heart failure in people with obesity[J].Circulation,2018,137(15):1614-1631.
[18]NA T,DAI D Z,TANG X Y,et al.Upregulation of leptin pathway correlates with abnormal expression of SERCA2a,phospholamban and the endothelin pathway in heart failure and reversal by CPU86017[J].Naunyn-Schmiedeberg′s Archives of Pharmacology,2007,375(1):39-49.
[19]HUBY A C,ANTONOVA G,GROENENDYK J,et al.Adipocyte-derived hormone leptin is a direct regulator of aldosterone secretion,which promotes endothelial dysfunction and cardiac fibrosis[J].Circulation,2015,132(22):2134-2145.
[20]RICHARDSON T L Jr,HACKSTADT A J,HUNG A M,et al.Hospitalization for heart failure among patients with diabetes mellitus and reduced kidney function treated with metformin versus sulfonylureas:a retrospective cohort study[J].Journal of the American Heart Association,2021,10(8):e019211.
[21]HUYNH T,HARTY B J,CLAGGETT B,et al.Comparison of outcomes in patients with diabetes mellitus treated with versus without Insulin+Heart failure with preserved left ventricular ejection fraction (from the TOPCAT study)[J].The American Journal of Cardiology,2019,123(4):611-617.
[22]ZOU C Y,LIU X K,SANG Y Q,et al.Effects of SGLT2 inhibitors on cardiovascular outcomes and mortality in type 2 diabetes:a meta-analysis[J].Medicine,2019,98(49):e18245.
[23]VERMA S,BHANOT S,MCNEILL J H.Antihypertensive effects of metformin in fructose-fed hyperinsulinemic,hypertensive rats[J].The Journal of Pharmacology and Experimental Therapeutics,1994,271(3):1334-1337.
[24]薛汝月,刘新宇.基于促代谢因子探讨卡格列净对2型糖尿病胰岛素抵抗的影响[J].重庆医学,2022,51(9):1524-1529.
[25]冯珍凤,胡春平,刘曼曼,等.健脾化湿汤治疗非糖尿病高胰岛素血症临床观察[J].河南中医,2020,40(12):1855-1858.
[26]代芳.清热解毒法对2型糖尿病胰岛素抵抗的影响[C].贵阳:2014年中西医结合内分泌学术会议论文集,2014:105-109.
[27]郑华,戈延茹.改善胰岛素抵抗的中药活性成分及其作用机制研究进展[J].中国中药杂志,2010,35(4):531-535.
[28]徐健,卢学春,段懿涵,等.复方北冬虫夏草提取工艺及其对链尿佐菌素诱导1型糖尿病大鼠的降血糖作用研究[J].食品工业科技,2020,41(19):332-338.
[29]张明丽,陈吉全,周新强.泽泻多糖对2型糖尿病大鼠胰岛素抵抗及脂代谢紊乱的改善作用及机制研究[J].中国药房,2018,29(1):42-45.
[30]王婷,范益.何首乌二苯乙烯苷对2型糖尿病大鼠骨骼肌胰岛素抵抗的影响[J].中国医药导报,2016,13(14):25-28;56.
[31]刘江,童智,张再超,等.山楂叶总黄酮防治大鼠胰岛素抵抗及脂肪肝的实验研究[J].华东师范大学学报(自然科学版),2008(6):127-132.
[32]阮耀,岳兴如,徐持华,等.黄芪对早期糖尿病大鼠心肌非酶糖基化及氧化应激反应的影响[J].中药药理与临床,2008,24(1):47-49.
[33]吴华英,夏帅帅,黄惠勇,等.加味生脉补心丹对2型糖尿病大鼠心肌损伤的保护作用[J].湖南中医药大学学报,2019,39(4):453-458.
[34]赵滋苗,蔡宛如,陆军,等.大黄素对脓毒症大鼠血糖和胰岛素抵抗的影响[J].中国现代应用药学,2016,33(9):1115-1118.
[35]侯庆宁,何兰杰.枸杞多糖对2型糖尿病大鼠血糖、血脂及TNF-α水平的影响[J].宁夏医学杂志,2009,31(3):201-203.
[36]陈文学,杨铭,于德伟,等.人参糖肽对糖尿病气阴两虚证大鼠降血糖作用及其机制研究[J].中国药学杂志,2014,49(21):1903-1907.
[37]杨建文,聂绪强,史海霞,等.吴茱萸次碱对胰岛素抵抗骨骼肌细胞炎症因子表达的影响[J].中国中药杂志,2014,39(15):2930-2935.
[38]SUN C,ZHANG F,GE X J,et al.SIRT1 improves insulin sensitivity under insulin-resistant conditions by repressing PTP1B[J].Cell Metabolism,2007,6(4):307-319.
[39]玛依努尔·斯买拉洪,赵翠霞,阿力木卡特尔,等.补气健脾化痰法对2型糖尿病脾虚痰湿证患者胰岛素抵抗、血脂及炎性因子的影响研究[J].中医药导报,2015,21(22):51-52.
[40]颜青.防己黄芪汤对小鼠3T3-L1前脂肪细胞分化及炎症因子基因表达的影响[D].银川:宁夏医科大学,2017.
[41]王超,张会欣,邢邯英,等.氧化苦参碱改善高脂诱导ApoE-/-小鼠的胰岛素抵抗[J].中国病理生理杂志,2016,32(11):2010-2014.
[42]黎梓霖.麦冬寡糖调控PI3K/Akt胰岛素信号通路改善2型糖尿病胰岛素抵抗作用机制研究[D].广州:广州中医药大学,2021.
[43]蔡晟宇.基于IRS-1/PI3K/GLUT4通路观察加味水陆二仙丹对2型糖尿病胰岛素抵抗的影响[D].北京:北京中医药大学,2016.
[44]王杏,王超,宋光耀,等.氧化苦参碱对高脂诱导胰岛素抵抗ApoE-/-小鼠肝脏脂代谢相关基因的影响[J].中国药理学通报,2015,31(12):1688-1692.
[45]李国生,刘栩晗,李欣宇,等.黄连素调节BMP4转录通路基因表达改善2型糖尿病地鼠内脏白色脂肪组织胰岛素抵抗的研究[J].中国中药杂志,2016,41(3):514-520.
[46]袁群,俞璐,邵致格,等.糖脉康颗粒对2型糖尿病患者胰岛素敏感性的临床疗效观察[J].中国临床药理学杂志,2015,31(12):1099-1102.
[47]YU L Q,LIAO Y J,WU H G,et al.Effects of electroacupuncture and Chinese kidney-nourishing medicine on polycystic ovary syndrome in obese patients[J].Journal of Traditional Chinese Medicine,2013,33(3):287-293.
[48]肖凤英,崔金涛,张压西,等.电针内关穴对糖尿病心肌病大鼠线粒体Ca2+转运及心肌细胞凋亡效应的影响[J].国际中医中药杂志,2014,36(6):544-546.
[49]陈丽.电针调控下丘脑SIRT1/NF-κB信号通路改善ZDF大鼠胰岛素抵抗的机制研究[D].武汉:湖北中医药大学,2016.
(收稿日期:2022-08-10)
(本文编辑郭怀印)
基金项目 山东省自然科学基金项目(No.ZR2020QH333);山东省老年医学学会2021年度科技发展计划项目(No.LKJGG2021W107);山东省中医药科技发展计划项目(2019—2020年)(No.2019-0080)
通讯作者 曹斌,E-mail:cb.0412@163.com
引用信息 任啟珣,丛丛,白玉涵,等.高胰岛素血症对糖尿病伴心力衰竭作用机制的中西医研究进展[J].中西医结合心脑血管病杂志,2024,22(1):109-113.

