超高效液相色谱-串联质谱法测定人血清康替唑胺浓度及其临床应用
金 洁 罗敬铭 范旭东 蔡鑫君
康替唑胺属于新一代恶唑烷酮类抗菌药物,其抗菌机制与利奈唑胺相同,可以与细菌的核糖体结合,阻止细菌蛋白质的合成,从而抑制细菌生长,临床上多用于多重耐药的革兰氏阳性球菌如耐甲氧西林金黄色葡萄球菌和耐万古霉素肠球菌的治疗[1-3]。有研究报道,康替唑胺的骨髓抑制,造成三系下降的不良反应低于利奈唑胺,但因其上市时间短,仍有待于更长时间的监测[4]。超高效液相色谱-串联质谱法(ultra-high-performance liquid chromatography coupled with tandem mass spectro-metry,UPLC-MS/MS)作为一种高度敏感性和选择性的检测方法,具有检测速度快,灵敏度高,不要求被分析物峰完全分离,样本需求量更少等优势,被广泛用于血药浓度监测[5-7]。本研究旨在开发一种高效、快速、准确的UPLC-MS/MS,用于测定人血清中康替唑胺浓度。
1 材 料
1.1 主要仪器 UPLC-MS/MS 系统由Xevo TQ-S IVD 三重四极杆质谱仪和ACQUITY UPLC I-Class超高效液相色谱系统(Waters Corporation,MLF,USA)组成,Eppendorf 5425R 高速冷冻离心机(德国),Heal Force SMART-N 超纯水仪(香港)。
1.2 试剂和标准品 甲醇、乙腈(美国Supelco 公司,质谱级),乙腈(美国Honeywell 公司,HPLC 级),甲酸(上海Macklin 公司,质谱级),色谱柱(ZORBAX PRHD SB-Aq,3×50 mm,1.8 μm,美国安捷伦公司)。标准物质康替唑胺(上海盟科药业股份有限公司),内标物质利奈唑胺-D3(Bepure 有限公司)。
2 方 法
2.1 色谱与质谱条件 流动相A 为0.1%甲酸水,流动相B 为甲醇,流速为0.3 mL/min,柱温为40 ℃,检测时间为5 min,进样量为3 μL,梯度洗脱程序见表1。

表1 梯度洗脱程序
质谱离子源为电喷雾离子源,质谱扫描模式为正离子模式(ESI,MS+)。电压设定为3.00 kV。解吸气体温度和流速为500 ℃,900 L/Hr。锥形气体流速为150 L/Hr,喷雾气体压力设定为7.00 Bar,碰撞气体的流速为0.16 mL/min。具体参数见表2。

表2 质谱检测参数
2.2 标曲、质控及内标工作液的制备 精密称取适量的康替唑胺标准品和利奈唑胺-D3 内标物,分别溶于甲醇-水溶液(50%,v/v)和甲醇中,配制浓度均为1 mg/mL 的储备液。以甲醇-水溶液(50%,v/v)为稀释剂,配制康替唑胺含量分别为500、400、250、100、50、10、5、2.5 μg/mL 的标曲工作液。取1 mg/mL的利奈唑胺-D3 储备液10 μL 加入到9.99 mL 的甲醇溶液中,配制1.00 μg/mL 的内标工作液。
按照上述方法,制备四个浓度水平的质控工作液,分别为定量下限(LLOQ,2.5 μg/mL)、低浓度质控(LQC,5 μg/mL)、中浓度质控(MQC,100 μg/mL)、高浓度质控(HQC,400 μg/mL)。
2.3 样本的处理 取空白血清样本45 μL 加入所需工作液5 μL 或临床血清样本50 μL 于1.5 mL 离心管中,加入内标工作液200 μL。涡旋混匀后在4 ℃,12 000 r/min 条件下离心5 min。取20 μL 的上清液转移到1.5 mL 离心管中,加入780 μL 的甲醇-水溶液(50%,v/v),涡旋混匀1 min 后取100 μL 样品溶液于进样瓶进行UPLC-MS/MS 分析。
2.4 方法学考察
2.4.1 专属性 按照“2.3”下方法处理6 个不同来源的血清分别制备空白基质样品,按照“2.2”下的方法制备康替唑胺LLOQ 浓度的质控样品;按照“2.1”下的方法进行分析。将空白基质样品的响应值和LLOQ样品的响应值进行比较,空白基质样品中康替唑胺的响应值不能超过LLOQ 样品中响应值的20%,内标则不能超过5%。
2.4.2 标准曲线 按照“2.2”下的方法制备梯度稀释的标曲工作液,通过将分析物的峰面积和内标面积之比和样品标称浓度进行线性回归,建立标准曲线。
2.4.3 准确度、精密度和回收率 建立4 个浓度水平质控样品(LLOQ、LQC、MQC、HQC),每个质控样品重复6 次,在3 d 内进行至少3 批次的分析,用来验证批次内和批次间的准确度、精密度和回收率。
2.4.4 基质效应和残留效应 选取两个浓度水平质控样品(LQC 和HQC)验证基质效应。采用不同来源的血清制备多个空白基质样本(n=3),将它们与不含基质的样品(n=3)做对比。由此计算出内标归一化基质效应因子。
为了验证残留效应,连续进样3 次HQC 样品后,立即进样1 次空白基质样品,重复多次。空白基质样品中的康替唑胺信号应当小于LLOQ 水平的20%,内标信号应当小于5%。
2.4.5 稳定性 不同条件下,对人血清和最终提取物中康替唑胺的稳定性进行测试。考察高、低质控样品(n=3)在常温下放置6 h 和4 ℃下放置24 h 的稳定性。最终提取物在自动进样条件下(4 ℃)保存24 h,测试最终提取物在高、低质控水平的稳定性。通过分析3 次冻融后高、低质控的浓度,测定未处理样品的冻融稳定性。对于所有的稳定性实验,高、低质控的精密度≤15%,准确度≤15%。
2.5 临床应用 收集9 份临床血清样本,按照“2.3”项下操作,取上清液经UPLC-MS/MS 分析,检测样本中康替唑胺的浓度。
3 结 果
3.1 专属性 康替唑胺和利奈唑胺-D3 的出峰时间均为2.25 min 左右(见图1A~E)。专属性结果显示,空白基质样品中康替唑胺色谱峰响应极低,不存在造成干扰的内源性物质(见图1A)。各组质控样品重复性良好,峰形清晰,无前沿或拖尾(见图1B~E)。

图1 康替唑胺空白基质样品(A),标准品的定量下限、低、中、高浓度质控样本(B~E)的色谱图
3.2 标准曲线 经过验证,康替唑胺的回归方程为y=0.193*x+0.020(R2=0.997),在0.25~50 μg/mL 的浓度范围内线性良好,定量下限为0.25 μg/mL。
3.3 精密度、准确度及回收率试验 康替唑胺的批内和批间准确度、精密度见表3。结果显示,各项质控指标均符合相关要求。在三批(n=6)样品中,LLQC 回收率在88.20%~108.90%之间;LQC 回收率在96.30%~108.20%之间;MQC 回收率在98.90%~104.70%之间;HQC 回收率在98.70%~104.90%之间。
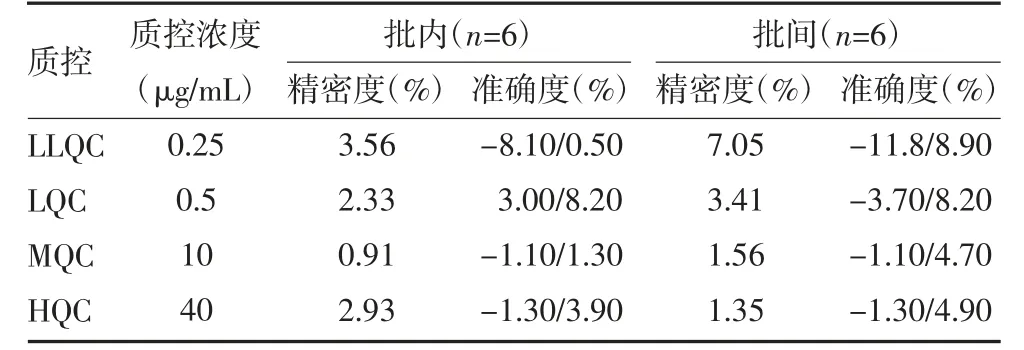
表3 康替唑胺批内和批间准确度和精密度
3.4 基质效应和残留效应 在LQC 和HQC 上,使用6 个不同来源的基质制备的样品来评估基质效应。LQC 下,康替唑胺的基质效应因子为(0.93±0.02),而HQC 下,则为(1.09±0.01)。
在最高浓度的质控样品进样后,空白基质样品中的康替唑胺峰面积占LLOQ 峰面积的(12.70±1.15)%,而内标的信号几乎没有(0.03±0.02)%。因此,可以认为该分析方法的残留效应符合要求。
3.5 稳定性 从表4 的稳定性结果可以看到,在不同的储存条件下,康替唑胺在人血清和最终提取物中都是稳定的。

表4 康替唑胺的稳定性
3.6 临床应用 将建立并完成验证的检测方法成功用于9 例临床患者康替唑胺血药浓度测定,其中有4例患者血清样本的康替唑胺浓度低于检测的LLQC,其余样本的康替唑胺检测浓度为1.10~8.99 μg/mL之间,检测浓度与临床预测结果相符,表明该检测方法可以用于治疗药物浓度监测(therapeutical drug monitoring,TDM)和药代动力学研究。
4 讨 论
本研究开发并且验证了一种用于检验康替唑胺血清药物浓度的方法。我们选择利奈唑胺-D3 作为内标物是基于康替唑胺和利奈唑胺-D3 具有类似的化学结构,但是具有不同的质荷比,这一内标良好地补偿了液相色谱串联质谱检测法中信号漂移的问题,即使康替唑胺和利奈唑胺-D3 的出峰时间同为2.25 min,但是仍能保证两者被有效区分出来。
本研究中采用的UPLC-MS/MS 方法需要的样本量少,只需要50 μL 血清就可以达到检测要求。样品只需加入含有定量内标的甲醇,沉淀蛋白质后离心稀释,该处理方法简单易行,且检测时间仅需要5 min,方便快捷。同时,由于康替唑胺作为新型恶唑烷酮类抗菌药物,临床应用不多,其有效的血药浓度范围有待进一步研究,本研究中设置了康替唑胺线性范围为0.25~50 μg/mL,以便开展临床研究。综上所述,我们开发的康替唑胺血药浓度分析方法能够在TDM实验室中开展,适用于在重症监护室治疗的患者及特殊患者人群如老年人、合并慢性病的患者,也适用于药代动力学研究。

