葶苈大枣泻肺汤对急性肺损伤小鼠PTEN/PI3K/AKT通路的影响*
张成浠,李小茜,高丹,汪顺,朱华贺,谭波,杨爱东
1.上海中医药大学,上海 201203; 2.上海市重大传染病和生物安全研究院中医药疫病研究中心,上海 200032;3.复旦大学附属华山医院,上海 200040; 4.上海中医药大学附属曙光医院,上海 201203
葶苈大枣泻肺汤首载于《金匮要略》,该方由葶苈子、大枣两味中药组成,具有泻肺行水、下气平喘之功[1]。临床研究表明,葶苈大枣泻肺汤能够通过减轻炎症反应、提高氧合指数,显著提升严重肺挫伤所致急性呼吸窘迫综合征(acute respiratory distress syndrome,ARDS)的抢救成功率[2]。此外,该方可有效缓解肺脓肿患者的临床症状,改善肺功能,并降低炎症反应程度[3]。
在急性肺损伤(acute lung injury,ALI)/ARDS中,脂多糖(lipopolysaccharide,LPS)等外源性刺激可通过激活磷酸酶与张力蛋白同源物(phosphatase and tension homology,PTEN)/磷脂酰肌醇-3-激酶(phosphatidylinositol-3-hydroxykinase,PI3K)/蛋白激酶B(protein kinase B,AKT)等信号通路,引发肺部炎症反应、细胞凋亡和肺泡上皮细胞损伤等病理改变[4]。研究表明,葶苈大枣泻肺汤治疗儿童肺炎的作用机制可能与调控PI3K/AKT、肿瘤坏死因子(tumor necrosis factor,TNF)等信号通路有关[5]。此外,该方治疗新型冠状病毒感染的机制可能与抑制促炎因子表达与细胞因子风暴、减轻肺部炎症损伤有关[6]。葶苈大枣泻肺汤治疗ALI是否与调控PI3K/AKT信号通路有关,有待进一步研究[7]。因此,本实验通过建立小鼠ALI模型,观察葶苈大枣泻肺汤对模型小鼠肺组织病理学、炎症因子及PTEN/PI3K/AKT信号通路的影响。
1 材料
1.1 动物C57BL/6J雄性小鼠30只,6~8周龄,体质量18~20 g,购自西普尔-必凯实验动物有限公司。所有小鼠饲养于上海中医药大学动物实验中心SPF级屏障系统,许可证号:SYXK(沪) 2020-0009,温度25~27 ℃,湿度40%~60%,自由进食和饮水。动物实验由上海中医药大学实验动物福利与伦理委员会审核批准,伦理编号为PZSHUTCM220613025。
1.2 药物与试剂葶苈大枣泻肺汤颗粒(一方制药有限公司,批号:A12388);地塞米松磷酸钠注射液(辰欣药业股份有限公司,批号:H37021969);LPS(默克公司,货号:L2880);白细胞介素-1β(interleukin 1β,IL-1β)、白细胞介素-6(interleukin 6,IL-6)、肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)试剂盒(威奥生物科技有限公司,货号:EM30300M、EM30325M、EM30536M);EZB组织RNA提取试剂盒(英泽生物医药科技有限公司,货号:RN001-plus);RT逆转录试剂盒、TB Green定量试剂盒(日本TAKARA,货号:RR036A、RR420A);BCA蛋白定量试剂盒(雅酶生物科技有限公司,货号:ZJ102);PI3K抗体、p-AKT抗体、AKT抗体、PTEN抗体、β-actin抗体(Cell Signaling Technology公司,货号:4249、4060、4691、9188、4970);羊抗兔IgG二抗、蛋白酶磷酸酶抑制剂混合物、RIPA裂解缓冲液、ECL化学发光试剂盒(碧云天生物科技有限公司,货号:A0208、P1045、P0013B、P0018FM)。
1.3 仪器3K15型低温冷冻离心机(Sigma);BH2型显微镜(Olympus);680型多功能酶标仪(Bio-Rad);实时荧光定量PCR仪(Roche,型号:LightCycler96);SDS-PAGE电泳仪、化学发光成像系统(Bio-Rad,型号:MINI Protean2、ChemiDoc MP)。
2 方法
2.1 药物制备葶苈大枣泻肺汤:取葶苈大枣泻肺汤颗粒剂,用适量生理盐水溶解,配成质量浓度为0.585 g·L-1、1.17 g·L-1的药液。地塞米松药液:取地塞米松磷酸钠注射液,用生理盐水稀释成质量浓度为1 g·L-1的药液[8]。LPS溶液:取适量LPS粉末,加入无菌PBS溶液,配成质量浓度为 2 g·L-1的溶液。
2.2 分组、造模及给药适应性喂养1周后,将30只C57BL/6J小鼠随机分为正常组、模型组、葶苈大枣泻肺汤低剂量组、葶苈大枣泻肺汤高剂量组、地塞米松组(5 mg·kg-1),每组6只。基于人和动物体表面积,按照成人(70 kg)每日葶苈大枣泻肺汤生药量45 g换算得出小鼠的等效剂量为5.85 g·kg-1,因此确定低剂量组、高剂量组的灌胃剂量分别为5.85 g·kg-1、11.70 g·kg-1。各药物组按照相应剂量灌胃给药,正常组和模型组灌胃等体积生理盐水,每日1次,连续7 d。末次灌胃2 h后,除正常组外,其余各组小鼠腹腔注射LPS溶液(20 mg·kg-1)建立急性肺损伤模型,造模8 h后取材。
2.3 样本制备异氟烷麻醉小鼠,体积分数75%酒精消毒,充分暴露气管并作一字型切口,将导管插入气管后使用尼龙绳固定,注入生理盐水进行灌洗,留取支气管肺泡灌洗液,置于-80 ℃冰箱保存[9]。取小鼠肺组织,使用4%多聚甲醛溶液固定用于制备切片,新鲜组织置于-80 ℃冰箱保存备用。
2.4 HE染色观察肺组织病理学改变取4%多聚甲醛固定的肺组织,固定24 h后取出换液,梯度酒精脱水,二甲苯透明,组织浸蜡包埋,制备石蜡切片(4 μm);切片采用HE染色,显微镜下观察肺组织病理学形态并拍照[10]。
2.5 ELISA检测肺泡灌洗液 IL-1β、IL-6、TNF-α含量取小鼠支气管肺泡灌洗液,3 000 r·min-1离心5 min,取上清液。按照ELISA试剂盒说明书的步骤,使用多功能酶标仪检测样品和标准品在450 nm波长下的光密度(optical density,OD)值,绘制标准曲线,进而计算样品中IL-1β、IL-6、TNF-α 含量。
2.6 RT-qPCR检测肺组织IL-6、TNF-α、信号转导和转录激活因子3(signal transducer and activator of transcription 3,STAT3)、细胞因子信号转导抑制因子3(suppressors of cytokine signaling 3,SOCS3)基因表达水平根据EZB试剂盒说明书提取小鼠肺组织总RNA;按照RT逆转录试剂盒说明书的步骤将RNA逆转录为cDNA(设定参数为:42 ℃ 2 min,37 ℃ 15 min,85 ℃ 5 s);使用TB Green定量试剂盒进行RT-PCR实验(设定参数为:95 ℃ 30 s,95 ℃ 5 s,60 ℃ 34 s);最后,采用实时荧光定量PCR仪上机检测。采用2-ΔΔCT法计算目的基因的相对表达水平,以GAPDH作为内参基因[11]。引物由上海生工生物工程有限公司合成,引物序列见表1。

表1 引物序列
2.7 Western Blot检测肺组织PI3K、p-AKT/AKT、AKT、PTEN蛋白表达水平每组随机取3只小鼠肺组织,加入适量裂解液匀浆,提取总蛋白;采用BCA法进行蛋白定量[12],95 ℃加热使蛋白变性;配置10%分离胶、5%浓缩胶,上样,电泳(80 V,120 min),转膜(250 mA,80 min),封闭10 min。加入一抗(PI3K、AKT、PTEN浓度均为11 000,p-AKT浓度为12 000),4 ℃孵育过夜;TBST洗膜3次,每次10 min;二抗(11 000)室温孵育1 h;TBST洗膜3次,每次10 min;配置ECL化学发光液,凝胶成像系统曝光并显影。采用Image J 软件分析蛋白条带的灰度值,以目的蛋白与内参蛋白的灰度值比值作为目的蛋白的相对表达量。

3 结果
3.1 各组小鼠肺组织病理学变化比较正常组小鼠肺组织未见明显病理性改变;模型组小鼠可见间质性肺炎和出血;与模型组比较,葶苈大枣泻肺汤低剂量组、高剂量组小鼠的间质性肺炎、出血情况减轻;地塞米松组小鼠肺组织未见明显病理性改变,见图1。

注:A:正常组;B:模型组;C:葶苈大枣泻肺汤低剂量组;D:葶苈大枣泻肺汤高剂量组;E:地塞米松组。
3.2 各组小鼠肺泡灌洗液炎症因子含量比较与正常组比较,模型组小鼠肺泡灌洗液IL-1β、IL-6、TNF-α含量均升高(P<0.01);与模型组比较,地塞米松组小鼠肺泡灌洗液IL-1β、IL-6、TNF-α 含量均降低(P<0.01),葶苈大枣泻肺汤低剂量组、高剂量组小鼠肺泡灌洗液IL-1β、IL-6、TNF-α含量均降低(P<0.01),见表2。

表2 各组小鼠支气管肺泡灌洗液炎症因子含量比较
3.3 各组小鼠肺组织IL-6、TNF-α、STAT3、SOCS3基因表达水平比较与正常组比较,模型组小鼠肺组织IL-6mRNA、TNF-αmRNA、STAT3mRNA、SOCS3mRNA水平均升高(P<0.01);与模型组比较,地塞米松组小鼠肺组织IL-6mRNA、TNF-αmRNA、STAT3mRNA、SOCS3mRNA水平均降低(P<0.01),葶苈大枣泻肺汤低剂量组、高剂量组小鼠肺组织IL-6mRNA、TNF-αmRNA、STAT3mRNA、SOCS3mRNA水平均降低(P<0.05),见表3。
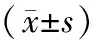
表3 各组小鼠肺组织IL-6、TNF-α、STAT3、SOCS3基因表达水平比较
3.4 各组小鼠肺组织PI3K、AKT、p-AKT/AKT、PTEN蛋白表达水平比较与正常组比较,模型组小鼠肺组织PI3K、p-AKT/AKT蛋白表达水平升高(P<0.01);与模型组比较,地塞米松组小鼠肺组织PI3K、p-AKT/AKT蛋白表达水平降低(P<0.01),葶苈大枣泻肺汤低剂量组、高剂量组小鼠肺组织PI3K、p-AKT/AKT蛋白表达水平降低(P<0.01)。与正常组比较,模型组小鼠肺组织PTEN蛋白表达水平降低(P<0.01);与模型组比较,地塞米松组小鼠肺组织PTEN蛋白表达水平升高(P<0.01),葶苈大枣泻肺汤低剂量组、高剂量组小鼠肺组织PTEN蛋白表达水平升高(P<0.05),见表4、图2。

注:A:正常组;B:模型组;C:葶苈大枣泻肺汤低剂量组;D:葶苈大枣泻肺汤高剂量组;E:地塞米松组。
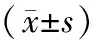
表4 各组小鼠肺组织PI3K、AKT、p-AKT/AKT、PTEN蛋白表达水平比较
4 讨论
ALI在中医学归属于“喘证”“暴喘”“喘脱”等疾病范畴[13]。当外在邪气侵袭人体时,五脏之中肺脏最易受邪。《素问·六节藏象论》云:“肺者,气之本”,《素问·阴阳应象大论》曰:“天气通于肺”[14],《医门法律》曰:“肺主一身之气”。在 ALI 发展过程中,肺主治节与通调水道的功能发生障碍,气血津液无法正常输布,导致痰浊邪气壅滞体内,邪实气逆,进而导致肺气壅滞。临床主要表现为进行性呼吸困难,严重者出现鼻翼煽动,喘息不得卧。因此,痰浊壅滞、肺气壅塞是 ALI 的关键病机[15],治宜泻肺祛痰、下气平喘,方选葶苈大枣泻肺汤[16]。
PI3K/AKT信号通路位于哺乳动物雷帕霉素靶蛋白(mammalian target of rapamycin,mTOR)信号通路上游,其中关键蛋白PI3K、AKT在ALI的发生发展中具有重要作用。AKT可通过mTOR途径调节细胞生长和细胞凋亡[17],还可通过其下游核因子-κB(nuclear factor-kappa B,NF-κB)信号通路调节细胞炎症反应[18]。抑癌基因PTEN可通过去磷酸化磷脂酰肌醇-3-磷酸(phosphatidylinositol-3-phosphate,PI3P)抑制AKT活性[19]。既往研究表明,PI3K/AKT信号通路可能与LPS所致大鼠肺组织损伤改善有关[20]。
Janus激酶2(Janus kinase 2,JAK2)/STAT3、PI3K/AKT信号通路与急性肺损伤密切相关[21]。JAK/STAT信号通路是IL-6激活的关键信号途径之一,其中JAK/STAT3信号通路在细胞因子刺激下激活,并参与细胞增殖和炎症基因的调控[22]。研究表明,在小鼠ALI模型中,STAT3磷酸化显著增加,引发下游蛋白酪氨酸磷酸酶2(Src homology region 2-containing protein tyrosine phosphatase 2,SHP2)磷酸化,以及SOCS3表达上调,激活促炎因子从而诱发ALI[23-24]。通过抑制JAK2/STAT3信号通路传导,以及白细胞介素家族因子释放,可对肺部起到一定的保护作用[25]。
临床研究发现,葶苈大枣泻肺汤联合五虎汤可通过降低血清炎性因子水平,减轻炎症反应,有效缓解支气管肺炎患者的临床症状[26]。此外,加味葶苈大枣泻肺汤可有效改善支气管哮喘患者的肺功能及其预后[27]。研究发现,葶苈子的重要活性成分槲皮素可通过调节Toll样受体4(Toll-like receptor 4,TLR4)/NF-κB信号通路,抑制心肌细胞炎症反应,直接调节心脏一氧化氮代谢,从而减轻心肌损伤[28-29]。此外,葶苈大枣泻肺汤可抑制PI3K/AKT和丝裂原活化蛋白激酶(mitogen-activated protein kinase,MAPK)信号通路激活,在调节炎症反应、抗细胞凋亡、改善能量代谢等方面发挥心脏保护作用,从而改善心功能[30]。
综上所述,葶苈大枣泻肺汤可减轻急性肺损伤小鼠肺组织病变,其机制可能与调控PTEN/PI3K/AKT信号通路,抑制炎症反应有关。

