Mir-106b对阿尔茨海默病昼夜节律调控的初步研究
王海林,刘嘉琳,宗园媛,张连峰,秦 川
(中国医学科学院医学实验动物研究所,北京协和医学院比较医学中心,北京 100021)
阿尔茨海默病(Alzheimer's disease,AD)是一种神经退行性疾病,以进行性痴呆为主要临床表现,同时伴有精神行为异常和明显的社会生活功能减退。超过80%的65岁以上的老年人存在昼夜节律的紊乱[1],如睡眠障碍,在AD病人中这种昼夜节律紊乱的比例更高[2],严重影响着 AD病人的生活质量。哺乳动物的生命节律由位于视交叉上核的生物钟基因调控,NPAS2作为生物钟基因的旁系同源类似物,在哺乳动物的前脑发挥着类似的功能,NPAS2缺陷的小鼠睡眠模式和行为的适应能力发生改变[3]。M icroRNAs(miRNAs)是近年来发现的长约18-25 nt小调节RNAs,通过与靶基因mRNA的3’UTR结合,在转录后水平调节基因的表达。现有的研究表明,microRNAs参与多种生理和病理过程,与AD的发生也密切相关[4,5],但是 m icroRNAs对靶基因的调节作用是否会影响AD病人的生活节律,目前这方面的研究尚未见报道。本实验利用芯片和real time PCR的方法在AD模型小鼠中筛选出表达有差异的 microRNAs,并通过体外实验探讨microRNA是否在 AD病人的昼夜节律紊乱中发挥一定的调节作用。
1 材料和方法
1.1 m icroRNA芯片
μParafloTM microRNA微阵列基因表达实验和分析由LC Sciences公司提供。miRNA探针序列信息来自于Sanger m iRbase Release 9.2版本数据库,每种探针至少重复3次。数据处理和分析首先是扣除背景,计算重复点平均值和标准偏差,然后通过LOWESS(locally-weighted regression)过滤进行标准化。对于双色标记实验,将计算两种检测信号的比值(log2)和t-test的P值,以P <0.01定义显著差异性表达。数据处理结果根据实验设计采用hierarchical clustering、K-means/medians clustering或者ANOVA(analysis of variance)等方法。
1.2 转基因小鼠的鉴定
将转APPswe基因和 PSΔE9基因的双转 C57/ BL6小鼠和野生型 C57/BL6小鼠杂交,提取鼠尾DNA,PCR鉴定 APPswe/PSΔE9双转基因小鼠的基因表型,筛选阳性小鼠进行进一步实验。
1.3 逆转录反应和real tim e PCR
利用m irVanaTMmiRNA Isolation Kit(Ambion)提取6月龄APPswe/PSΔE9双转基因小鼠和同月龄对照小鼠总RNA,在紫外分光光度计上测浓度。利用 m iScript Reverse Transcription Kit(Qiagen)将RNA逆转录为 cDNA。Real-time PCR是利用miScript SYBR Green PCR Kit(Qiagen)进行的,以U6为内参。用delta-delta C(t)的方法和t-test对数据进行分析和统计学处理,以P<0.05定义显著差异性表达。
1.4 m ir-106b表达载体的构建
按照 BLOCK-iTTMPol II m iR RNAi Expression Vector Kit(invitrogen)的说明书进行,简述如下:首先合成 mir-106b的 Top strand oligo(TGCTGTAAA GTGCTGACAGTGCAGATGTTTTGGCCACTGACTGAC ATCTGCACTCAGCACTTTA)和 bottom strand oligo (CCTGTAAAGTGCTGAGTGCAGATGTCAGTCAGTGG CCAAAACATCTGCACTGTCAGCACTTTAC),然后将二者退火结合生成ds oligo,在T4 DNA连接酶的作用下,将ds olig与pcDNATM6.2-GW/EmGFP-miR载体进行连接,把连接好的质粒转化到感受态大肠杆菌中进行扩增,将菌液涂布在 LB培养板上(含50μg/m L壮观霉素),37℃培养过夜,挑取单克隆,进行摇菌测序。阴性对照质粒由试剂盒提供。
1.5 m ir-106b稳转细胞的构建与鉴定
SH-SY5Y细胞用DMEM培养基进行培养,其中添加10%热灭活的胎牛血清和100 U/m L青链霉素,37℃、5%CO2孵箱中培养。转染前1 d将细胞接种到24孔板,换成无抗生素的培养基,转染按照Lipofectamine 2 000(Invitrogen)的说明书进行。转染后6 h将24孔板中的培养基换成全培养基。转染后第2天将24孔板的细胞用胰酶消化下来,按1:10传到60 cm2培养皿中培养,在培养基中添加2 μg/m L的Blasticidin进行筛选。此后,每隔3 d换1次含2μg/m L的 Blasticidin的培养基,连续培养2周,然后在荧光显微镜下挑选带GFP的阳性克隆,进行扩大培养。构建成功后,提取稳转细胞的RNA,逆转成 cDNA后,用 real-time PCR检测 m ir-106b的表达,鉴定mir-106b稳转细胞系的构建是否成功。
1.6 m ir-106b靶基因的预测
用Targetsan、Pictar、miRanda等 microRNA靶基因预测软件,对mir-106b的靶基因进行预测。
1.7 W estern b lot
从稳转细胞中提取总蛋白,蛋白上样量为70 μg,利用10%的SDS-PAGE胶进行分离,然后将其转移至NC膜上,室温下用TBST配制的5%牛奶封闭1 h,与兔多抗NPAS2抗体(abcam)进行杂交,室温下孵育2 h,用TBST洗膜3次,与HRP标记的羊抗兔 IgG和 β-actin进行杂交,室温下孵育 1h,用TBST洗膜3次,然后进行化学发光。
1.8 双荧光素酶报告检测
根据 Targetsan、Pictar、m iRanda等靶基因预测软件,预测mir-106b与NPAS2 3’UTR的结合位点。PCR扩增NPAS2的3’UTR(包含与m ir-106b的预测结合位点并带Xho I和Not I两个酶切位点),将PCR扩增产物克隆到 pMDTM18-T载体,命名为 TNPAS2-3’UTR。突变预测与 mir-106b结合位点的碱基,构建突变的 pMDTM18-T载体.根据 Targetsan的预测,NPAS2与 m ir-106b的结合位点有两个,因此我们分别构建了两个单突变 pMDTM18-T载体和一个双突变pMDTM18-T载体分别命名为T-NPAS2-3’UTR-M1,T-NPAS2-3’UTR-M2,T-NPAS2-3’UTR-2M。psiCHECKTM-2载体(Promega)含有两种荧光素酶:萤火虫荧光素酶和海肾荧光素酶。将所构建的T-NPAS2-3’UTR、T-NPAS2-3’UTR-M1、T-NPAS2-3’ UTR-M2、T-NPAS2-3’ UTR-2M 载 体 与psiCHECKTM-2载体进行Xho I和Not I双酶切实验,将野生型或者含有突变位点的NPAS2的3’UTR克隆至psiCHECKTM-2载体的海肾荧光素酶开放读码框架的下游,构建含 NPAS2-3’UTR及突变的NPAS2-3’UTR的荧光素酶报告载体,分别命名为PNPAS2-3’UTR、P-NPAS2-3’UTR-M1、P-NPAS2-3’UTR-M2、P-NPAS2-3’UTR-2M。将所构建的荧光素酶报告载体与 mir-106b表达载体或者阴性对照载体在HEK-293T细胞进行共转染,转染后48h,用双荧光素酶报告检测试剂盒(Promega)及荧光素酶活性检测仪分别检测萤火虫荧光素酶和海肾荧光素酶的活性,并将海肾荧光素酶的活性用萤火虫荧光素酶的活性进行标准化,比较荧光强度的变化。
2 结果
2.1 芯片结果和real tim e PCR验证的结果
芯片结果显示:与野生型C57BL/6J小鼠相比,6月龄APPswe/PSΔE9小鼠脑组织中mir-106b表达水平明显降低。由于芯片结果存在一定的假阳性,我们用real—time PCR的方法对芯片结果进行进一步验证,选取6月龄APPswe/PSΔE9小鼠6只(雌雄各半)和同月龄的野生型C57BL/6J小鼠6只(雌雄各半),每只重复3次,经t检验结果有统计学差别(P=0.03),采用delta-delta C(t)的方法计算其比值为1.46,与野生型 C57BL/6J小鼠相比,6月龄APPswe/PSΔE9小鼠脑组织中m ir-106b的表达水平升高。6月龄小鼠脑组织中 mir-106b表达情况的real time PCR结果见图1。
2.2 稳转细胞的构建及鉴定结果。
我们构建的mir-106 b表达载体和试剂盒里提供的阴性对照质粒均含有绿色荧光蛋白(GFP)表达结构域,当其转染至细胞后,能够表达GFP,,因此我们可以通过荧光显微镜来观察所构建的稳转细胞的情况。稳转细胞系构建成功后,可见80%以上的细胞均表达GFP(图2,见彩插1)。
Real time PCR检测稳转细胞m ir-106b的表达,共检测了6个m ir-106b稳转细胞克隆(命名为m ir-106b-1、2、3、4、5、6)。用delta-delta C(t)的方法进行计算,我们发现与阴性对照质粒的稳转细胞相比,m ir-106b稳转细胞的m ir-106b的表达升高2~5倍,说明我们的稳转细胞的构建是成功的,real-time PCR的结果见图3。

图1 6月龄小鼠mir-106b表达情况的real time PCR结果Fig.1 The expression level of mir-106b in six-month old mice detected by real-time PCR注:“*”:P<0.05。 note:“*”:P<0.05.

图3 mir-106b稳转细胞系real time PCR鉴定结果Fig.3 The real-time PCR Results of mir-106b stable transfection cell lines
2.3 W estern b lot结果
用提取阴性对照质粒稳转细胞和 mir-106b稳转细胞总蛋白,进行 western blot检测。我们发现,与阴性对照质粒的稳转细胞相比,在m ir-106b稳转细胞中,NPAS2表达水平明显降低(图4)。
2.4 双荧光素酶报告检测实验结果
荧光素酶活性检测仪分别检测萤火虫荧光素酶和海肾荧光素酶的活性,并且用萤火虫荧光素酶的活性对海肾荧光素酶的活性进行标准化,可见与阴性对照相比,P-NPAS2-3’UTR与 mir-106b共转染,海肾荧光素酶的活性下降。荧光素酶报告载体的NPAS2-3’UTR突变后,与mir-106b共转染其海肾荧光素酶的活性升高;并且荧光素酶报告载体的NPAS2-3’UTR双突变与mir-106b共转染,海肾荧光素酶/萤火虫荧光素酶的活性较单突变更高(图5)。
3 讨论

图4 NPAS2的Western blot检测结果Note:1:Stable transfection cell line generated with negative control plasm id;2:Stable transfection cell line generated with mir-106bFig.4 The results of Western blot analysis of NPAS2
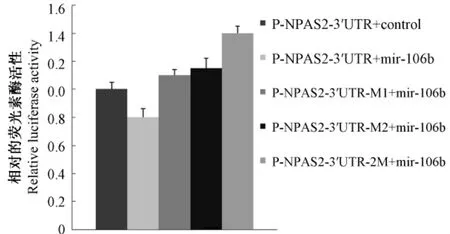
图5 双荧光素酶报告检测结果Fig.5 The results of dual-luciferase reporter assay
我们用real-time PCR对microRNA芯片的结果进行验证,发现在AD双转小鼠模型脑组织中m ir-106b的表达升高,实验组与对照组相比差异具有统计学意义。Hébert等[6]的研究发现 mir-106b的表达在AD病人的脑组织中有改变,可能通过调控淀粉样前体蛋白(Amyloid precursor protein,APP)的表达参与AD的发病。这些研究表明mir-106b可能在AD的发生发展过程中发挥一定的调控作用。
NPAS2是一种主要在哺乳动物前脑表达的转录因子,与 BMAL1结合成异二聚体,激活内源性Per1、Per2和Cry1基因,从而在哺乳动物脑中发挥分子钟的功能[7]。我们的研究发现 mir-106b可以调控NPAS2的表达:(1)在SH-SY5Y的mir-106b的稳转细胞系中,m ir-106b的表达升高的同时,NPAS2的表达下降。(2)双荧光素酶报告检测实验证实,mir-106b与 P-NPAS2-3’UTR共转染与对照质粒与P-NPAS2-3’UTR共转染相比,海肾荧光素酶/萤火虫荧光素酶的活性明显降低。microRNA靶基因预测软件 Targetsans和 Pictar均预测 m ir-106b与NPAS2的3’UTR有2个结合位点,对这2个预测的结合位点进行突变,发现荧光素酶报告载体的NPAS2-3’UTR突变后与mir-106b共转染,其海肾荧光素酶/萤火虫荧光素酶的活性单突变较未突变的升高,双突变的最高。证实mir-106b通过与NPAS2-3’UTR的这两个位点结合来发挥其翻译抑制作用,对这两个位点进行突变能够使 mir-106b丧失与NPAS2的 3’UTR的结合功能而无法发挥其对NPAS2的翻译抑制作用。此外,我们的研究发现PNPAS2-3’UTR-2M 与 m ir-106b的共转染较 PNPAS2-3’UTR与阴性对照质粒的共转染海肾荧光素酶/萤火虫荧光素酶的活性升高,理论上讲两者均不存在转染 mir-106b的抑制作用。之所以出现这种现象,我们分析可能是因为 m icroRNA在许多组织和细胞广泛表达,转染所用的HEK-293T细胞存在的内源性的m icroRNA干扰的影响。
越来越多的研究发现microRNAs参与AD的发生发展[8],干扰 microRNAs的表达可能为 AD的治疗提供一种新的思路和方法[9]。由于AD病人经常表现出较正常的老年人更为严重的昼夜节律紊乱,因此我们的研究表明 mir-106b可能通过调控生物钟基因NPAS2的表达参与调控AD病人的生活节律,干扰mir-106b的表达可能有助于改善AD病人的这种紊乱,提高其生活质量。
[1] Foley DJ,Monjan AA,Brown SL,et al.Sleep complaints amongelderly persons:an epidemiologic study of three communities[J].Sleep,1995,18(6):425-432.
[2]Van Someren EJ.Circadian and sleep disturbances in the elderly[J].Exp Gerontol,2000,35(9-10):1229-1237.
[3]Dudley CA,Erbel-Sieler C,Estill SJ,et al.Altered patterns of sleep and behavioral adaptability in NPAS2-deficient mice[J].Science,2003,301(5631):379-383.
[4] Wang WX,Rajeev BW,Stromberg AJ,et al.The expression of microRNA miR-107 decreases early in Alzheimer's disease and may accelerate disease progression through regulation of beta-site amyloid precursor protein-cleaving enzyme 1[J].J Neurosci,2008,28(5):1213-1223.
[5]Hébert SS,HorréK,NicolaïL,et al.Loss ofmicroRNA cluster miR-29a/b-1 in sporadic Alzheimer's disease correlates with increased BACE1/beta-secretase expression[J].Proc Natl Acad Sci U S A,2008,105(17):6415-6420.
[6]Hébert SS,HorréK,NicolaïL,et al.MicroRNA regulation of Alzheimer's Amyloid precursor protein expression[J].Neurobiol Dis,2009,33(3):422-428.
[7] Reick M,Garcia JA,Dudley C,et al.NPAS2:an analog of clock operative in themammalian forebrain[J].Science,2001,293(5529):506-509.
[8] Boissonneault V,Plante I,Rivest S,et al.MicroRNA-298 and microRNA-328 regulate expression of mouse beta-amyloid precursor protein-converting enzyme 1[J].J Biol Chem,2009,284(4):1971-1981.
[9]Krützfeldt J,Rajewsky N,Braich R,et al.Silencing of microRNAs in vivo with‘antagomirs’[J].Nature,2005,438 (7068):685-689.

