稳定转染Dicer基因对HELF细胞功能的影响
何 琳,王禄增,郑志红
(1.中国医科大学实验动物部 辽宁省实验动物转基因重点实验室,2.中国医科大学附属第四医院 中心实验室,沈阳 110001)
肿瘤是人类最常见的一种多基因、多因素复杂疾病,其发生是由于细胞出现异常增殖。以往研究显示原癌基因和抑癌基因的表达异常对肿瘤发生起着非常重要的作用,近年来随着生命科学的进展发现有些肿瘤组织中较少甚至完全没有基因突变,而m iRNA表达却存在异常。有关m iRNA的研究,为更全面深入的了解肿瘤的发生发展提供了新的思路。
Dicer是miRNA形成过程中必须的酶。在细胞核内编码miRNA的基因转录成miRNA原初转录物(pri-miRNA),pri-miRNA在一种被称作 Drosha的RNA酶的作用下,剪切为长度约70个核苷酸的前体m iRNA(pre-m iRNA)[1]。pre-m iRNA在Ran-GTP依赖性核质/细胞质转运蛋白 exprotin-5的作用下,从核内运输到胞质中[2,3],最后在Dicer酶作用下剪切为含有20-24个核苷酸长度的双链miRNA,然后双螺旋解旋,miRNA结合到RNA诱导的沉默复合物(RISC)中形成非对称RISC复合物而发挥剪切或抑制翻译的作用[4]。由此推测,Dicer基因表达异常时可能会引起某些m iRNA表达异常从而引起细胞或组织异常增生,甚至导致肿瘤的形成。为此,作者将Dicer基因稳定转染人胚肺细胞(HELF),制作Dicer基因高表达的细胞模型,通过检测转染后HELF细胞增殖能力和侵袭能力的变化来分析Dicer基因在肿瘤发生中所行使的功能。同时,本实验也为进一步建立转基因小鼠模型及在动物水平对Dicer基因功能进行研究提供了一定的实验基础。
1 材料和方法
1.1 材料
pcDNA3.1质粒、pcDNA3.1—Dicer质粒、HELF细胞为本实验室保存,DMEM培养基、小牛血清、脂质体转染试剂 Lipofectamine reagent(Invitrogen)、G418、Trizol (Invitrogen)、RT-PCR 试 剂 盒(Promege)、兔抗人 Dicer多克隆抗体(Imgenex)、MTT(华美公司)、Transwell小室(Falcon)。
1.2 方法
1.2.1 细胞培养及转染:用含 10%小牛血清的DMEM培养液于37℃、5%CO2孵箱培养HELF细胞。培养细胞处于增殖期时,以3×105细胞/孔的密度平铺于6孔板培养皿上,继续培养20~24 h,细胞约长满孔板底部90%时,用脂质体介导的方法进行转染,将质粒 pcDNA3.1-Dicer、pcDNA3.1(空载体)分别转染HELF细胞,按照Lipofectamine plus试剂盒说明进行操作。转染细胞培养48 h后进行1:7传代,然后加入G418进行筛选,每3 d换液1次,约10 d后,可见细胞呈单克隆状生长,挑取实验组和对照组稳定转染细胞单克隆各100个接种于24孔板中,进行培养。
1.2.2 PCR实验检测各转染细胞株 Dicer基因嵌合情况:酚氯仿法提取细胞基因组DNA进行PCR检 测,PCR 引 物 序 列:上 游 5′-GGCATT GGGAAGAATCAGCC-3′下 游 5′-ATTGATGTGTC CAATGGCCC-3′,PCR反应条件如下:95℃ 5 m in,94℃ 1 m in,60℃ 1 m in,72℃ 1 m in,循环30次,最后72℃延伸10 min,1%琼脂糖凝胶电泳观察结果。
1.2.3 RT-PCR实验检测PCR阳性Dicer基因表达情况:提取PCR阳性的细胞总RNA,并用DNA酶处理总RNA;琼脂糖凝胶电泳确定RNA未降解,紫外分光光度计测定浓度,取1μg RNA,按照RT试剂盒反转录为cDNA,进行PCR扩增,PCR引物:上游5′-GGCATTGGGAAGAATCAGCC-3′ 下 游 5′-ATTGATGTGTCCAATGGCCC-3′,PCR反应条件如下:95℃5 m in,94℃1 m in,60℃1 m in,72℃1 m in,从第二步开始循环30次,最后72℃延伸10 m in,产物经1%的琼脂糖凝胶电泳检测Dicer基因的表达。1.2.4 Western blot实验检测 Dicer基因蛋白表达情况:取正常 HELF细胞和 pcDNA3.1转染组、pcDNA3.1-Dicer转然组RT-PCR阳性细胞各一株分别分别提取细胞总蛋白,培养细胞加入含有蛋白质酶抑制剂的蛋白裂解液1 m L/瓶,冰上裂解30 min,12 000 r/m in,4℃离心40 m in,吸取上清即为细胞总白质。取总蛋白150μg/孔(20μL),沸水煮10 m in,室温冷却15 m in,7%SDS-PAGE分离总蛋白,然后将蛋白质转移至PVDF膜上,5%脱脂奶粉封闭2 h,加入一抗(1∶2000稀释的兔抗人Dicer)置摇床上4℃震荡孵育过夜,加入相应二抗(1:2000)置摇床上室温震荡孵育2 h,ECL显色,曝光于X光片上。扫描计算灰度值。
1.2.5 MTT实验检测 Dicer对细胞增殖能力的影响:将对数生长期的正常HELF细胞和 pcDNA 3.1转染组、pcDNA 3.1-Dicer转染组阳性细胞,以每孔3000个细胞分别接种于96孔板中,分别在培养24、48、72、96 h后加入MTT溶液(终浓度为5 mg/m L),37℃、孵育 4 h,弃上清液,加入二甲基亚砜 150 μL/孔,置振荡仪上低速震荡10 m in,以培养液调零,在酶标仪上测定490 nm的光吸收值。每组设8个孔,共重复3次。以时间为横坐标,光吸收值为纵坐标绘制细胞生长曲线。
1.2.6 Transwell实验检测 Dicer对细胞迁移能力的影响:将pcDNA3.1-Dicer转染组细胞、pcDNA3.1转染组细胞和未转染的 HELF细胞各100 m L(约2.5×104个细胞),加入Transwell系统的上层小室,下室加入含有10%FBS的DMEM 600μL作为趋化因子,置于5%CO2孵箱中、37℃条件下培养22 h,镜下观察实验组细胞已大部分穿过人工基底膜。取出Transwell小室,用棉签轻轻擦掉上层小室侧未侵袭过去的细胞,将滤膜用4%多聚甲醛固定15 min,苏木素染核,于100倍显微镜下计数上下左右中5个视野的侵袭细胞数,计算平均值。上述实验重复3次。
2 结果
2.1 PCR检测结果
用脂质体介导的方法将质粒 pcDNA3.1-Dicer和空载体pcDNA3.1转染HELF细胞G418筛选后各挑取100个克隆,分别提取细胞基因组DNA,PCR扩增结果显示,pcDNA3.1转染组9(9/100)个阳性克隆未能扩增出 Dicer基因片段,而 pcDNA3.1-Dicer转染组6(6/100)个单克隆成功扩增出487 bp目的基因片段(图1),说明PCR结果初步鉴定转染质粒已嵌合于HELF细胞。
2.2 RT-PCR检测结果
提取PCR阳性的各稳定转染细胞株总RNA,以反转录生成的cDNA为模板进行PCR扩增,pcDNA 3.1转染组未能扩增出 Dicer基因片段,而 pcDNA 3.1-Dicer转染组有4个细胞株成功扩增出487 bp的目的基因片段(图2),说明Dicer基因已成功转染HELF细胞。
2.3 W estern检测结果
Western 印迹分析显示与转染空载体pcDNA3.1的 HELF细胞相比,转染 pcDNA 3.1-Dicer质粒的HELF细胞中 Dicer蛋白的表达明显增强,其分子量大小约200 kD(图3)。各组之间表达差异经统计学分析显示:转染空载体 pcDNA 3.1的HELF细胞与转染pcDNA 3.1-Dicer质粒的HELF细胞之间比较P<0.05;转染空载体pcDNA3.1的HELF细胞与正常HELF细胞之间比较P>0.05,无统计学意义。2.4 M TT检测结果

图1 Dicer DNA在转染HELF细胞中的表达Fig.1 Expression of Dicer DNA in the transfected HELF cells

图2 Dicer mRNA在稳定转染PCR阳性HELF细胞中的表达Fig.2 Expression of Dicer mRNA in the stably transfected HELF cells

表1 三组细胞在不同时间MTT光吸收值的描述性统计Tab.1 Descriptive statistics of MTT optical absorbance at different times among the cells of the three groups

图3 Western blot检测在稳定转染HELF细胞中Dicer蛋白表达Fig. 3 The Dicer protein expression detected by Western blot
转染 pcDNA 3.1-Dicer质粒的 HELF细胞的MTT光吸收值在48、72、96 h显著高于 pcDNA 3.1空载体组(P<0.05),提示将pcDNA 3.1-Dicer质粒转染HELF后,使HELF细胞生长率逐渐增加,说明Dicer基因表达水平上调能使HELF细胞生长增殖速度加快(图4,表1)。
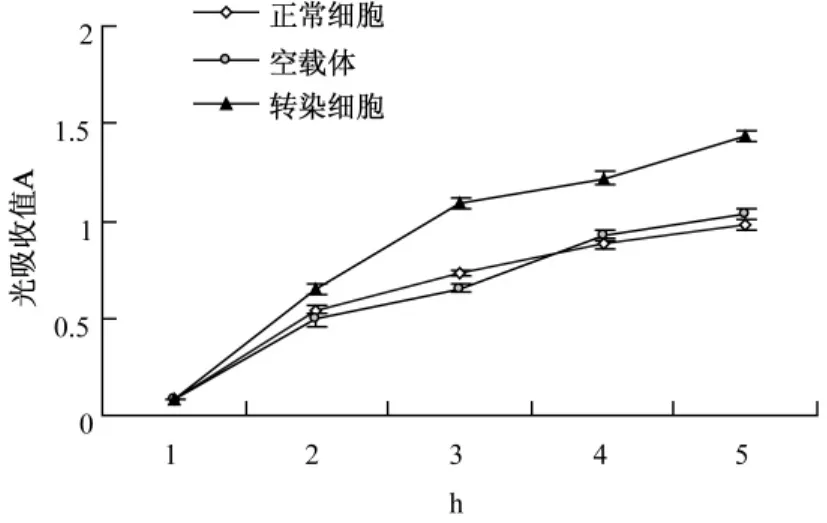
图4 三组细胞不同时间点的MTT光吸收值检测细胞增殖变化趋势的差异Fig.4 The MTT optical absorbance at different times to detect the proliferation trend in cells of the three groups
2.5 T rans-well检测结果
转染 pcDNA3.1-Dicer质粒的 HELF细胞比转染空载体pcDNA 3.1的HELF细胞和普通HELF细胞穿透人工重构基底膜的细胞数明显增多(图6,见彩插4),用平均穿膜细胞数标化成相对数后进行统计作图(图5)。由图5可见,转染pcDNA 3.1-Dicer质粒的HELF细胞穿膜细胞数为198.5±4.75,而未转染组 HELF细胞和转染空载体 pcDNA3.1的HELF细胞分别为27.50±6.30和26.88±5.24,质粒 pcDNA3.1-Dicer转染的 HELF细胞与空载体pcDNA3.1转染的HELF及HELF细胞比较,穿膜细胞数有显著增多。转染pcDNA 3.1-Dicer组与未转染组、转染体空载体pcDNA3.1组比较,差异具有统计学意义(P<0.05)。
3 讨论

图5 Transwell实验结果Fig.5 Results of Transwell chamber assay
Dicer是 RNAⅢ家族的成员之一,其定位在14q32.13,主要存在于细胞质,是 miRNA成熟所必需的酶。Dicer与其酶切产物之一miRNA及其他蛋白质形成核酸蛋白复合物在多种生物过程中起调节作用,包括细胞增殖、分化、凋亡、死亡等。有研究发现许多疾病的形成尤其是肿瘤的发生与 Dicer基因表达异常密切相关。研究显示,在有些肿瘤组织中Dicer基因起到抑癌基因的作用,其表达水平下调,如:在非小细胞肺癌中Dicer基因表达水平下调,引起let-7表达下调,并与预后正相关[5,6];在卵巢癌中Dicer基因表达水平下调[7]。有些肿瘤组织中Dicer基因起到原癌基因的作用,其表达水平上调,如:在肝癌和前列腺癌中 Dicer基因表达水平上调[8,9]。
根据前人研究结果可以看出Dicer基因在不同的肿瘤中表达水平不一致。为了进一步了解 Dicer基因表达上调在肿瘤细胞异常增殖及侵袭转移过程中的作用机制,我们应用脂质体介导的转染方法制备了Dicer基因高表达的细胞模型。通过用MTT实验绘制生长曲线,发现转染 pcDNA 3.1-Dicer质粒的HELF细胞较转染空载体pcDNA3.1的HELF细胞生长速度明显加快(P<0.05),说明Dicer基因表达增加能使HELF细胞生长增殖速度加快,提示Dicer基因表达增加可能会使细胞产生恶性转化的趋势;同时本研究将稳定转染的细胞和正常细胞分别接种于Transwell小室的上室,通过在显微镜下观察计数穿过人工重构基底膜的细胞数测定HELF细胞迁移能力的变化,发现转染 pcDNA 3.1-Dicer质粒的HELF细胞比转染空载体pcDNA3.1的HELF细胞和普通HELF细胞穿过人工重构基底膜的细胞数明显增多(P<0.05),说明Dicer基因的表达增加能使HELF细胞的体外侵袭和迁移能力有所增强,这些与以往的报道是一致的。有研究显示Dicer基因定位在人染色体14q32.13,而这一位点正是最常见的引起肺腺癌的突变位点[10],当 Dicer基因表达增加时,引起该位点突变,从而引起细胞恶性转化:使细胞增值速度加快,侵袭和迁移能力增加。还有研究显示Dicer的酶切产物之一m iRNA与人类肿瘤发生密切相关,在 B细胞淋巴细胞瘤中 Dicer基因表达增加,引起miR-17-92簇 miRNA经常被扩增,He和 O’Donnell等人[11]发表的论文描述:在 B细胞淋巴瘤中常常有13q31位点的扩增,而在这一扩增区域的唯一基因就是 Cl3orf25。Cl3orf25基因的第3内含子编码一个非编码蛋白的RNA基因,m iR-17-92。He分析了具有13q31扩增的细胞系的191个miRNAs,发现其中有6个miRNAs的表达增加,其中5个属于miR-17-92基因簇,研究还发现许多B细胞淋巴瘤组织 miRNA-17的前体表达增加,并且他们通过对比过表达Myc和miR-17-92miRNA基因的淋巴瘤与仅有Myc过表达的肿瘤细胞进行比较,发现前者具有更强的增殖能力,说明 m iR-17-92m iRNA簇的过表达与 Myc协同作用加快了肿瘤的发生。以上研究结果也说明Dicer基因表达增加,引起具有癌基因功能的miRNA表达上调可能是肿瘤形成的原因之一。但Dicer基因具体的作用机制尚不十分清楚,为此我们将在转基因小鼠的动物模型上进一步对 Dicer基因的功能及作用机制进行研究。
[1] Lee Y,Ahn C,Han J,et al.The nuclear RNaseⅢ Drosha initiates microRNA processing[J].Nature,2003,425:415 -419.
[2]Lund E,Guttinger S,Calado A,et al.Nuclear export of microRNA precursors[J].Sinence,2004,303:95-98.
[3] Kidner CA,Martienssen RA.Macro effect of microRNAs in plants[J].Trends Genet,2003,19:13-16.
[4] Bartel DP.MicroRNAs:Genomics,biogenesis,mechanism,and function[J].Cell,2004,116:281-297.
[5] Yanaihara N,Cap len N,Bowman E,et al.Unique microRNA molecular profiles in lung cancer diagnosis and prognosis[J].Cancer Cell,2006,9:189-198.
[6] Lu J,Getz G,Miska EA,et al.MicroRNA expression profiles classify human cancers[J].Nature,2005,435:834-838.
[7] Merritt WM,Lin YG,Kamat AA,et al.Dicer Drosha and outcomes in patients with ovarian cancer[J].N Engl J Med,2008,359(25):2641-2650.
[8] 王玉兰,王爱华,陈允硕,等.实时荧光定量RT-PCR检测原发性肝细胞癌中Dicer mRNA的表达[J].第二军医大学学报,2006,27(8):842-844.
[9] Chiosea S,Jelezcova E,Chandran U,et al.Up-regulation of Dicer,a component of the microRNA machinery,in prostate adenocarcinoma[J].Am J Pathol,2006,169(5):1812 -1820.
[10]Chiosea S,Jelezcova E,Chandran U,et al.Overexpression of Dicer in precursor lesions of lung adenocarcinoma[J].Cancer Res,2007,67:(5)2345-2350.
[11] He L,Thomson JM,Hemann MT,etal.A microRNA polycistron as a potential human oncogene[J].Nature,2005,435:828 -833.

