肠炎沙门氏菌SEFA基因表达和间接ELISA检测方法的初步建立
朱春红,吴 娟,张伟娟,陆光富,朱国强*
(1.扬州大学兽医学院,江苏扬州225009;2.江苏畜牧兽医职业技术学院,江苏泰州225300)
肠炎沙门氏菌是目前引起人类食物中毒的主要病原之一[1],其感染主要是因食用了被肠炎沙门氏菌污染的动物性食品,尤其是家禽的肉蛋食品,因而对该菌的研究倍受国内外学者的关注[2]。
肠炎沙门氏菌能表达多种菌毛结构,主要包括:SEF14,SEF17,SEF21,长极性菌毛(LPF),质粒编码菌毛(PEF)等。其中SEF14是90年代鉴定出来的一种菌毛[3],没有凝集红细胞的能力,其编码基因仅分布于血清D群沙门氏菌中,目前仅在肠炎沙门氏菌和都柏林沙门氏菌中检测到SEF14菌毛的表达,而某些D群沙门氏菌如鸡沙门氏菌,鸡白痢沙门氏菌和伤寒沙门氏菌均具有完整的sef基因操纵子,但却不能表达SEF14菌毛,这是很少见的现象[4]。
完整的sef基因操纵子至少由 sefA,sefB,sefC,sefD4个基因组成[5],其中sefA编码SEF14菌毛的主要亚单位蛋白,sefB编码伴侣蛋白亚单位,和大肠杆菌菌毛的外周伴侣蛋白类似,sefC则编码推进蛋白,这种蛋白位于外膜中,负责将菌毛亚单位组织和装配到聚合的菌毛结构上,sefD基因作为sef基因操纵子的组成部分,可能编码SEF14菌毛的顶端结构,并在致病过程中起着重要的作用[6]。目前关于SEF14菌毛的功能,有报道认为SEF14菌毛介导了肠炎沙门氏菌在肠道的定植,但也有报道其与黏附与定植功能无关,但有助于肠炎沙门氏菌在巨噬细胞中的存活,并影响入侵细胞的相关细胞因子的表达,增强肠炎沙门氏菌的毒力[7]。
肠炎沙门氏菌与鸡白痢沙门氏菌引起鸡群发病的症状和病理学变化非常相似,所以在临床感染中往往把鸡肠炎沙门氏菌感染误诊为鸡白痢或伤寒。肠炎沙门氏菌宿主谱比鸡白痢沙门氏菌广泛,而血清学诊断的敏感度低,因此该病的防治和普查要比鸡白痢困难得多。两种表达SEF14菌毛的沙门氏菌,只有肠炎沙门氏菌在家禽中较为流行,而都柏林沙门氏菌在家禽中的感染鲜见报道。本实验构建重组菌体外表达SEF14菌毛主要亚单位SEFA蛋白,检测重组蛋白的免疫原性和反应原性,并建立间接ELISA方法检测肠炎沙门氏菌感染血清,为临床检测肠炎沙门氏菌的感染和血清学调查奠定基础。
1 材料和方法
1.1 菌株、质粒 肠炎沙门氏菌国内标准株CMCC(B)50336由本校焦新安教授提供,鸡白痢沙门氏菌标准株、都柏林沙门氏菌标准株、鼠伤寒沙门氏菌标准株、E.coliBL21(DE3)、DH5α均由本实验室保存。pET22b+质粒购自Invitrogen公司;肠炎沙门氏菌国内标准株CMCC(B)50336小鼠感染阳性血清由本实验室制备。
1.2 主要试剂 TaqDNA聚合酶,DNA凝胶回收试剂盒,λHindⅢDNA Marker、DNA Marker DL2000、Miniprep质粒提取试剂盒、pMD18-T质粒和标准低分子量蛋白Marker购自TaKaRa公司,限制性内切酶和T4 DNA连接酶购自NEB公司。羊抗鼠IgG-HRP、羊抗鸡IgG-HRP、DAB均为Sigma公司产品。
1.3 实验动物 ICR品系青年小白鼠购自扬州大学比较医学中心实验动物房。
1.4 sefA基因的扩增和鉴定 根据已发表的sefA基因序列(L11008),用DNAStar软件分析设计一对引物,引物序列为:NdeⅠ-sefAF:CGCATATGGCTGG CTTTGTTGGTAAC;NotⅠ-sefAR:CGGCGGCCGCT TAGTTTTGATACTGCTGAA。按全菌裂解法制备国内标准株CMCC(B)50336模板DNA[9]。PCR扩增产物经琼脂糖凝胶电泳初步鉴定后,克隆于pMD18-T,通过氨苄抗性和蓝白斑筛选所获阳性克隆重组质粒pMD18-sefA,经测序引物M13-47测序鉴定。
1.5 sefA基因的克隆和鉴定 PCR产物经琼脂糖切胶回收,以及双酶切消化后克隆于表达载体pET22b+,通过氨苄抗性筛选结合酶切分析鉴定出重组pET-sefA质粒的阳性克隆。
1.6 重组菌的诱导表达、纯化以及重组蛋白的鉴定重组质粒转化E.coliBL21(DE3),根据pET表达系统操作手册优化重组蛋白诱导条件,并用Novagen公司的固定化镍离子亲和层析试剂盒纯化重组蛋白。纯化的重组蛋白经SDS-PAGE电泳后,以BIO-RAD转印系统将凝胶中蛋白条带电转移到NC膜上,10%BSA 4℃封闭过夜。PBST洗涤NC膜后依次加入1∶1000稀释的抗His-Tag的单克隆抗体,1∶500稀释的羊抗鼠IgG-HRP孵育,DAB底物显色。
1.7 肠炎沙门氏菌SEF14菌毛提取以及重组蛋白的免疫原性鉴定 根据已报道的方法提取肠炎沙门氏菌标准株CMCC(B)50336 SEF14菌毛[8]。将纯化的重组蛋白按常规方法免疫ICR小鼠,三免后第10 d麻痹小鼠眼球采血分离血清,经间接ELISA方法检测阳性备用。利用该血清和肠炎沙门氏菌国内标准株CMCC(B)50336小鼠感染阳性血清,通过western blot检测重组蛋白的免疫原性。
1.8 间接ELISA程序的建立 取96孔ELISA板,重组抗原用pH9.6的碳酸盐缓冲液依次做1∶50、1∶100至1∶3200倍比稀释,每孔100 μL,37℃作用3 h后4℃过夜包被。次日取出后洗涤5遍。封闭后将阳性血清和阴性血清按1∶20至1∶1280倍比稀释,自上而下分别加入反应孔中,37℃作用1 h,洗涤。加入IgG-HRP的作为二抗,37℃作用1 h,洗涤,加含OPD底物显色液,37℃避光作用20 min~30 min;以2 mol/L H2SO4终止反应,观察结果,测量OD490nm值。上述操作重复3次。选取最佳的重组蛋白抗原包被浓度和血清稀释度。
1.9 间接ELISA方法临界值的确定 用建立的间接ELISA方法对10份SPF鸡阴性血清(粪便棉拭检测无肠炎沙门氏菌感染)进行检测,测定其OD490nm值并计算OD490nm值平均值χ和标准差(SD)。将10份阴性血清OD490nm值平均值+3SD定为阴、阳性血清临界值,当待测样本的OD490nm值≥上述临界值时,判其为阳性。
1.10 间接ELISA特异性以及临床检测 肠炎沙门氏菌,鸡白痢沙门氏菌,都柏林沙门氏菌,鼠伤寒沙门氏菌标准株小剂量(100 cfu/只)接种小鼠(各10只)制得各自的鼠抗血清,用上述建立的间接ELISA方法检测其抗体及其特异性。从无锡某鸡场随机采集家禽血清100份,使用建立的ELISA程序初步检测鸡场肠炎沙门氏菌的感染情况。
2 结果
2.1 sefA基因的PCR扩增、鉴定 PCR产物电泳结果显示,利用设计的引物以肠炎沙门氏菌国内标准株CMCC(B)50336基因组DNA为模板成功地扩增出特异性目的条带,其片段大小与预期设计的498 bp相符。将该PCR片段克隆到pMD18-T质粒,经测序引物M13-47测序证明,该sefA基因DNA序列与已发表的sefA序列一致。
2.2 sefA基因的表达以及鉴定 将上述sefA基因克隆到pET22b+中构建pET-sefA重组质粒,重组质粒单酶切产物大小为5991 bp,而双酶切产物大小分别约为5500 bp和500 bp,与预期大小相符。SDSPAGE结果表明重组蛋白rSEFA约15.2 ku(图1),根据重组菌在不同温度(29℃和37℃)以及不同IPTG浓度条件下的表达量差异得出其最佳诱导条件为:IPTG终浓度为0.4 mmol/L,37℃诱导3 h。使用鼠抗His-Tag的单克隆抗体进行western blot检测,在相对分子量为15.2 ku处有特异性条带,表明纯化产物为含His标签的重组蛋白rSEFA(图2)。
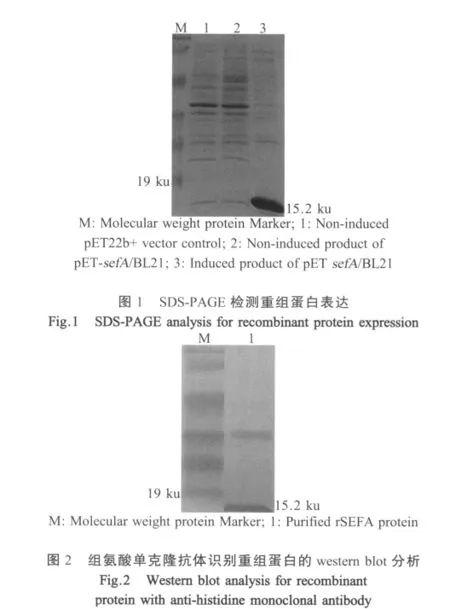
2.3 重组蛋白western blot检测 提取肠炎沙门氏菌SEF14菌毛,获取大小为14 ku左右与重组蛋白rSEFA分子量相近的主要亚单位蛋白,3次重复结果一致,表明肠炎沙门氏菌能表达SEF14菌毛(图3A)。上述提纯的SEF14菌毛以及纯化的重组蛋白rSEFA经SDS-PAGE之后,用重组蛋白rSEFA免疫小鼠所得多抗血清和标准株CMCC(B)50336感染阳性血清进行western blot检测(图3B和图3C),表明重组蛋白rSEFA免疫得到的高免血清能识别从国内标准株CMCC(B)50336中提取的SEF14菌毛蛋白;所纯化的重组蛋白rSEFA也能被标准株CMCC(B)50336感染阳性血清识别,重组蛋白rSEFA和上述菌毛蛋白具有同样的免疫原性、反应原性,可作为检测抗原使用。
2.4 间接ELISA抗原、血清的最佳工作浓度的确定 根据方阵ELISA测试结果,选择了最佳的抗原和血清稀释倍数(抗原的最佳浓度为7.5 μg/mL,血清稀释倍数为1∶20)。当重组抗原rSEFA每孔包被量为0.75 μg、血清稀释倍数为1∶20时,阳性血清的OD490nm值在1.0左右,而且阴性值较低,平均值为 0.192,阳性样品 OD490nm值 /阴性对照平均值(P/N)达到 4.864。

2.5 间接ELISA方法临界值的确定 用建立的间接ELISA方法检测10份SPF鸡阴性血清,并测定其OD490nm值。其OD值中最小值为0.223,最大值为0.539,标准差为0.06,经计算得出OD490nm平均值+3SD为0.522,故本试验间接ELISA方法的判定值定为0.522。
2.6 特异性试验以及临床检测 建立的间接ELISA检测肠炎沙门氏菌、都柏林沙门氏菌和鸡白痢沙门氏菌感染血清,OD490nm平均值分别为1.212、0.990和0.505,说明此方法能特异性识别肠炎和都柏林沙门氏菌感染血清,OD平均值均高于临界值,而不能识别鸡白痢沙门氏菌感染血清,其OD平均值低于临界值,此检测方法特异性良好。根据已建立的ELISA方法检测无锡某鸡场的100份血清,抗体阳性率高达67%,以此可以推测在国内某些养鸡场,肠炎沙门氏菌的隐性感染比较严重的,需要加强管理和防范。
3 讨论
本实验利用PCR技术以肠炎沙门氏菌国内标准株CMCC(B)50336基因组DNA为模板成功扩增出编码SEF14菌毛操纵子亚单位sefA基因,将其克隆入表达载体pET22b+,鉴定和筛选出含sefA基因正确阅读框架的pET-sefA重组质粒,进一步转化进诱导表达系统E.coliBL21(DE3),优化诱导表达条件获得rSEFA蛋白表达,用该重组蛋白制备的鼠抗高免血清抗体能识别从标准株CMCC(B)50336中提纯的SEF14菌毛,同时这一重组蛋白能被标准株CMCC(B)50336的感染阳性血清识别,上述结果表明,原核表达的rSEFA蛋白与标准蛋白具有同样的免疫原性和反应原性。
目前,在家禽生产过程中肠炎和鸡白痢沙门氏菌的感染比较普遍,但关于都柏林沙门氏菌的感染却鲜见报道。国外相关研究表明,脂质体SEF14菌毛抗原滴眼免疫小鼠,能诱导小鼠肠道黏膜和全身的体液免疫,产生IgG和IgA,明显降低肠道中肠炎沙门氏菌的定植和粪便中的带菌率[10]。另有相关报道称,家禽感染肠炎沙门氏菌后两周内,88%的抗血清能与重组蛋白SEFA产生反应,而在随后的时间内,则100%能产生反应[11]。本实验构建重组菌,体外表达SEF14菌毛主要亚单位蛋白SEFA,并初步建立间接ELISA方法检测家禽中肠炎沙门氏菌的抗体情况。通过ELISA方阵确定了间接ELISA方法的2个参数,即抗原包被量和血清稀释倍数,并对此方法进行了特异性检测,结果表明,该方法特异性良好。因此,可以推测肠炎沙门氏菌在小鼠体内能表达SEF14菌毛,并产生可供检测的抗体。本实验用建立的间接ELISA方法对无锡某鸡场100份血清样品进行检测,初步结果显示抗体阳性率高达67%。
迄今为止,在全球范围内家禽的肠炎沙门氏菌的隐性感染是一个很严重的问题,每年由此引发的食物中毒事件,或者由此引起的间接经济损失巨大,如何有效预防和控制家禽养殖过程中肠炎沙门氏菌的感染仍然是个急待解决的问题。上述研究一方面为深入研究肠炎沙门氏菌SEF14菌毛在易感宿主体内的致病作用提供了很好的基础;另一方面表明基于重组蛋白rSEFA建立的间接ELISA检测方法,其特异性较好,可以初步应用于家禽生产中肠炎沙门氏菌抗体的检测,进行相关血清学调查,为有效防制肠炎沙门氏菌感染提供可行的诊断方法和检测标准,进一步为净化种群奠定基础。
[1]Gantois I.Ducatelle R,Pasmans F et al.Salmonella enterica serovarEnteritidis genes induced during oviduct colonization and egg contamination in laying hens[J].Appl Environ Microbiol,2008,74(21):6616-6622.
[2]Ukuku D O,Jin T,Zhang H.Membrane damage and viability loss ofEscherichia coliK-12 andSalmonellaenteritidis in liquid egg by thermal death time disk treatment[J].J Food Prot,2008,71(10):1988-1995.
[3]Thorns C J,Sojka M G,Chasey D.Detection of a novel fimbrial structure on the surface ofSalmonellaenteritidis by using a monoclonal antibody[J].J Clin Microbiol,1990,28:2409-2414.
[4]Walker S L,Sojka M,Dibb-Fuller M,et al.Effect of pH,temperature and surface contact on the elaboration offimbriaeandflagellabySalmonellaserotype Enteritidis[J].J Med Microbiol,1999,48(3):253-261.
[5]Clouthier S C,Müller K H,Doran J L,et al.Characterization of three fimbrial genes,sefABC,ofSalmonellaenteritidis[J].J Bacteriol,1993,175(9):2523-2533.
[6]Clouthier S C,Collinson S K,Kav W W.Unique fimbriae-like structures encoded by sefD of the SEF14 fimbrial gene cluster of Salmonellaenteritidis[J].Mol Mocrobiol,1994,12(6):893-901.[7]Edward R A,Schifferli D M,Maloy S R.A role forSalmonella fimbriaein intraperitoneal infections[J].Proc Natl Acad Sci,2000,97(3):1258-1262.
[8]Feutrier J,Kay W W,Trust T J.Purification and characterization offimbriaefromSalmonellaenteritidis[J].J Bacteriol,1986,168(1):221-227.
[9]萨姆布鲁克,弗里奇,曼尼阿蒂斯.分子克隆实验指南[M].2版.北京:科学出版社,1992.
[10]Li W,Watarai S,Iwasaki T,et al.Suppression ofSalmonella entericaserovar Enteritidis excretion by intraocular vaccination with fimbriae proteins incorporated in liposomes[J].Dev Comp Immunol,2004,28(1):29-38.
[11]Rajashekara G,Munir S,Lamichhane C M,et al.Application of recombinantfimbrialprotein forthe specific detection of Salmonellaenteritidis infection in poultry[J].Diagn Microbiol Infect Dis 1998,32(3):147-157.

