乙型脑炎病毒E蛋白Ⅰ、Ⅱ结构域抗原表位鉴定
闫丽萍,华荣虹,亓文宝,周艳君,李国新,于 海,姜一峰,田志军,童光志*
(1.中国农业科学院上海兽医研究所,上海200241;2.中国农业科学院哈尔滨兽医研究所兽医生物技术国家重点实验室/猪传染病研究室,黑龙江哈尔滨150001;3.华南农业大学兽医学院,广东广州510642)
流行性乙型脑炎(Japanese encephalitis,JE),是由JE病毒(JEV)引起的一种人与动物共同感染的蚊媒病毒性疾病。JEV主要侵害人的中枢神经系统,引起急性病毒性脑炎,导致高病死率(25%),或神经-精神后遗症[1];JEV感染猪可引起其繁殖障碍,给养猪业造成巨大的经济损失[2]。JEV主要流行于亚洲[3-4],在南半球亦有报道[5-6]。
E蛋白是JEV的主要结构蛋白,由500个氨基酸组成,它在病毒的吸附、融合、血凝、细胞趋向性、病毒毒力和诱导保护性免疫反应中起重要作用。Kolaskar等认为E蛋白的三维结构域Ⅲ(292 aa~402 aa),集中许多抗原中和表位[7]。Seif等通过分段表达E蛋白,证明了中和表位存在于E373~399位的27个氨基酸序列内[8]。Wu等发现JEV的中和位点主要集中在 EⅢ的 E307~309、E327~333、E386~390这3个区域内[9]。本研究通过截短表达鉴定出 JEV EⅢ的线性抗原表位 E39(305~320)、E45-1(355~366)、E48-1(377~384)和 E49(385~400),经体外病毒中和试验表明,E39为具有病毒中和活性的抗原表位[10]。
为了进一步确定E蛋白的抗原表位,本研究设计了一组覆盖E蛋白I、II结构区域的部分重叠短肽,基因合成后克隆于原核表达载体进行融合蛋白表达。通过对表达融合多肽进行western blot和ELISA反应性筛选,鉴定线性抗原表位为针对JE建立基于抗原表位水平的特异性诊断方法奠定了基础。
1 材料和方法
1.1 质粒、阳性血清及实验动物 质粒pGEX-6P-1、E.coliDH5α及BL21均为本实验室保存。兔抗JEV SA14-14-2疫苗株阳性血清由第四军医大学马文煜教授惠赠。BALB/c小鼠为中国农业科学院哈尔滨兽医研究所实验动物中心提供。
1.2 酶与标记物 限制性内切酶及T4 DNA连接酶均为TaRaKa公司产品;红外荧光标记(IRDye700)的抗兔IgG抗体、红外荧光标记(IRDye700)的抗鼠IgG抗体购自Rockland化学免疫试剂公司;IPTG、凝胶回收试剂盒为上海华舜生物工程有限公司产品。合成短肽由南京博亚生物有限公司合成。
1.3 短肽融合蛋白的设计 对E蛋白I、II结构区域(1 aa~296 aa)进行抗原表位作图,设计了一套覆盖全部E蛋白I、II结构区域的36个短肽E1~E36。这些短肽长为16 aa,部分重叠,各肽序列及位置如表1所示。并设计合成了36对寡核苷酸链。在编码区的5'端引入BamH I位点,3'端引入XhoI位点。寡核苷酸由北京英骏生物技术有限公司合成。
1.4 短肽的融合表达与纯化 pGEX-6P-1经BamH I、XhoI双酶切回收后分别与退火的各双链寡核苷酸连接,重组子经酶切鉴定后命名为pGEX-E1至pGEX-E36,由北京英骏生物技术有限公司测序验证。将重组质粒转化感受态大肠杆菌BL21,进行表达。将表达产物超声波裂解后,12%SDS-PAGE检测表达情况。可溶性短肽融合蛋白用谷胱甘肽Sepharose 4B RediPack亲和层析柱(Pharmacia Biotech)纯化,操作步骤按说明进行,纯化后测定蛋白质含量。不溶性短肽融合蛋白经超声波裂解后纯化[11]。
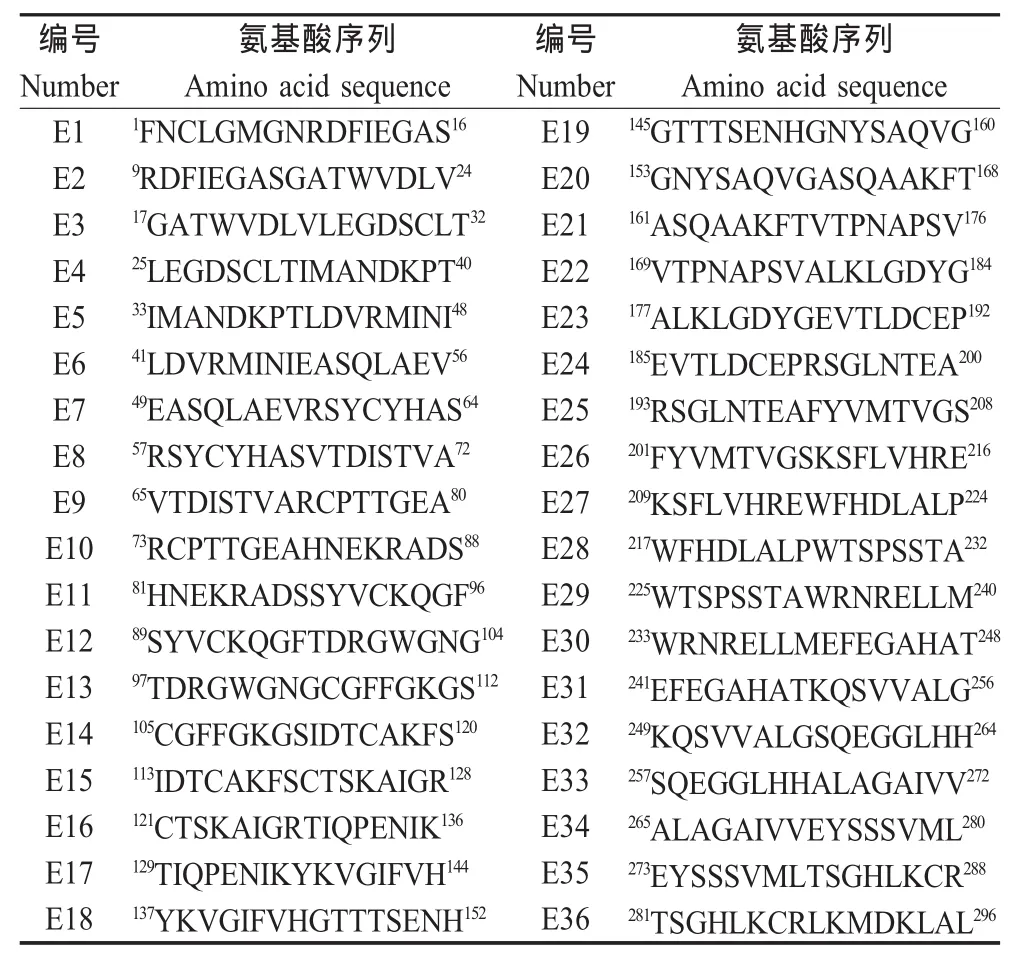
表1 短肽序列与位置Table 1 The sequence and the location of designed short peptides
1.5 抗原表位进一步确定 根据实验结果,将E10、E11进一步截短,设计系列短肽,如表2所示。具体步骤按1.4所述的方法进行。

表2 进一步确定的短肽序列与位置Table 2 The sequence and the location of deeply devided designed short peptides
1.6 抗融合蛋白血清的制备 融合蛋白的纯化按1.4所述方法进行。首免用纯化融合蛋白(浓度为1 mg/mL)与完全弗氏佐剂等体积混合乳化,腿部皮下注射免疫6周龄~8周龄雌性BALB/c小鼠5只(100 mg/只),每隔2周用与不完全弗氏佐剂等体积乳化的纯化融合蛋白加强免疫,第2次加强免疫后10 d采血分离血清,-20℃保存备用。
1.7 Western blot分析
1.7.1 检测融合蛋白与JEV阳性血清的免疫反应性样品经SDS-PAGE电泳后,转移至硝酸纤维素膜上,5%脱脂乳4℃封闭过夜,一抗为1∶100稀释兔抗JEV SA14-14-2株阳性血清,二抗为1∶5000稀释的红外荧光标记的抗兔IgG抗体,具体试验步骤按Odyssey双色红外激光成像系统说明书进行。
1.7.2 检测鼠抗融合蛋白免疫血清 将纯化的JEV样品经SDS-PAGE电泳后,转移至硝酸纤维素膜上,5%脱脂乳4℃封闭过夜。一抗用1∶100稀释的鼠抗融合蛋白免疫血清(该血清被过量的GST蛋白37℃孵育半小时),其它步骤同1.7.1。
1.8 ELISA分析检测
1.8.1 融合蛋白与阳性血清的免疫反应性 用0.1 mol/L碳酸盐缓冲液(pH9.6)将纯化的短肽融合蛋白按10 μg/mL的量包被ELISA板,4℃过夜,用1%BSA 37℃封闭3 h。以1∶100稀释的 JEV阳性血清为一抗,37℃作用1 h,以1∶5000稀释的HRP标记羊抗兔IgG抗体为二抗,37℃作用1 h,经TMB显色液显色15 min,读取450 nm波长测量吸收值。[以P/N值≥2为阳性,P/N值<2为阴性,P/N值=(检测孔A值-空白对照孔A值)/(阴性鼠血清100倍稀释A值-空白对照孔A值)]。
1.8.2 鼠抗融合蛋白血清与合成肽的免疫反应性用0.1 mol/L碳酸盐缓冲液(pH9.6)将合成短肽按10 μg/mL的量包被ELISA板,一抗为倍比稀释的鼠抗融合蛋白血清(1∶50~1∶800),同时设非免疫鼠血清为阴性对照,二抗加入1∶5000稀释的HRP标记羊抗鼠IgG抗体,具体试验步骤按1.8.1的试验方法进行。
2 结果
2.1 短肽融合蛋白的表达与纯化 经SDS-PAGE分析表明,各短肽融合蛋白均得到了表达(图略)。
2.2 短肽融合蛋白的western blot分析与ELISA检测 Western blot和ELISA结果表明,表达的融合蛋白 GST-E1、GST-E10、GST-E11、GST-E19和 GSTE33能被JEV阳性血清所识别(图1,图2)。由于GST-E10,GST-E11是一个连续的氨基酸序列,为了确定抗原表位的主要功能性区域,将该段基因进一步截短表达,通过蛋白质印迹结果表明该区域含有2个抗原表位,即E10-4和E11-2(图1)。
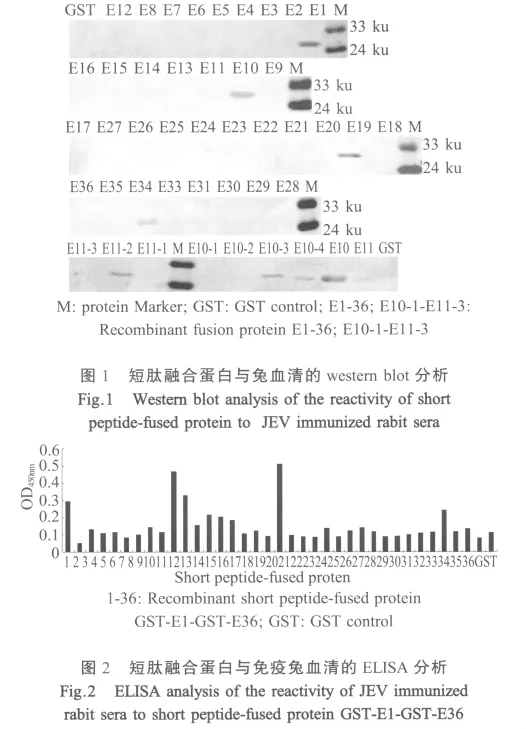
2.3 E蛋白1 aa~296 aa结构区域抗原表位作图36个相互重叠且覆盖E蛋白1 aa~296 aa的I、II结构区域的短肽融合蛋白经JEV阳性血清免疫印迹及ELISA筛选,以及通过免疫印迹进一步精确定位后,最终确定E1、E10-4、E11-2、E19和E335个线性抗原表位,表位作图如下(图3)。

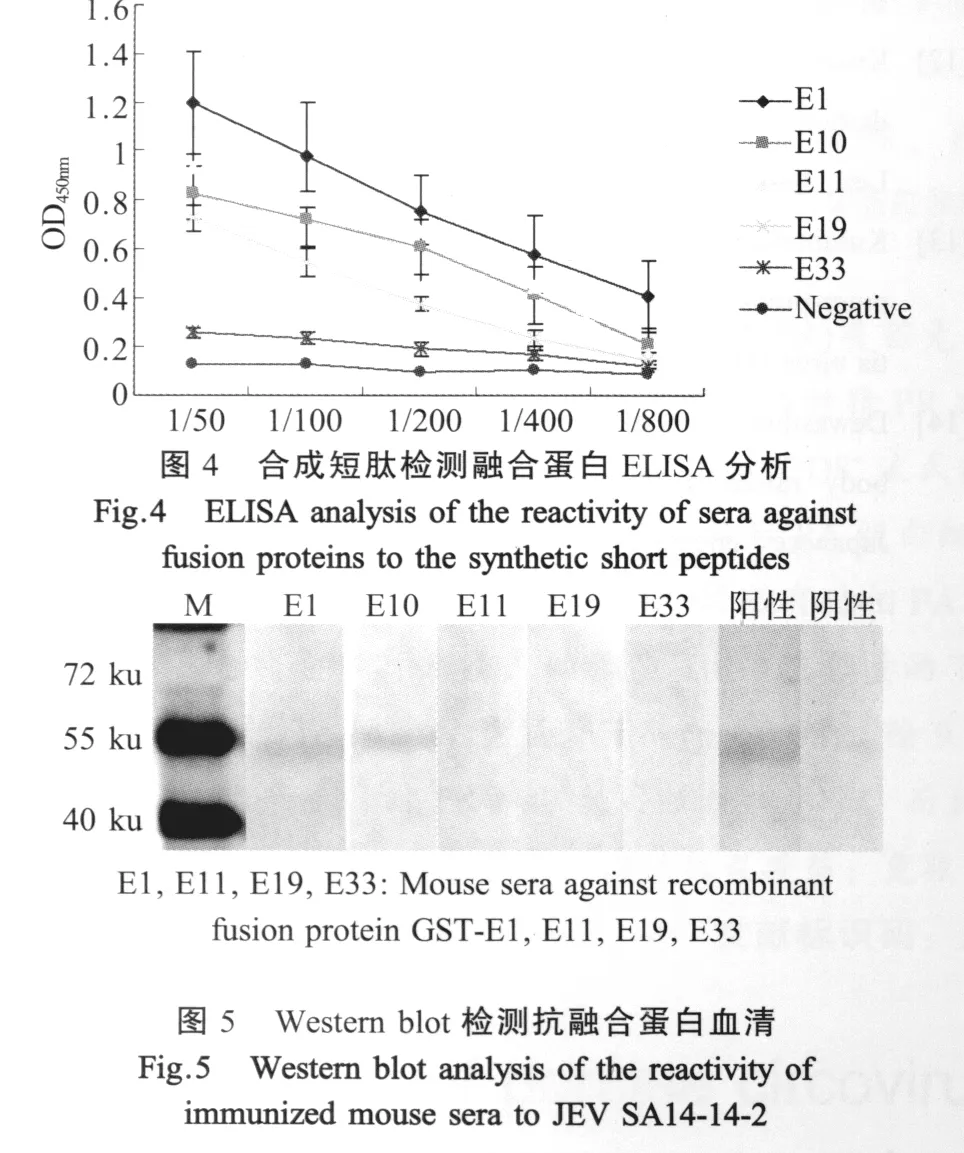
2.4 融合短肽免疫原性分析 融合蛋白GST-E1、GST-E10、GST-E11、GST-E19和GST-E33经纯化免疫小鼠制备了免疫血清,通过合成短肽包被ELISA板进行分析表明,这些融合短肽能诱导小鼠产生针对相应短肽的特异抗体,而且抗体滴度高于1∶200(图4),该结果表明所鉴定出的抗原表位均具有良好的免疫原性。而与全病毒的western blot结果表明,只有抗GST-E1,GST-E10,鼠血清能识别全病毒抗原(图5),分子量约为53 ku。
3 讨论
3.1 E蛋白1 aa~296 aa区域的表位鉴定 本实验采用原核表达系统对E蛋白I、II结构域1 aa~296 aa进行表位鉴定。通过免疫学反应性筛选,鉴定出5个线性抗原表位:E1(1 aa~16 aa)、E10-4(77 aa~84 aa)、E11-2(83 aa~94 aa)、E19(145 aa~160 aa)和 E33(257 aa~272 aa)。其中的 E11-2、E19和E33与1999年预测的表位E86~90、E153~158、E258~285及Kolaskar和Tongaonkar所预测的E88~95 相似[7,12]。而且,其中 E10(73 aa~88 aa)与Kutubuddin等报道的线性中和表位74 aa~87 aa重叠[13];E19(145 aa~160 aa)表位包含E蛋白上唯一的糖基化位点,Dewasthaly等制备了一株抗表位E149 aa~163 aa具有中和活性的MAb[14],该位点与本实验鉴定的E19表位有12个氨基酸的重叠,E10和E19是否具有中和活性,还需进一步的实验来证明。本实验所确定的表位除E10和E19外,其它均是第一次通过实验方法确定的。
3.2 抗原表位的免疫原性 融合蛋白GST-E1,GST-E10,GST-E11,GST-E19和GST-E33经纯化免疫小鼠制备了免疫血清,通过合成短肽包被ELISA板进行分析表明,GST-E1诱导的免疫原性最强,其次是 GST-E10、GST-E11和 GST-E19,最弱的是GST-E33。这些融合短肽能诱导小鼠产生针对相应短肽的特异抗体,而且抗体滴度高于1∶200该结果表明所鉴定出的抗原表位均具有良好的免疫原性,为今后建立基于表位水平的特异性诊断JE试剂的研发奠定了基础。
单因子血清与全病毒进行western blot分析,发现GST-E1和GST-E10制备的血清有反应性,而处于E蛋白中间的抗原表位融合蛋白GST-E11、GST-E19和GST-E33制备的血清没有与全病毒反应。分析原因可能是由于E19(145 aa~160 aa)中包含E蛋白上唯一的糖基化位点和一个二硫键位点,E33(257 aa~272 aa)处有一个a-螺旋,E11(81 aa~96 aa)位于域П,由于原核表达蛋白不能进行正确的折叠以及糖基化修饰等蛋白质的后期加工,所以导致GST-E11、GST-E19和GST-E33制备的单因子血清没有与全病毒反应。
[1]Vaughn D W,Hoke C H.The epidemiology of Japanese encephalitis:prospects for prevention[J].Epidemiol Rev,1992,14:197-221.
[2]Yamada M,Nakamura K,Yoshii M,Kaku Y.Nonsuppurative encephalitis in piglets after experimental inoculation of Japanese encephalitis flavivirus isolated from pigs[J].Vet Pathol,2004,41:62-67.
[3]Takeshi N,Hyunh T K,Shingo I,et al.Evidence of frequent introductions of Japanese encephalitis virus from south-east Asia and continental east Asia to Japan[J].J Gen Virol,2009,90:827-832.
[4]Zhang J S,Zhao Q M,Zhang P H,et al.Genomic sequence of a Japanese encephalitis virus isolate from southern China[J].Arch Virol,2009,154:1177-1180.
[5]Van Den Hurk A F,Montgomery B L,Northill J A,et al.Short report:the first isolation of Japanese encephalitis virus from mosquitoes collected from mainland Australia[J].Am J Trop Med Hyg,2006,75(1):21-25.
[6]Parida M,Dash P K,Tripathi N K,et al.Japanese encephalitis outbreak,India,2005[J].Emerg Infect Dis,2006,12(9):1427-1430.
[7]Kolaskar A S,Urmila K K.Prediction of Three-Dimensional structure and mapping of conformational epitopes of envelope glycoprotein of Japanese encephalitis virus[J].Virology,1999,261:31-42.
[8]Seif S A,Morita K,Matsuo S,et al.Finer mapping of neutralizing epitopes on the terminal of Japanese encephalitis virus E-protein expressed in recombinantEscherichia colisystem[J].Vaccine,1995,13:1515-1521.
[9]Wu S C,Lin C W.Neutralizing peptide ligands selected from phage-displayed libraries mimic the conformational epitope on domainⅢof the Japanese encephalitis virus envelope protein[J].Virus Res,2001,76:59-69.
[10]Yan L P,Hua R H,Qi W B,et al.Antigenic epitopes mapping and functional analysis of domain III of Japanese encephalitis virus envelope protein[J].Prog Biochem Biophys,2008,35(3):341-348.
[11]闫丽萍.流行性乙型脑炎病毒SA14-14-2株全基因组序列分析及E蛋白抗原表位鉴定[D].中国农业科学院,2007年.
[12]Kolaskar A S,Tongaonkar P C.A semi-empirical method for prediction of antigenic determinants on protein antigens[J].FEBS Lett,1990,276:172-174.
[13]Kutubuddin M,Gore M M,Banerjee K,et al.Analysis of computer-predicted antibody inducing epitope on Japanese encephalitis virus[J].Acta Virol,1993,37(6):417-428.
[14]Dewasthaly S,Ayachit V M,Sarthi S A,et al.Monoclonal antibody raised against envelope glycoprotein peptide neutralizes Japanese encephalitis virus [J].Arch Virol,2001, 146:1427-1435.

