酒石酸泰乐菌素联合阿莫西林钠缩小猪链球菌耐药突变选择窗的研究
刘 洋,徐 刚,王 敏,李洪涛,李艳华*
(东北农业大学动物医学学院,黑龙江哈尔滨150030)
猪链球菌病是由多种溶血性链球菌(Streptococcus suis)引起的人兽共患的急性、热性传染病,呈世界范围流行,给养猪业及公共卫生构成了严重的威胁。目前,尚无理想的疫苗来预防该病,抗生素在预防和治疗猪链球菌病中起着重要的作用。但由于大量和不合理的使用抗生素,S.suis的耐药问题日益严重。因此,如何合理使用现有的抗菌药物,减少和延缓细菌耐药性的产生,就显得十分重要。Zhao等首先提出了关于防细菌耐药突变选择浓度(Mutant prevention concentration,MPC)、突变选择窗(Mutant selection window,MSW)的新假说和新理论,为临床优化抗菌药物给药方案,限制耐药突变体选择性扩增提供了新思路[1]。MPC是指防止单次突变菌株被选择性富集扩增所需的最低抗菌药物浓度。但是对某些器官来说,临床上单独应用一种药物时,要获得血浆或组织药物浓度超过MPC是很困难的,可能会引起宿主严重的毒性反应,所以对不能使组织或血清药物浓度超过MPC的药物可以通过联合用药来防止细菌耐药。酒石酸泰乐菌素(TLST)是一种大环内酯类动物专用抗生素[2],为快效抑菌剂。阿莫西林(Amoxil)为β-内酰胺青霉素类抗生素,由于其对细菌强效的抑制作用且低毒,是兽医临床主要的抗生素之一[3],是细菌繁殖期杀菌剂。传统的理论认为,大环内酯类抗生素和β-内酰胺类抗生素联合应用产生拮抗作用。但近年来,临床上将二者合用却得到了较好的疗效,也有不少报道认为两者合用治疗重症感染,特别是难治感染效果良好[4]。本试验通过测定TLST和Amoxil钠各自单药及二者联合用药对S.suis临床分离株的MSW变化,在体外初步探讨两种不同作用机制的抗菌药物联合应用是否可以缩小单药对细菌的MSW,为临床合理使用现有抗菌药物,防止细菌耐药产生提供理论依据。
1 材料和方法
1.1 菌株与病料 质控菌株金黄色葡萄球菌ATCC 29213购于中国兽药监察所。病料系2006年~2007年分别从东北三省各猪场通过灭菌棉拭子采集猪鼻腔分泌物。选取对TLST和Amoxil钠均敏感的一株菌株,作为实验菌株,编号为D10分离株。
1.2 药 物 TLST(含量:92.2%)原粉购自西安亨通光华制药有限公司。Amoxil钠(含量:100%)原粉购自浙江拓扑药业有限公司。TLST、Amoxil钠、复方TLST-Amoxil钠分别配制成有效浓度为1024 μg/mL、1536 μg/mL、1024 μg/mL+1536 μg/mL(根据实验室棋盘微量稀释法的结果,TLST和Amoxil钠在2∶3时,对S.suis抗菌作用最好),灭菌过滤,-20℃贮存。
1.3 最低抑菌浓度(MIC)测定 采用琼脂平板二倍稀释法:取S.suisD10分离株冻存菌株接种至脑心浸液琼脂平板,37℃孵育过夜。取单个菌落接种于脑心浸液培养基中,37℃过夜培养。比浊法将菌液浓度先调整为0.5麦氏管悬液(1.5×108cfu/mL),然后用脑心浸液培养基稀释为约5×105cfu/mL。用倍比稀释法分别配制含TLST溶液、Amoxil钠溶液、TLST和Amoxil钠混合液(2∶3)的琼脂平板,浓度分别为0.05 μg/mL~38.4 μg/mL,19.2 μg/mL+12.8 μg/mL~0.0375 μg/mL+0.25 μg/mL。分别取 1.5×l05cfu/mL 菌液 100 μL接种于不同浓度的抗菌药物平板上,37℃培养18 h~24 h后观察结果,以平板上无细菌生长的最低药物浓度定为MIC,并计算FIC。[注:FIC=(联合用药时TLST的MIC/单独应用时TLST的MIC)+(联合应用时 Amoxil钠的 MIC/单独应用时 Amoxil钠的MIC),FIC≤0.5,协同作用;0.5<FIC≤1,相加作用;1<FIC≤2.0,无关作用;FIC>2.0,拮抗作用]。药敏结果严格根据NCCLS标准[5]判读。
1.4 MIC99测定 以抑制99%接种细菌生长的最低抗菌药物浓度为MIC99。采用琼脂平板稀释法测定MIC99。参照文献[1]方法,以各药MIC为基准,线性递减(10%)抗菌药物浓度配制含药琼脂平板直至1/2 MIC。按照1.3方法进行细菌富集,将菌液浓度先调整为3.0×108cfu/mL,再用肉汤10倍倍比稀释至3.0×102cfu/mL。在每个含药平皿及无药平皿分别接种不同浓度菌液100 μL,37℃过夜培养,进行菌落计数,计算MIC99。
1.5 防突变浓度(MPC)测定 采用琼脂平板稀释法测定抗菌药物对S.suisD10分离株的MPC。参照文献[1]的方法,以各药MIC为基准,按照倍比稀释递增7个浓度,配制琼脂平板。富集细菌,分别取3.0×l010cfu/mL菌液100 μL均匀涂抹在含有倍比稀释的抗菌药物琼脂平板上,每个浓度4个平板,各平板细菌总接种量为1.2×l010cfu,通过菌落计数确保每个浓度平板的接种量>l010cfu。37℃孵育,以72 h时无菌落生长的最低药物浓度称为初测MPC(MPCpr)。以MPCpr为基准,依次递减(20%)抗菌药物浓度重新配制含药琼脂平板,测定72 h时菌落生长的最低药物浓度定为MPC。对接近MPC的药物浓度筛选出的菌株再接种于无药平板上,传代5次后,再接种于原筛选浓度的抗菌药物平板上,确保所筛选出的菌株为耐药突变株,冻存备用。
重复以上实验3次,保证实验结果的准确性。
2 结果与讨论
本实验通过琼脂平板二倍稀释法,分别测定了TLST、Amoxil钠、复方TLST-Amoxil钠对S.suisD10分离株的MIC、MIC99和MPC,结果见表1、表2。

表1 TLST、Amoxil钠、TLST和Amoxil钠联合对S.suisD10分离株的MIC9及MIC99Table 1 MICand MIC99 of tylosin tartrate,Amoxicillin Sodium and tylosin tartrate combined with Amoxicillin Sodium forS.suisstrain D10isolate
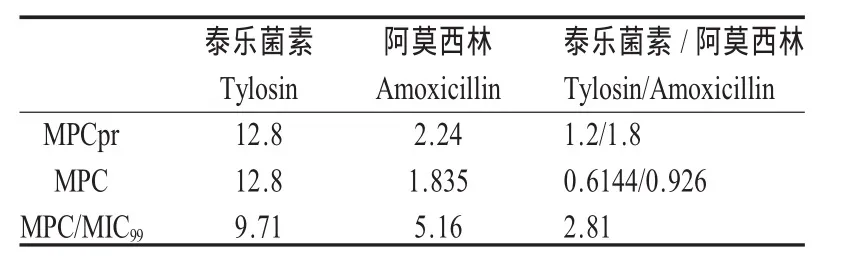
表2 TLST、Amoxil钠、TLST和Amoxil钠联合对S.suisD10分离株的MPC及MSWTable 2 MPC and MSW of tylosin tartrate,Amoxicillin Sodium and tylosin tartrate combined with Amoxicillin Sodium forS.suisstrin D10isolate
由表1和表2可看出,TLST素单药的MIC为1.62μg/mL、Amoxil钠单药的MIC为0.56μg/mL、TLST和 Amoxil钠联用的 MIC 为 0.3 μg/mL 和 0.45 μg/mL,FIC指数为0.99,呈相加作用,这与本实验室的联合药敏试验结果一致。说明TLST和Amoxil钠联合应用可降低两药单用对S.suisD10分离株的MIC及MIC99。TLST单药的 MPC和 MSW 为 12.8 μg/mL和 9.71 μg/mL,Amoxil钠单药的 MPC和 MSW 为1.835 μg/mL 和 5.16 μg/mL,两药联用的 MPC 和MSW 为 0.6144 μg/mL、0.9216 μg/mL 和 2.81 μg/mL,结果表明TLST和Amoxil钠联用可降低两药单用的MPC,并能缩小两药单用的耐药突变窗,即联用后可使TLST的耐药突变窗缩小3.5倍、Amoxil钠的耐药突变窗缩小1.8倍。
MPC和MSW理论为有效抑制细菌耐药及制定抗菌药物应用策略提供了新的思路和参考依据[7]。临床可以采取缩小或关闭MSW的方法来抑制细菌耐药[8]。但对大多数药物来说,要获得血浆或组织液药物浓度超MPC是很困难的。当两种不同作用机制的抗菌药物联合应用,细菌需要同时发生两种耐药突变才能生长。因此,不同作用机制的药物联合应用提供了一种关闭MSW的途径,即使这些药物各自都有非常高的MPC[9]。而本实验所研究的两种抗菌药物中,TLST和Amoxil这2种药物作用机制各不相同,都是治疗S.suis较为理想的药物。
S.suis是否对TLST和Amoxil钠发生了两种耐药突变,还需要进一步的分子生物学的实验证实。综上所述,TLST和Amoxil钠联合使用后,可以使S.suisMPC/MIC大大下降,说明TLST和Amoxil钠复方制剂不仅可用于S.suis病的治疗,而且可以降低彼此的耐药突变选择窗,延缓或降低S.suis耐药性的产生。
[1]Zhao X,Drlica K.Restricting the selection of antibiotic-resistant mutants:a general strategy derived from fluoroquinolone studies[J].Clin Infect Dis,2001,33(Suppl 3):147-156.
[2]洪学.正确安全使用泰乐菌素[J].猪业科学,2009,1:110.
[3]张玲玲,江善祥.阿莫西林药理与毒理研究进展[J].兽药与饲料添加剂,2009,14(1):20-23.
[4]武丽,张文波,李景艳,等.β-内酰胺类与大环内酯类抗生素联合应用的合理性[J].山西职工医学院学报,2007,17(2):78-80.
[5]Clinical and Laboratory Standards Institute/NCCLS.Performance standards for antimicrobial susceptibility testing,Fifteenth informational supplement.CLSI/NCCLS document M100-S15[M].Wayne,Pennsylvania,Clinical and Laboratory Standards Institute,2005,25(1).
[6]Spiss H K,Kofler M,Hausdorfer H,et al.Streptococcus suismeningitis and neurophysiology of the acoustic system[J].First case report from Austrial.Nervenarzt Aug.1999,70(8):738-741.
[7]李朝霞,刘又宁.细菌耐药突变选择窗理论与抗菌药物合理应用[J].中国药学杂志,2006,41(16):1201-1204.
[8]施毅,苏欣.关注抗菌药物的防突变浓度[J].中国实用内科杂志,2006,1(26):76-79.
[9]崔俊昌,刘又宁.抗菌药物防突变浓度及其临床意义[J].国外医学呼吸系统分册,2003,6(23):315-318.

