聚乙二醇化尿酸酶体内外稳定性研究
杨 剑,朱 姝,才 蕾,田 ,姚文兵
(中国药科大学 生命科学与技术学院,江苏,南京 210009)
聚乙二醇化(PEGylation)又称为PEG修饰,是目前分子变构化学中最重要的技术之一。单甲氧基聚乙二醇经过活化带上亲电基团,可以与蛋白质分子上的亲核基团(如自由氨基和末端氨基)共价结合进行修饰[1-3]。PEG修饰不仅可以增加蛋白质的水溶性,还能减少肾脏的清除,优化蛋白质的药代动力学和药效学性质,克服蛋白质类药物在临床应用中的困难,因而在蛋白质类药物的开发中得到了广泛的应用[4-5]。
尿酸酶(Urate Oxidase,Uricase,EC 1.7.3.3)是生物体内嘌呤降解代谢途径中的一种酶,催化尿酸氧化为水溶性较高的尿囊素排出体外[6]。尿酸酶在治疗顽固性痛风及高尿酸血症方面有很好的效果[7-8],但由于免疫原性较高,易引起过敏反应等使其临床应用受到了一定限制。而PEG修饰可以克服这些缺点,因而PEG化尿酸酶的研究越来越受到重视。
本文着重考察尿酸酶和PEG化尿酸酶的体内外稳定性差异,并比较修饰前后尿酸酶在小鼠体内半衰期的变化,为PEG化尿酸酶的开发提供参考。
1 材 料
PEG化尿酸酶、尿酸酶(工程菌pBV220-Uricase/DH5α表达),自制;尿酸、胰蛋白酶、活性检测液(1 mmol/L DHBS,0.2 mol/L Na3PO4,0.25 mmol/L 4-AAP,25 U/mL HRP),Sigma公司,其余均为国产分析纯试剂。
BALB/c小鼠(清洁级,雄性,25 g),扬州大学比较医学研究中心,合格证号:SCXK(苏)2009-0004。
752 型紫外光栅分光光度计,上海第三分析仪器厂;MK3全波长酶联免疫检测仪(Thermo Electron Corporation)。
2 方 法
2.1 尿酸酶活性测定
尿酸酶活性测定反应体系为pH 8.4,0.1 mol/L硼酸-硼砂缓冲液,以0.001%尿酸为底物,25℃反应5 min,每隔30 s在293 nm波长处测定1次吸光度值。酶活单位定义为:每1 min催化1μmol底物转化为产物所需的酶量。
2.2 热稳定性研究
分别取1mg/mL尿酸酶和PEG化尿酸酶溶液,于4~80℃条件下水浴30 min,取出静置至25℃,按照2.1项方法测定酶活性。结果以活性保留百分数表示。
2.3 酸碱稳定性
分别将尿酸酶与PEG化尿酸酶透析置换于下列缓冲体系中:0.1 mol/L醋酸-醋酸钠缓冲液(pH 3.6,4.0,5.2);0.1 mol/L磷酸缓冲液(pH 6.0,6.8);0.1mol/L硼酸缓冲液(pH 7.6,8.4);0.1 mol/L甘氨酸-氢氧化钠缓冲液(pH 9.2,10.0),4℃放置24 h。调节pH至8.5,按照2.1项方法测定活性。结果以活性保留百分数表示。
2.4 抗胰蛋白酶水解能力
配制1mg/mL的胰蛋白酶溶液,缓冲体系为pH 8.4,0.1 mol/L硼酸缓冲液,将胰蛋白酶溶液与1mg/mL尿酸酶和1mg/mL PEG化尿酸酶分别按照5∶1的比例混合,37℃温育,定时取样,按2.1项方法测定酶活性。结果以活性保留百分数表示。
2.5 小鼠体内半衰期的测定
取BALB/c小鼠12只,随机分为2组,每组6只。两组小鼠分别尾静脉注射尿酸酶和PEG化尿酸酶0.2mg/kg,并于给药后10,30,60,120 min以及4,6,10,24 h眼眶取血。按常规分离血清,于-20℃保存待测。
取血清20μL用pH 8.4,0.1 mol/L的硼酸缓冲液200μL稀释后,取100μL加入酶标板,再加入0.01%尿酸底物溶液80μL和活性检测液100μL,反应20 min后,在570 nm波长处测定吸光度值[9]。
3 结 果
3.1 热稳定性
尿酸酶和PEG化尿酸酶对温度的稳定性试验结果如图1所示。从图1可以看出PEG化尿酸酶在4~60℃范围内是稳定的,而尿酸酶在40℃时,酶活降至最高值的70%。超过60℃时,PEG化尿酸酶及尿酸酶活性均迅速降低。
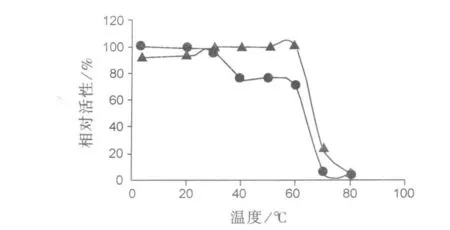
图1 PEG化尿酸酶及尿酸酶的温度稳定性Fig.1 Thermal stability of PEG-uricase and native uricase
3.2 酸碱稳定性
尿酸酶和PEG化尿酸酶对酸碱的稳定性试验结果如图2所示。从图2可以看出,pH 5.2~6.0及pH 9.2~10.0之间,尿酸酶活性迅速降低,而在这一pH范围内,PEG化尿酸酶保留了较高的活性。

图2 PEG化尿酸酶和尿酸酶的pH稳定性Fig.2 pH stability of PEG-uricase and nativeuricase
3.3 抗胰蛋白酶水解能力
结果见图3。PEG化尿酸酶比尿酸酶有更好的抗胰蛋白酶降解的能力。尿酸酶在胰蛋白酶作用下100 min后活性降至50%,在作用200 min后活性降至20%;而PEG化尿酸酶在200 min后仍保留70%的活性。
3.4 小鼠体内半衰期的测定
随着PEG化尿酸酶及尿酸酶经尾静脉注射至小鼠体内,其活性随着时间逐渐降低,结果如图4。经药代动力学软件进行房室模型拟合及药代动力学参数计算,PEG化尿酸酶的血浆半衰期为1530 min,而尿酸酶半衰期为45 min。
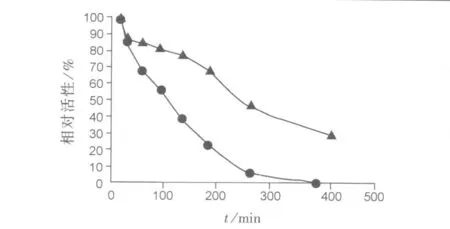
图3 PEG化尿酸酶和尿酸酶的抗胰蛋白酶水解能力Fig.3 Resistanceto proteolysis of PEG-uricase and uricase

图4 PEG化尿酸酶和尿酸酶在小鼠体内的消除速率Fig.4 Circulation half-lifetimeof PEG-uricase and uricase in vivo
4 讨 论
经过PEG修饰,尿酸酶的体内外稳定性有较大幅度的提高。在体外试验中,PEG化尿酸酶显示了不同于尿酸酶的热稳定性和酸碱稳定性。值得关注的是,酸碱稳定性试验结果显示,PEG化尿酸酶在其等电点附近较好的保留了活性,而尿酸酶在等电点附近活性明显下降。推测可能是由于PEG的亲水链阻止了蛋白质在等电点处的聚集,因而提高了稳定性。抗胰蛋白酶水解能力的提高,则可能是由于聚乙二醇在尿酸酶分子表面的空间位阻作用,使蛋白的活性部位和维持构象的次级键免受酶水解破坏,从而提高了其抗蛋白酶水解的能力。
在临床使用中,尿酸酶需要每天注射,不仅是尿酸酶,大多数蛋白质药物的半衰期都非常短,这是由于蛋白质能轻易的被肾小球滤过,并且蛋白水解作用也缩短了药物半衰期。经过PEG修饰可以很好的解决上述问题,如PEG修饰可以增加蛋白质药物的相对分子质量,增大的流体半径可以减少肾小球的滤过;此外,PEG修饰蛋白质药物也可以遮蔽蛋白水解酶的水解位点来增强其抗酶解能力。本研究证明,尿酸酶经PEG修饰,其半衰期由原来的45 min增至1 530 min。因此,用PEG修饰尿酸酶是提高尿酸酶生物半衰期的有效方法。
[1]Harris JM,Zalipsky S.Poly(ethyleneglycol)Chemistry and Biological Applications[M].Washington DC:American Chemical Society,1997:347-381.
[2]姜忠义,许松伟,高蓉.生物分子化学修饰用聚乙二醇衍生物的合成及应用[J].高分子通报,2002,(1):34-40.
[3]田氵宏,姚文兵.聚乙二醇化技术在药物转运系统中的研究进展[J].中国药科大学学报,2008,(4):379-384.
[4]Harris J M.Peptide and protein pegylationⅡ-clinical evaluation[J].Adv Drug Deliv Revi,2003,55:1259-1260.
[5]董惠钧,姜俊云,郑立军,等.蛋白药物聚乙二醇修饰技术研究进展[J].中国生化药物杂志,2009,30(3):199-203.
[6]Bosly A,Sonet A,Pinkerton CR,etal.Rasburicase(recombinant urate oxidase)for the management of hyperuricemia in patients with cancer:report of an international compassionateuse study[J].Cancer,2003,98(5):1048-1054.
[7]Sundy JS,Hershfield MS.Uricase and other novel agents for themanagement of patients with treatment-failure gout[J].Curr Rheumatol,2007,9:258-264.
[8]Sherman M R,Saifer M G,Perez-Ruiz F.PEG-uricase in the management of treatment-resistant gout and hyperuricemia[J].Adv Drug Deliv Rev,2008,60:59-68.
[9]Fraisse L,Bonnet M C,Farcy de JP,etal.A colorimetric 96-well microtiter plate assay for thedetermination of urate oxidaseactivity and its kinetic parameters[J].Anal Biochem,2002,309:173-179.

