大黄素-BSA不同表位构型的免疫原性和特异性研究
李丽华 刘文泰 戴 军 窦玉红 王 茹 刘艳臣 彭 洋 (河北医科大学,石家庄 050091)
大黄素-BSA不同表位构型的免疫原性和特异性研究
李丽华 刘文泰 戴 军 窦玉红 王 茹 刘艳臣 彭 洋 (河北医科大学,石家庄 050091)
目的:研究不同偶联法制备大黄素-BSA的大黄素表位构型及其免疫原性和特异性。方法:用重氮化对氨基苯甲酸偶联法和琥珀酸酐偶联法制备两种不同表位构型的大黄素-BSA1和大黄素-BSA2抗原,免疫小鼠制备抗血清,用醋酸纤维素膜双向免疫扩散法检测免疫原性及其抗体特异性。结果:大黄素-BSA1和大黄素-BSA2抗血清与大黄素反应的抗体效价分别为1∶144 0±357.771和1∶440±219.089,二者有极显著性差异(P=0.006)。分别与大黄素等五种蒽醌类化合物反应,前者对大黄素有较高特异性,抗原结合效价可达1∶1 843.2±457.947。后者对大黄素的特异性较低,结合效价仅为1∶8.8±4.382。结论:两种偶联法制备大黄素-BSA的表位构型不同,其免疫原性和特异性存在着显著差异。重氮化对氨基苯甲酸偶联法制备大黄素-BSA的免疫原性较高、大黄素特异性较强。
抗原抗体反应;双向免疫扩散法;大黄素;半抗原-载体偶联法;表位
制备抗中药成分抗体,运用抗原抗体检测技术定性或定量测定中药成分,对于鉴定中药材品质和控制中药制剂质量,具有广阔的应用前景。中药的有效或标志性成分,多数是小分子半抗原,须与大分子载体偶联成半抗原-载体复合物,才具免疫原性,方能制备抗体。在制备半抗原-载体复合物时,选择中药小分子成分(半抗原)与蛋白载体连接的偶联方法,决定着半抗原的表位构型,直接影响着其免疫原性和特异性。
大黄素为蒽醌类化合物,是蓼科中药材中常见的有效成分和标示性成分。蒽醌母核上6号位酚羟基,是大黄素区别于大黄素甲醚和大黄酚的特征性结构,因此,大黄素是研究半抗原-载体复合物表位构型及其特异性的理想实验材料[1]。本文以大黄素酚羟基与载体连接的琥珀酸酐偶联法和以酚羟基邻位或对位与载体连接的重氮化对氨基苯甲酸偶联法,制备了两种不同表位构型的大黄素-牛血清蛋白(BSA)抗原,通过免疫小鼠制备抗血清,研究了两种抗原的免疫原性和特异性[2,3]。并依据实验结果和大黄素化学结构,探讨分析了两种抗原的大黄素表位构型与免疫原性和特异性关系。
1 材料与方法
1.1 药品与器材 大黄素、大黄素甲醚、大黄酚、芦荟大黄素、大黄酸标准品(DELTA天然有机化合物信息中心);小牛血清白蛋白、EDCI(Sigma公司);透析袋(上海华美生物工程有限公司);醋酸纤维素膜(浙江四青生化材料厂);紫外分光光度计(λ-2,1 100 nm,美国PE公司);其他试剂均为分析纯。
1.2 大黄素-BSA的偶联方法
1.2.1 重氮化对氨基苯甲酸偶联法[4]取对氨基苯甲酸800mg,亚硝酸钠400mg溶于三蒸水10ml中,置冰浴中搅拌20分钟,加少量尿素得重氮盐溶液。取大黄素140mg溶于2%碳酸钠溶液(pH9.0)10m l,在不断搅拌下逐滴加入到重氮盐溶液中,室温搅拌25分钟。然后逐滴加入BSA溶液(BSA 500 mg溶于pH7.4 0.01mol/L PBS 25m l溶液)和EDCI 91mg,避光搅拌20小时。最后将其置于透析袋中,4℃用PBS液透析两天,期间多次换液,至透析袋外液几乎无色为止,取透析袋内容物,用PBS液调至50m l,即为大黄素-BSA1,分装后冷冻保存。
1.2.2 琥珀酸酐偶联法[5]取琥珀酸酐80 mg溶于二氧六环10m l后,加入大黄素140 mg,搅拌溶解,再加入三乙胺0.25m l,置30℃搅拌1小时,待溶液冷却至室温后,同1.2.1法制得大黄素-BSA 2。
1.2.3 大黄素-BSA结合比的测定与计算[2]大黄素-BSA结合比,即每分子BSA所结合大黄素的分子数。用紫外分光光度计对大黄素、BSA、大黄素-BSA和末次透析外液,从波长200 nm到600 nm进行扫描,取 450 nm 处吸光度 ,依公式 N=(E半抗原-载体复合物-E载体)/E半抗原,计算大黄素-BSA 结合比。E=(A/CL)×M/10(L为测定时液层厚度,M为吸光物质的摩尔质量,A为所测吸光度,C为被测物浓度,C大黄素-BSA以CBSA为准)。第一次计算时,因尚不清楚每分子BSA所结合大黄素的分子数,故取BSA的M值作为大黄素-BSA的估算值,所得结合比需进行再次回归计算,再次回归计算时M大黄素-BSA=68000+270×N。
1.3 抗血清的制备
1.3.1 实验动物及其分组 雌性昆明小鼠,6周龄,体重20克,清洁级,购于河北医科大学实验动物中心,合格证号903041,自行饲养。随机分成大黄素-BSA1组、大黄素-BSA2组、实验对照组,每组5只。
1.3.2 免疫小鼠制备抗血清 初次免疫取抗原0.3 ml与等量不完全弗氏佐剂混合乳化后,多点皮下注射0.1 ml/只。两周后同上法加强免疫一次,免疫剂量为0.08ml/只。再间隔两周,用不加佐剂的抗原皮下注射0.05m l/只。实验对照组分别用PBS液取代抗原,同法皮下注射免疫。末次免疫后第4天,球后动脉放血制血清,-20℃冷冻保存。
1.4 大黄素-BSA的免疫原性及特异性检测
1.4.1 抗原反应液的制备 分别取大黄素、大黄素甲醚、大黄酚、芦荟大黄素、大黄酸的标准品各1mg,溶于1.5 ml无水乙醇,加 PBS液至2.5 ml,制成60%乙醇溶解的抗原反应液。
1.4.2 大黄素-BSA的免疫原性检测 用醋酸纤维素膜双向免疫扩散法,在96孔板的一排各孔中,分别依次加入用 PBS稀释的抗血清 1∶200、1∶400、1∶800、1∶1 600、1∶3 200、1∶6 400 和 PBS 对照各 0.2 ml;间隔两排的对应各孔,加入大黄素抗原反应液(0.4mg/ml)各0.2ml,每组设3个同水平复孔。将醋酸纤维素膜剪成55mm×5mm小条,小条两端分别插入抗血清和大黄素抗原的对应孔内,置于湿盒内室温扩散2小时。取出醋酸纤维素膜条,依次用0.5%氨基黑蛋白染液染色1分钟、PBS漂洗2次、2%冰醋酸水溶液脱色。肉眼观察醋酸纤维素膜条中段形成沉淀线情况,取最大稀释度抗血清仍能形成沉淀线作为抗体效价。用SPSS16.0统计软件,取本组5只鼠抗血清抗体效价的对数值,进行秩和检验,判定各组抗原的免疫原性。
1.4.3 大黄素-BSA的特异性检测 分别取五种蒽醌类化合物的抗原反应液,在96孔板一排的各孔中分别依次加入用60%乙醇稀释的1∶2、1∶4、1∶8、1∶16直至1∶4 096的倍比稀释液和空白对照(60%乙醇液)0.2m l,间隔两排的对应孔加入抗血清(用PBS液稀释成1∶200)0.2 ml,每组设3个同水平复孔。同1.4.2法进行醋酸纤维素膜双向免疫扩散,取最大稀释度抗原仍可见沉淀线作为抗原结合效价。用SPSS16.0统计软件,取本组5只鼠抗血清与五种蒽醌类化合物反应的抗原结合效价对数值,进行秩和检验,判定各组抗血清抗体的特异性。
2 结果
2.1 不同偶联法的大黄素-BSA结合比 大黄素在450 nm处有典型吸收,而 BSA在此处几乎没有吸收。紫外扫描发现两组大黄素-BSA均在450 nm处有明显吸收,而经反复换液透析后的最终透析外液在450 nm处吸收峰极低,表明透析袋内容物的450 nm吸收,主要来自大黄素-BSA,而不是游离大黄素所致。取450 nm所测各物质的A值,经两次回归计算,得大黄素-BSA 1和大黄素-BSA2的结合比分别为12和13,二者结合比相近。
2.2 两种偶联法制备大黄素-BSA的免疫原性 大黄素-BSA1和大黄素-BSA2抗血清与大黄素反应形成的沉淀线见图1,其抗体效价见图2,二者有极显著性差异(P=0.006)。实验对照组均未见沉淀线形成,大黄素-BSA 1的免疫原性显著高于大黄素-BSA2。

图1 两种偶联法大黄素-BSA醋酸纤维素膜双向免疫扩散沉淀线Fig.1 Precipitation of the two Emodin-BSA with doub le immunodiffusion on cellu lose acetatemembrane

图2 大黄素-BSA1和大黄素-BSA2的大黄素免疫原性Fig.2 Immunogenicity of Emodin of Emodin-BSA1 and E-modin-BSA2

图3 五种蒽醌类化合物结构图[1]Fig.3 Five anthraquinone compounds structures
2.3 不同偶联法制备大黄素-BSA的特异性 结果见表1。重氮化对氨基苯甲酸偶联法制备大黄素-BSA1的抗血清,与大黄素结合效价较高,与大黄素甲醚和大黄酚呈低度结合,统计学有极显著性差异(P=0.007)。琥珀酸酐偶联法制备大黄素-BSA2的抗血清,与大黄素甲醚结合效价较高,而与大黄素和大黄酚的结合效价较低,统计学有极显著性差异(P=0.009)。两种抗血清均不与大黄酸、芦荟大黄素结合,实验对照组均未见沉淀线形成。
大黄素-BSA1抗血清中以抗大黄素抗体为主,并对大黄素有较强的特异性;大黄素-BSA2抗血清则以抗大黄素甲醚抗体为主,对大黄素的特异性较差,二者有极显著性差异(P=0.006)。

表1 大黄素-BSA1和大黄素-BSA2抗血清与蒽醌类化合物反应的抗原结合效价Tab.1 Fiveanthraquinone compoundsantigens titer in anti-E-modin-BSA1 serum and anti-Emodin-BSA2 serum

图4 重氮化对氨基苯甲酸偶联法连接大黄素-BSA1的结构图Fig.4 The Emodin-BSA1 structures from p-am inobenzoic acid diazotizition coupling reaction
3 讨论
影响半抗原免疫原性的因素,除了结合比外,还与偶联方法密切相关。重氮化对氨基苯甲酸偶联法大黄素-BSA1与琥珀酸酐偶联法大黄素-BSA2的结合比分别为12和13。因为半抗原与BSA连接的结合比在5~20较为适宜,故二者无明显差异[6]。但实验结果显示这两种抗原对小鼠的免疫原性具有显著性差异,这可能与不同偶联法连接大黄素-BSA所形成的半抗原表位构型有关。
重氮化对氨基苯甲酸偶联法,是先将大黄素与重氮化对氨基苯甲酸反应,在大黄素酚羟基的邻位或对位引入羧基,再用碳二亚胺法与BSA偶联[3]。根据大黄素结构(见图3)及其与重氮盐偶合反应原理推测:在大黄素2、4、5、7号位均可发生反应,分别生成大黄素-BSA1-1、大黄素-BSA1-2、大黄素-BSA1-3、大黄素-BSA1-4(见图4)及其两个或两个以上部位同时发生反应的产物。这些产物均保留了大黄素6号位酚羟基的特征性结构。因此,用该法制备大黄素-BSA1的大黄素免疫原性较强,主要诱导产生抗大黄素特异性抗体。
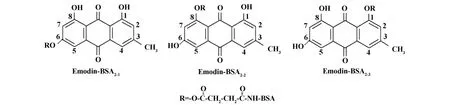
图5 琥珀酸酐偶联法连接大黄素-BSA2的结构图Fig.5 The Emodin-BSA2 structures from succinic anhyd ride coup ling reaction
大黄素-BSA1的抗血清中,尚存在少量能与大黄素、大黄素甲醚、大黄酚共同结合的抗体。可能是因大黄素-BSA1-1和大黄素-BSA1-3产物与BSA连接的部位距6号位酚羟基较近,掩盖了大黄素特征性结构,而表达了大黄素、大黄素甲醚、大黄酚的共同表位构型(见图3)所致。
琥珀酸酐偶联法,是先将大黄素的酚羟基与琥珀酸酐反应,生成带有羧基的大黄素琥珀酸单酯,再用碳二亚胺法与BSA偶联[2]。大黄素的1、6、8号位酚羟基均可与琥珀酸酐发生反应,分别生成大黄素-BSA2-1、大黄素-BSA2-2、大黄素-BSA2-3(见图5)及其两个或三个酚羟基共同发生反应的产物。因1号位和8号位的酚羟基可与羰基形成分子内氢键,加上空间位阻效应,使反应活性降低,所以6号位酚羟基最为活泼[1],故推测大黄素-BSA2-1的产量最大。而大黄素-BSA2-1正是利用大黄素6号位酚羟基与BSA连接,即破坏了大黄素6号位酚羟基的特征结构。其表位构型是大黄素、大黄素甲醚、大黄酚的共同结构(见图3)。因此,用大黄素-BSA2免疫小鼠产生的抗体,主要是能与大黄素、大黄素甲醚、大黄酚共同结合的抗体,对大黄素的特异性不强。
本实验提示:选择合适的偶联方法制备半抗原-载体复合物,是制备抗半抗原特异性抗体的关键所在。不同偶联方法因选择半抗原的连接基团或部位不同,决定了半抗原表位构型的表达,不仅影响半抗原的免疫原性,更决定其免疫抗体的特异性。在选择半抗原-载体偶联法时,首先应保留半抗原的特征性结构,其次还应注意选择在远离半抗原特征性结构的部位进行连接,防止半抗原的特征性结构被破坏或被屏蔽而失去特异性。
制备抗大黄素抗体,宜选用重氮化对氨基苯甲酸偶联法制备大黄素-BSA作免疫原,这样不仅能提高大黄素的免疫原性,而且还可制备出较高特异性的抗大黄素抗体。
1 匡海学.中药化学[M].北京:中国中医药出版社,2003:74-78.
2 刘文泰.医学免疫学[M].北京:中国中医药出版社,2009:219-226.
3 方 渡.有机化学[M].北京:学苑出版社,2002:384-385.
4 徐修远,滑 静,胡建民.氯霉素人工抗原的合成及其结合比的测定[J].中国畜牧兽医,2005;32(2):24-25.
5 胥传来,贺铁明,王武康.己烯雌酚免疫原的合成及其抗血清制备[J].细胞与分子免疫学杂志,2005;21(2):65-66.
6 Brian law.Immunoassay[M].A PracticalGuide.London/mew York:Taylor&Francis Ltd,1996:11-31.
[收稿2010-11-24 修回2011-01-26]
(编辑 张晓舟)
Study on the immunogenicity and specificity of different epitope configuration Emodin-BSA
LILi-Hua,LIUWen-Tai,DAIJun,DOUYu-Hong,WANGRu,LIUYan-Chen,PENGYang.HebeiMedicalUniversity,Shijiazhuang050091,China
Objective:To study the immunogenicity and specificity of differentepitope configuration Emodin-BSA preparedwith different coupledmethods.Methods:Emodin-BSA1 was synthesizedwith p-aminobenzoic acid diazotizition coupling reaction and Emodin-BSA2 was synthesized with succinic anhydride coupling reaction.Anti-Emodin-BSA sera wereobtained from immunizedm iceusing Emodin-BSA1 and E-modin-BSA2,respectively.The immunogenicity and antibody specificity of anti-Emodin were tested by doub le immunodiffusion on cellulose acetatemembrane.Results:The anti-Emodin antibody titers in anti-Emodin-BSA1 and anti-Emodin-BSA2 serum were 1∶144 0±357.771 and 1∶440±219.089 respectively(P=0.006).The former combinative titer with Emodin were 1∶184 3.2±457.947,the latter were 1∶8.8±4.382.Conclusion:The epitope configurations of two Emodin-BSA were strikingly different,immunogenicity and specificity existed significant difference.Emodin-BSA1 was ont on ly high immunogenicity but specificity for Emodin aswell.
Antigen-antibody reaction;Double immunodiffusion;Emodin;Hapten-carrier coupling;Epitope
R392.33
A
1000-484X(2011)05-0419-04
10.3969/j.issn.1000-484X.2011.05.008
李丽华(1960年-),女,学士,教授,主要从事中药成分分析研究;
及指导教师:刘文泰(1958年-),男,教授,硕士生导师,主要从事免疫学与中医药研究。

