2,4,6-三硝基苯酚降解菌的筛选和表征
孙秀云,沈锦优,王连军,李健生,韩卫清
(南京理工大学 环境与生物工程学院,江苏 南京210094)
0 引言
硝基芳香族化合物(Nitro-aromatic compounds,简称NAC)是重要的化工品,广泛应用于火炸药、农药、杀虫剂、除草剂、染料、医药等产品的生产[1-2],这些行业生产废水的排放对环境造成了严重污染。其中以火炸药行业的污染最为严重,问题最为突出。而NAC 难以生物降解,可在环境中持续存在并可能在食物链中积累,对人类的毒性大并可引发严重的环境污染问题。
NAC 所造成的严重污染问题和NAC 的生物降解性能密切相关。硝基芳香族化合物由于苯环上硝基的吸电子作用[3],苯环上形成了π 电子的缺电子特性,使好氧微生物加氧酶所催化的亲电子氧化攻击受阻,从而使硝基芳香族化合物难以实现好氧微生物降解。且该类物质的生物降解性能和取代基团的数量有关[4]。随着硝基数目的增加,苯环上π 电子的缺电子特性增强,显示出了高度的异型生物质特征,生物降解难度加大。单取代的硝基酚、硝基苯等芳香族硝基化合物是可实现生物氧化降解的,但是多硝基取代的芳香族硝基化合物,例如2,4,6-三硝基甲苯(TNT)、2,4,6-三硝基苯酚(TNP)等显示出了很大的降解难度。这些难降解物质的存在,不仅难以实现开环氧化降解,且对生物处理系统产生了很大的毒害作用,造成了处理效率的降低,甚至微生物的死亡。因此,对芳香族硝基化合物,尤其是多硝基取代芳香族化合物而言,具有良好的降解能力、并能适应该类废水复杂水质的高效降解微生物的筛选和驯化成为实现该类物质生物处理的关键。
2,4,6 -三硝基苯酚(TNP)是一种重要的硝基芳香族化合物,广泛应用于K·D 复盐、二硝基重氮酚(DDNP)等起爆药生产中。由于TNP 生物降解性能差,目前关于该物质生物转化的实例尚不多见[4-6]。此外,绝大部分TNP 降解菌株只能实现部分转化,形成死端产品,而不能实现TNP 的完全矿化。因此,能够实现TNP 矿化的降解菌株的筛选对TNP 污染的治理具有重要意义。
本研究从长期受到TNP 污染的工厂排污口土样中分离TNP 高效降解菌株,对其进行菌种鉴定和降解机理的考察,以期为TNP 的生物降解提供菌株资源和可行性依据。
1 材料与方法
1.1 培养基
筛选和富集培养液S1 组成如下[4]:3.06 g Na2HPO4·12H2O,0.76 g KH2PO4,0.2 g MgSO4·7H2O,0.05 g CaCl2,适量TNP(TNP 的量根据实验需要确定)和微量元素溶液,加入1 000 mL 蒸馏水中。上述S1 培养液加入15 g 琼脂即为相应的S1 固体培养基。
培养液和培养基在使用前均采用高压灭菌锅在121 ℃条件下灭菌20~30 min.
1.2 TNP 降解菌株的筛选
试验用土样取自南京陶吴化工厂排污口。将5 g 土样与含有50 mg/LTNP 的S1 培养液以1∶100 的质量比混合,放入三角瓶中,室温下以180 r/min 的摇床转速振荡3 h,得泥水混合物。将泥水混合物稍作沉淀,将上层液体分装入150 mL 的锥形瓶中(装液量为50 mL),摇床培养。约10 d 后,其中两个锥形瓶中苦味酸所呈现的黄色褪去。将这两个锥形瓶中的泥砂进一步沉淀,将该上清液转接到含100 mg/L 苦味酸的S1 培养液中,进行菌种的富集。培养48 h 后,培养液褪色,重新转接菌株,进一步提高培养液的浓度,重复该过程直至培养液中TNP 浓度达到500 mg/L.待TNP 浓度为500 mg/L 的培养液褪色后,将所得的菌悬浮液用无菌蒸馏水逐级稀释,涂布于以TNP 为唯一碳源、氮源和能源的筛选培养基S1 平板上,放入培养箱28 ℃倒置培养。观察菌体生长情况,并进行记录。两周后挑取单菌落,在LB 固体培养基上采用采用稀释涂布的方法进行分离纯化,进行斜面保存并编号。
1.2.4 TNP 降解菌株的复筛
挑取分离所得到的单菌落,分别接种于LB 培养液中,摇床培养至对数增长期。将所得菌体用无菌蒸馏水洗涤过程3 次。将菌体重新悬浮于无菌蒸馏水(调节加入的水量,控制菌悬浮液OD600约为2.0),得到种子液。
将各单菌落的种子液接种于含500 mg/L TNP的S1 培养液中,考察接种菌株的培养液有无颜色变化,如果培养液颜色发生变化,即可表明TNP 发生了降解。将TNP 降解菌转接于S1 固体培养基进行保存。分别制备各降解菌的种子液,接种于S1 培养液中,定时取样,测定OD600值,并测定过滤液COD浓度、TNP 浓度,以衡量降解效果,对筛选得到的TNP 降解菌降解性能进行进一步的比较。
1.3 TNP 降解菌株的鉴定
1.3.1 降解菌株16S rDNA 的提取
将菌体重新悬浮于150 μL 经过灭菌的纯净水中;向离心管中加入10 μL 浓度为5 mg/mL 的溶菌酶用以破碎细胞壁;向离心管中加入40 μL 浓度为10%的SDS(十二烷基硫酸钠),65 ℃下放置30 min;30 min 后,向离心管中加入20 μL 浓度为10 mg/mL 的蛋白酶K,37 ℃下放置4 h;将400 μL 的STE 缓冲溶液(组成为:NaCl,0.1 M;Tris-HCl,10 mM,pH 为8.0;EDTA,1 mM)加入离心管;加入等体积的的苯酚-氯仿,并于12 000 r/min 的转速下离心5 min,将上清液加入新离心管重复萃取过程,以消除杂质影响;萃取完成后,向上清液中加入50 μL醋酸钠溶液(3 M,pH 为5.2)和1 mL 95%的乙醇,沉淀10 min;将移液枪枪尖剪掉,在酒精灯火焰上烫去边角,用该枪头吸取含DNA 的悬液进行搅动;吸取含DNA 的悬液,转入70 μL 无菌纯净水中,备用于下一步的PCR 扩增。
1.3.2 降解菌株16S rRNA 基因的PCR 扩增及测序
以总DNA 为模板,用正向引物P1:5'-GAATTTGATCCTGGCTCAGAACGAACGCT-3'(对应于大肠杆菌的第11~37 碱基位置),反向引物P6:5'-TACGGCTACCTTGTTACGACTTCAC-3'(对应大肠杆菌的第1 451~1 503 位置)经PCR 反应扩增出16SrDNA.
PCR 反应体系(总体积为20 μL):10 ×buffer,2 μL;dNTPs,0.5 μL;正向引物,0.5 μL;反向引物,0.5 μL;MgCl2溶液,2 μL;Taq 聚合酶,0.5 μL;DNA模板,1 μL;ddH2O,13 μL.
PCR 反应条件:
1)94 ℃预变性2 min.
2)94 ℃,1 min;58 ℃,30 secs;72 ℃,2 min(35个循环).
3)72 ℃延伸8 min.
4)4 ℃保存.
将得到的目的DNA 进行16S rDNA 测序。测序仪器为Applied Biosystems 公司生产的3700 DNA Analyzer.
1.3.3 系统发育分析
将得到的1 339bp 序列与美国国家生物技术信息中心(National center for biotechnology information,简称NCBI)的GenBank 中核酸数据库(http:∥www.ncbi.nlm.nih.gov/BLAST/)进行同源性对比,并构建系统发育树。
1.4 TNP 降解中间产物分析
为确定TNP 的降解机理,本研究采用紫外可见光谱、红外谱图等分析手段,对代谢产物进行分析。
配制S1 培养液(含500 mg/L TNP),接种。摇床培养直至培养液变为无色。用0.22 μm 的滤膜过滤培养液并收集滤液200 mL.将200 mL 降解后的培养液滤液和200 mL 未经降解的S1 培养液利用旋转蒸发仪在60 ℃条件下分别进行浓缩,得到泥状固体物质。将泥状固体物质在烘箱中60 ℃烘干。将得到的干燥固体研磨,进行KBr 压片,测定得到红外谱图。
配制S1 培养液(含500 mg/L TNP),接种,摇床培养。每隔4 h 取样,用0.22 μm 的滤膜过滤培养液,将过滤清液稀释50 倍,进行紫外可见光谱扫描分析。
1.5 测定和分析方法
用紫外可见分光光度计测定在波长为600 nm处的光密度(optical density)OD600值。COD 采用重铬酸钾滴定法测定(GB11914—89)。TNP 浓度采用高效液相色谱法测定。具体操作如下:取一定量水样用0.22 μm 的滤膜过滤并适当稀释进入色谱柱(Waters RP18 column (5 μm,3.9 ×150 mm)),柱箱温度35 ℃.流动相A:乙腈;流动相B:超纯水与H3PO4体积比为0.26%;流动相A 与B 体积比为3/7.流速为1.00 mL/min.双极管紫外检测器设定波长为254 nm,积分出峰面积并由标准曲线确定TNP 浓度。亚硝酸根离子的测定采用N-(1-萘基)-乙二胺二盐酸盐分光光度法[4]。细菌的扫描电镜观察过程为:挑取单菌落,用无菌水稀释,涂片;用4%的戊二醛和1% 的锇酸固定;采用10%、30%、50%、70%、90%和100%的乙醇梯度洗涤;在临界点干燥仪内进行干燥;喷金,扫描电子显微镜观测并拍照。
2 结果与讨论
2.1 苦味酸降解菌的筛选
经过富集和分离,将经过纯化后所得到的菌株经过LB 培养液扩大培养,接种入以TNP 为唯一碳源、氮源的S1 培养液中。结果表明,所得的大部分菌株在以TNP 为唯一碳源和氮源的培养液中无TNP 降解能力(经过72 h 的培养,培养液仍然为黄色)。只有接种编号为NJUST6、NJUST9、NJUST16的菌株的培养液发生了颜色变化,培养液的颜色由最初的黄色变成橘红色。继续培养,培养液红色消退,培养液变为无色(略带浅黄)。NJUST6、NJUST9、NJUST16 均可在S1 固体培养基上生长,而S1 固体培养基则由初始的亮黄色变为橘红色,最后变为无色。NJUST6、NJUST9、NJUST16 在琼脂平板上的菌落形态相似,菌落光滑粘稠,色素为淡黄色;三种菌均呈革兰氏阳性,好氧;均为杆状菌,菌体不运动,不形成分生孢子或内孢子;其中NJUST16 菌曾观察到无色的变异菌株。图1为NJUST16 的扫描电镜图片。
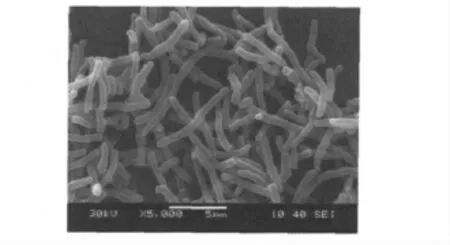
图1 NJUST16 菌的扫描电镜图Fig.1 The Scanning electron micrographs of NJUST16
为了进一步考察3 种菌对TNP 的降解能力,对3 种菌降解过程中S1 培养液的COD 和TNP 浓度变化情况进行了比较。由图2可见,NJUST6、NJUST9和NJUST16 3 种菌均具有TNP 降解能力。在相同的接种量、相同的起始TNP 浓度、相同的培养历史、相同的培养条件下,接种NJUST16 菌的体系在32 h内可实现2.18 mM(500 mg/L)TNP 的完全降解;而接种NJUST6、NJUST9 的体系分别需要44 h 左右才能实现完全降解。此外,3 种菌对COD 的降解能力也有差异。接种NJUST169 菌的培养液中的COD值经过32 h 的降解降到最低点,COD 去除率达到90%左右;接种NJUST6 和NJUST9 的培养液COD值分别经过44 h 达到最低点,COD 去除率分别为85%和67%.在降解终点,接种NJUST6 和NJUST9的培养液呈浅黄色,而接种NJUST16 的培养液基本呈无色。由此可见,NJUST16 菌相比NJUST6 和NJUST9,具有更强的TNP 降解能力。因此我们最终选取NJUST16 菌作为出发菌株,对其进行菌种鉴定,研究其降解TNP 的能力、降解机理,以期实现该菌的废水处理应用。
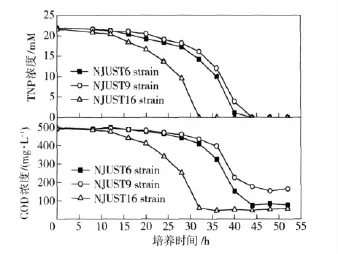
图2 接种NJUST6、NJUST9 和NJUST16 的培养液中COD 和TNP 浓度变化情况Fig.2 The COD and TNP concentration variation in the media inoculated by NJUST6、NJUST9 and NJUST16
2.2 TNP 降解菌的鉴定及降解能力
16S rRNA 在生物中高度保守,素有“生物化石”之称[7],已经成为一个分子指标,广泛引用于菌种的鉴定,因此NJUST16 的鉴定主要基于16S rRNA序列分析。将测序得到的1 339bp 序列输入到NCBI 的GenBank 数据库中,获得登陆号EF635425,用BLAST 工具将NJUST16 与已知的16S rRNA 基因序列进行同源性比较。在11 个与NJUST16 菌株最接近且同源性大于99%的菌株中,有10 株为红球菌属(Rhodococcus).一般认为序列相似性大于98%即可以认为是同种内的菌株。此外,结合NJUST16 菌形态特征、生理生化反应结果,可以判断NJUST16菌为红球菌属(Rhodococcus),命名为Rhodococcus sp.NJUST16.
由于TNP 的难生物降解性,目前已见报道的TNP 降解菌极其有限,主要集中在放线菌类的诺卡氏菌属(Nocardioides)和红球菌属(Rhodococcus)[4-6].这些降解菌株普遍具有降解速率低、可降解浓度低、降解条件苛刻的缺点。例如,针对750 mg/L 左右的TNP 的降解,接种Rhodococcus opacus HL PM-1 的体系,需要长达8.5 d 的时间才能实现TNP 的完全降解[5];此外这些菌株可处理的TNP 最高浓度在较低,在Weidhaas 等[6]所报道的接种Rhodococcus opacus strain JW01 的SBR 反应体系中,TNP 处理浓度在200 mg/L 以下,且降解过程易受温度影响。本研究所述的NJUST16 菌,可在32 h 内实现500 mg/LTNP 的完全降解(如图2所示)。与文献相比,NJUST16 菌具有较高的降解速率和耐受浓度,具有应用潜力。
2.3 NJUST16 对TNP 的降解中间产物分析
由图2可知,在NJUST16 的作用下,S1 培养液中TNP 可发生降解和转化,COD 也有了明显降低。但是仅凭TNP 浓度和COD 浓度的变化,不能说明在NJUST16 作用下TNP 发生了矿化。本论文采用紫外可见光谱图、红外谱图等分析手段,确定TNP在NJUST16 作用下的降解机理,为TNP 实现矿化提供直接的证据。
2.3.1 S1 培养液中NJUST16 的生长、TNP 的降解和亚硝酸根的释放
如图3所示,在NJUST16 的作用下,32 h 后S1培养液中TNP 浓度降到检测限以下,细菌浓度达到最大(最大OD600增量约为0.38).此外,在TNP 降解过程中,可观察到亚硝酸根离子的释放。理论上每降解1 mol TNP 可释放出3 mol 的亚硝酸根离子,而本研究表明每降解1 molTNP 约释放出2.62 mol的亚硝酸根离子。亚硝酸根离子和降解TNP 摩尔比大于2,表明TNP 分子苯环上的3 个硝基均发生了脱落。
2.3.2 紫外可见光谱图分析降解中间产物
图4为含TNP 的S1 培养液在降解过程中的紫外可见光谱图变化情况。TNP 在354 nm 处和250 nm 处有两个特征吸收峰。随着TNP 的降解,TNP的特征吸收在降低,至40 h TNP 的特征吸收已完全消失,同时在210 nm 处的吸收峰增强(图4)。在210 nm 处的吸收峰推测为亚硝酸根离子及小分子有机物的特征吸收。可见TNP 在NJUST16 的作用下发生了降解和转化,生成了一些小分子物质。
2.3.3 红外谱图分析降解中间产物
图5为含TNP 的S1 培养液在经NJUST16 降解前后的红外谱图。在降解前,波数为3 070 cm-1处出现TNP 苯环的C—H 伸缩振动;波数为1 480 cm-1处出现TNP 苯环的 C==C 伸缩振动;波数为1 550 cm-1处出现TNP 苯环上硝基的反对称伸缩振动;波数为1 340 cm-1处出现TNP 苯环上硝基的对称伸缩振动;波数范围为675~910 cm-1处出现TNP苯环的C—H 面外变形振动。经过NJUST16 的降解,以上吸收峰均得到了显著的减弱或消失,表明经过NJUST16 的降解,TNP 的苯环发生了开环反应,同时发生了苯环上硝基脱除的反应。
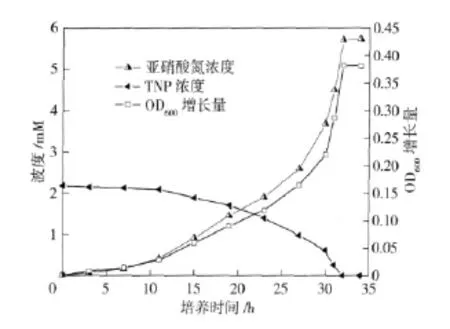
图3 S1 培养液中NJUST16 的生长、TNP 的降解和亚硝酸根离子的释放Fig.3 Growth of NJUST16,degradation of TNP and the release of the nitrite in the S1 media
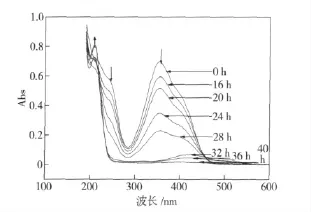
图4 NJUST16 降解过程中S1 培养液的紫外光谱图变化Fig.4 UV spectrum variation of S1 media during the degradation by NJUST16
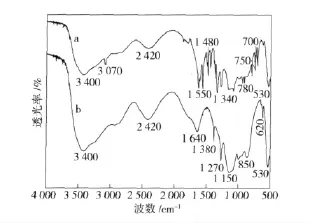
图5 TNP 经NJUST16 降解前(a)和降解后(b)的傅里叶变换红外光谱(FTIR)Fig.5 FTIR spectra of TNP before (a)and after (b)degradation by NJUST16
3 结论
1)利用以TNP 为唯一碳源、氮源的S1 培养基,从长期受到TNP 污染的工厂排污口土样中,筛选得到三株可以TNP 为唯一碳源、氮源生长的菌株,其中NJUST16 菌降解TNP 的能力最为优异;
2)NJUST16 菌经16S rRNA 鉴定,确定为Rhodococcus,命名为Rhodococcus sp.NJUST16,Gen-Bank 登陆号为EF635425;
3)对Rhodococcus sp.NJUST16 降解TNP 的降解产物分析表明,TNP 在Rhodococcus sp.NJUST16的作用下,苯环上3 个硝基均发生了脱落,苯环发生了开环反应,并且无明显的中间产物积累,最终TNP发生完全矿化。
References)
[1] Spain J C.Biodegradation of nitroaromatic compounds[J].Annual Review of Microbiology,1995,49:523-555.
[2] Qiu X H,Zhong Q Z,Li M,et al.Biodegradation of p-nitrophenol by methyl parathion-degrading Ochrobactrum sp.B2[J].International Biodeterioration & Biodegradation,2007,59:297-301.
[3] Melgoza R M,Buitron G.Degradation of p-nitrophenol in a batch biofilter under sequential anaerobic/aerobic environments[J].Water Science and Technology,2001,44(4):151-157.
[4] Behrend C,Heesche-Wanger K.Formation of hydride-meisenheimer complexes of picric acid(2,4,6-trinitrophenol)and 2,4-dinitrophenol during mineralization of picric acid by Nocardioides sp.strain CB 22-2[J].Applied and Environmental Microbiology,1999,65(4):1372-1377.
[5] Rieger P G,Sinnwell V,Preuβ A,et al.Hydride-meisenheimer complex formation and protonation as key reactions of 2,4,6-trinitrophenol biodegradation by Rhodococcus erythropolis[J].Journal of Bacteriology,1999,181(4):1189-1195.
[6] Weidhaas J L,Schroeder E D,Chang D P.An aerobic sequencing batch reactor for 2,4,6-trinitrophenol (picric acid)biodegradation[J].Biotechnology and Bioengineering,2007,97(6):1408-1414.
[7] Delong E F.Phylogenetic strains:ribosomal RNA-base for the identification single cells[J].Science,1982,243(4896):1360-1363.

