糖尿病患者眼表及泪液蛋白改变的临床分析
高 妍 刘新玲 李筱荣
糖尿病(diabetes mellitus,DM)是一种常见的代谢异常疾病,可引起视网膜病变、白内障、眼肌麻痹、角膜病变等多种眼部并发症。随着对DM认识的深入,以及人们医疗保健水平的提高,DM患者眼表的异常逐渐得到关注。DM对角膜的形态、代谢、生理及泪膜都起着重要影响,而泪液功能异常是导致干眼症、角膜并发症等多种眼表疾病的重要原因[1],因此,了解DM患者眼表、泪液成分及分泌量的改变情况,以分析其改变的影响因素,对指导临床诊断治疗DM眼表疾病有重要意义。
1 资料与方法
1.1 一般资料 选取2009年1月至12月就诊于我院眼科中心并经专科医师确诊的2型DM患者65例(72眼)作为DM组,其中男35例(39眼),女30例(33眼);年龄49~68岁,平均(58.48±6.28)岁; DM病程5~20 a,平均(10.93±4.23)a。依据双目间接眼底镜和荧光素眼底血管造影检查的结果,按照1987年中华医学会的糖尿病视网膜病变的分期标准[2],将患者分为:糖尿病无眼底改变 (non-diabetic retinopathy,NDR)组、非增生性糖尿病视网膜病变(nonproliferative diabetic retinopathy,NPDR)组和增生性糖尿病视网膜病变(proliferative diabetic retinopathy,PDR)组。
无全身系统性疾病,拟在本中心行白内障手术的患者40例(40眼)作为对照组。其中,男23例(23眼),女17例(17眼);年龄52~65岁,平均(59.42±4.01)岁。所有研究对象均无眼部外伤、手术及眼部激光史,未曾配戴角膜接触镜,无眼部急、慢性感染、眼睑及眼球位置异常及其他眼部疾病史;裂隙灯显微镜检查显示角膜透明,上皮完整;无眼部用药史。检查前取得所有受试对象或其亲属的知情同意。
1.2 检查方法
1.2.1 一般项目检查 询问病史,行空腹血糖及糖化血红蛋白检测。空腹血糖低于7.8 mmol·L-1、糖化血红蛋白低于7.8%认为是血糖控制良好。
非侵入性泪膜破裂时间(break-up time,BUT)采用英国Keeler公司生产的Tearscope Plus泪膜镜,手动计时自动记录。重复测量3次,取其平均值。
泪液分泌试验(Schirmer I):采用5 mm×35 mm滤纸,测量时患者不滴表面麻醉剂,将滤纸一端反折,置下睑中外1/3结膜囊内,嘱患者轻轻闭眼,5 min后取出滤纸条,从折叠处计算并记录滤纸的湿润长度。
采用Cochet.Bonnet角膜知觉仪(法国 Luneau SA公司)进行角膜知觉检测,纤维直径0.12 mm,最长长度60 mm,用纤维末梢垂直接触角膜中央,检查者肉眼看到纤维弯曲,阳性反馈为:感觉到角膜有异物感。从最长长度开始,每次递减5 mm,直到患者有阳性应答为止,重复3次取平均值。所有检查均由同一医师完成,并与另一医师进行了重复性检验,取平均值。
角膜荧光素染色:将荧光染色条置于下睑结膜囊内,嘱患者闭眼5 s后眨眼数次,在裂隙灯钴蓝光下观察。采用12分制记录染色结果:将角膜划分为4个象限,根据染色程度和染色面积分0~3分(0分:无染色;1分:散在点状染色;2分:中等密集点状染色;3分:高密度点染或片状染色)。
1.2.2 角膜HRT-Ⅱ检查 所采用的激光由HRT-Ⅱ和Rostock角膜模块组件组成。于中央角膜约70 μm深度处的神经纤维层的进行扫描检查,结束后,选择有价值的图像与录像存盘。神经纤维的密度以每视野中神经纤维总长度(μm/视野)表示。
1.2.3 泪液蛋白测定 采用毛细吸管法在DM患者及对照组患者下泪河采集约20 μL非刺激性泪液,采集的泪液立即置于-80℃冰箱中保存备用。采用Brandford法测定泪液总蛋白含量,以小牛血清白蛋白作为标准(Brandford蛋白浓度测定试剂盒购于上海拜力生物科技有限公司)。
放射免疫分析法测定乳铁蛋白,取泪液样品10 μL,生理盐水1∶100稀释,用同一批号放射免疫药盒测定,制作标准曲线,由曲线上查出样品中乳铁蛋白含量。
试管比浊法测定溶菌酶的含量,溶菌酶测试盒(北京尚柏生物医学技术有限公司)、染色菌液的制备、溶菌酶标准液配制及标准曲线的绘制均按说明书进行;将泪液及染色菌液混匀,离心后取上清液,根据测定管与样品对照管光密度差值,查标准曲线,即可求得样品中溶菌酶的含量。
1.2.4 干眼问卷调查 干眼症状的判定采用美国干眼流行病学调查的干眼症状判断标准。眼干涩、烧灼感、磨砂感、眼红、睫毛结痂分泌物堆积、黏涩睁眼费力。1项或多项每周出现1次或持续存在均为干眼症状阳性。
1.3 统计学方法 采用SPSS 17.0统计学软件对数据进行单因素方差分析和χ2检验,以P<0.05为差异有统计学意义。
2 结果
2.1 一般情况 DM组与对照组在年龄(t= -0.746,P=0.447)、性别比例(χ2=0.34,P=0.56)的差异均无统计学意义。DM组中37例(56.9%)血糖控制良好,24眼(36.9%)为 NDR,21眼(32.3%)为NPDR,20眼(30.8%)为PDR。
2.2 眼部状况 DM组干眼症状阳性的患者为46例(70.77%),明显高于对照组11例(27.50%),差异有统计学意义(χ2=18.68,P<0.01)。与对照组相比,NDR组与NPDR组泪液分泌、BUT、角膜染色差异均无统计学意义,而对于角膜敏感度及神经纤维密度,除NDR组外,DM各组与对照组比较差异均有统计学意义(均为P<0.05),PDR组差别更显著(均为P<0.001),见表1。DM各组患者泪液中总蛋白量与对照组比较差别无显著性,但乳铁蛋白和溶菌酶含量在NPDR及PDR组均较对照组下降,PDR组下降的更明显,见表2。
2.3 DM组一般情况与眼表改变的关系 DM患者的年龄与眼表的改变没有明显的对应关系,但是病程长短、血糖控制状况与眼表改变存在统计学的相关性,病程长、血糖控制差的患者眼表改变更明显,见表3。
表1 DM组和对照组泪液分泌、BUT、角膜染色、角膜敏感度及神经纤维密度的比较Table 1 Comparison of Schirmer test,BUT,corneal staining,corneal sensitivity and corneal nerve fibre density in diabetic patients and control group (s)
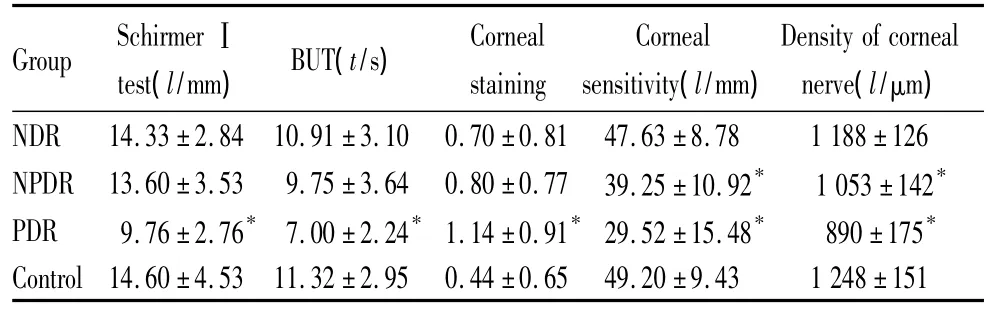
表1 DM组和对照组泪液分泌、BUT、角膜染色、角膜敏感度及神经纤维密度的比较Table 1 Comparison of Schirmer test,BUT,corneal staining,corneal sensitivity and corneal nerve fibre density in diabetic patients and control group (s)
Note:Compared with control group,*P<0.05
Group SchirmerⅠtest(l/mm) BUT(t/s) Corneal staining Corneal sensitivity(l/mm) Density of corneal nerve(l/μm) NDR 14.33±2.84 10.91±3.10 0.70±0.81 47.63±8.78 1 188±126 NPDR 13.60±3.53 9.75±3.64 0.80±0.77 39.25±10.92* 1 053±142* PDR 9.76±2.76* 7.00±2.24*1.14±0.91*29.52±15.48* 890±175* Control14.60±4.53 11.32±2.95 0.44±0.65 49.20±9.43 1 248±151
表2 DM组和对照组泪液总蛋白、溶菌酶及乳铁蛋白表达Table 2 Comparison of total proteins,lysozyme and lactoferrin in tear film in diabetic patients and control group (s,ρ/g·L-1)

表2 DM组和对照组泪液总蛋白、溶菌酶及乳铁蛋白表达Table 2 Comparison of total proteins,lysozyme and lactoferrin in tear film in diabetic patients and control group (s,ρ/g·L-1)
Note:*Compared with control group,P<0.05;Compared with NDR group,△P<0.05
Group NDR NPDR PDR Control Total protein 10.79±2.36 11.60±2.28 11.09±2 1.67±0.34 .91 11.72±2.91 Lysozyme 1.26±0.22 1.13±0.23* 0.92±0.19*△ 1.30±0.22 Lactoferrin 1.63±0.31 1.43±0.33*△ 1.15±0.31*△
表3 泪液及眼表改变与全身状况的关系Table 3 Relation of tear film and ocular surface parameters changes with systemic factors (s)
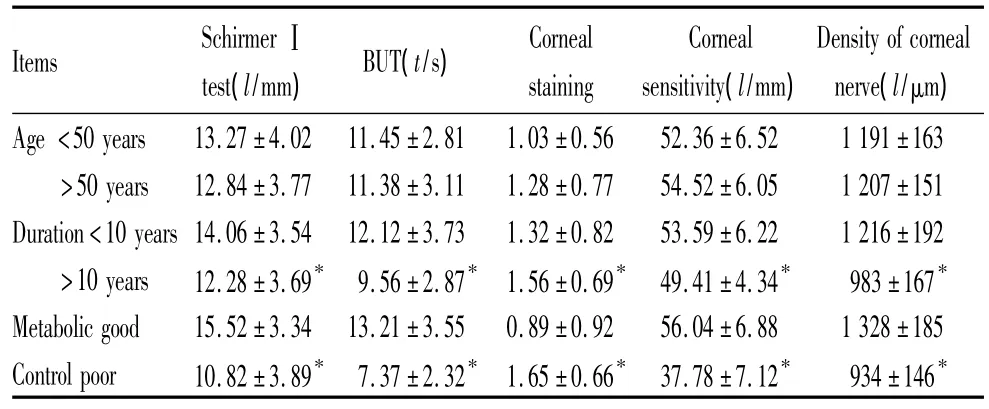
表3 泪液及眼表改变与全身状况的关系Table 3 Relation of tear film and ocular surface parameters changes with systemic factors (s)
Note:Compared with duration<10 years or metabolic good,*P<0.05
Items SchirmerⅠtest(l/mm) BUT(t/s) Corneal staining Corneal sensitivity(l/mm) Density of corneal nerve(l/μm) Age<50 years 13.27±4.02 11.45±2.81 1.03±0.56 52.36±6.52 1 191±163>50 years 12.84±3.77 11.38±3.11 1.28±0.77 54.52±6.05 1 207±151 Duration<10 years 14.06±3.54 12.12±3.73 1.32±0.82 53.59±6.22 1 216±192>10 years 12.28±3.69* 9.56±2.87* 1.56±0.69* 49.41±4.34* 983±167* Metabolic good 15.52±3.34 13.21±3.55 0.89±0.92 56.04±6.88 1 328±185 Control poor 10.82±3.89* 7.37±2.32* 1.65±0.66* 37.78±7.12* 934±146*
3 讨论
有调查显示,65~84岁的美国人群中,干眼症患病率为14.6%,而在2型DM患者中为70%[3]。BUT可以反映泪膜的成分和稳定性,Schirmer试验评价泪膜中水样层的分泌量。众多研究表明,DM患者BUT时间缩短、泪液分泌量降低[4-5],我们的研究还发现这些变化与DM病程及血糖控制的优劣相关,而且在PDR组下降的更为明显。角膜上皮层内穿插的顶端细胞可表达膜相关的黏蛋白,对维持泪膜的稳定性起重要的作用;角膜上皮损害影响黏蛋白的表达,降低眼表面亲水性,导致泪膜的稳定性下降[6]。DM患者的泪液功能和眼表变化与高血糖密切相关,氧化损伤机制在病理过程中发挥重要作用。Inoue等[7]的研究显示,DM患者糖代谢异常,周围神经病变累及泪腺及角膜,使泪液分泌减少导致干眼。
糖尿病性角膜病变包括临床及亚临床的角膜上皮异常,例如:上皮再生迟缓、浅层点状角膜炎、微囊性水肿、持续性上皮损失、浅层角膜溃疡及大泡形成等[8]。角膜荧光染色可以较敏感地反映上皮缺失的程度。在我们的研究中,裂隙灯检查角膜均为透明,染色后可发现部分患者角膜上皮的缺失;血糖控制差的患者、伴有PDR的患者角膜上皮的病变较重。Yoon等[9]的研究也表明,DM患者角膜上皮病变的发生率及严重程度与糖尿病性视网膜病变相关。在DM机体的三叉神经节中,P物质、降钙素基因相关肽等神经递质的减少导致角膜上皮细胞有丝分裂和新陈代谢降低,从而影响了上皮的功能和活力[10-11];周围神经病变还可以使角膜知觉减退,角膜上皮和基底膜异常,再生的上皮细胞黏附功能下降,导致角膜上皮缺损和脱落[12]。
角膜神经主要是由来自三叉神经眼支的感觉神经纤维组成,同时也存在少量肾上腺素能和乙酰胆碱能植物神经纤维,在维持角膜组织,特别是角膜上皮功能和解剖完整性等方面起重要作用。DM患者角膜的神经病变使其感觉、营养、代谢功能障碍,是引起角膜病反复发作,难治疗的根本原因[13]。我们的研究发现,在DM早期,仅有神经纤维密度的减少,角膜知觉尚未发生明显降低,说明共焦激光显微镜可以更敏感地发现早期角膜改变。Rosenberg等[14]在对1型DM患者角膜结构及敏感度研究中发现,在糖尿病性周围神经病变的早期即发现有角膜神经纤维的改变,因此我们可以通过角膜神经纤维检查来发现并检测糖尿病性周围神经病变的进展,比较方便且经济,并能及早发现病变。
另有研究表明,异常的糖代谢可能通过激活的多元醇途径导致角膜神经纤维功能异常[7];其他的机制还包括局部组织微血管病变使神经营养障碍,并阻断了泪液分泌的反馈途径[15]。因此,有学者探索使用抑制多元醇通路的药物,如醛糖还原酶抑制剂来改善角膜知觉、稳定基底膜正常成分,减少溃疡。Fujishima等[16]给予白内障术后的DM患者口服ARI(ONO-2235)每天150 mg,12周后与对照组比较,发现角膜敏感度及角膜染色明显改善。
泪膜中的溶菌酶、分泌型IgA及其他抗菌成分共同组成眼表的第一道防御屏障。其中乳铁蛋白具有抗菌、抗感染、免疫调节等作用;还可促进溶菌酶的抗菌作用,与SIgA有协同作用,其缺失可引起各种眼表疾病[17]。DM患者易发生浅层点状角膜炎、浅层角膜溃疡与泪膜中防御性蛋白减少有关。随后的研究表明,DM患者泪液中蛋白质的总量和种类都与正常人不同,其泪液蛋白变化与糖尿病视网膜病变相关[18-19]。在我们的研究中,DM患者泪膜中蛋白质总量随病程的延长而减少,乳铁蛋白、溶菌酶在PDR患者的泪膜中下降的较为明显。其原因可能为糖尿病性周围神经病变累及泪腺,导致其分泌蛋白的功能下降。同时有研究显示:在DM患者泪膜中出现正常人没有的“新”的蛋白[20],考虑与糖尿病性角膜病变的发病机理有关,是一种非特异的针对组织损伤而产生的蛋白[15]。
随着DM患者日益增多,其眼表的病变应得到眼科医师的重视;DM患者泪液功能较差,是眼表疾病的易患人群。我们的研究显示,在DM及其视网膜病变早期,角膜的变化与对照组无明显区别,早期预防可避免这些患者出现糖尿病性角膜病变。而对于病程长,伴有糖尿病性眼底病变、周围神经病变者,常规行BUT、SchirmerⅠ试验及角膜荧光染色,有助于早期发现并治疗眼表疾病。虽然糖尿病性眼表疾病发生机理尚未完全清楚,根据其临床特点治疗主要针对:补充人工泪液、保护角膜上皮,同时应注意控制血糖、抗氧化、抗炎及神经营养等全身治疗。
1 Mathers WD,Lane JA,Zimmerman MB.Tear film changes associated with normal aging[J].Cornea,1996,15(3):229-234.
2 张承芬.眼部病学[M].北京:人民卫生出版社,1998:243.
3 李凤鸣.中华眼科学[M].北京:人民卫生出版社,2005:1153-1160.
4 Ozdemir M,Buyukbese MA,Cetinkaya A,Ozdemir G.Risk factors for ocular surface disorders in patients with diabetes mellitus[J].Diabetes Res Clin Pract,2003,59(3):195-199.
5 陈连萍,张关玲.2型糖尿病患者泪液及眼表改变的临床观察[J].眼科新进展,2007,27(9):687-688.
6 Gipson IK,Argüeso P.Role of mucins in the function of the corneal and conjunctival epithelial[J].Int Rev Cytol,2003,231(1): 1-49.
7 Inoue K,Kato S,Ohara C,Numaga J,Amano S,Oshika T.Ocular and systemic factors relevant to diabetic keratoepitheliopathy[J].Cornea,2001,20(8):798-801.
8 王 伟,李筱荣,袁佳琴.2型糖尿病患者角膜基质细胞形态学特征的共焦显微镜观察[J].眼科研究,2007,25(1):64-67.
9 Yoon KC,Im SK,Seo MS.Changes of tear film and ocular surface in diabetes mellitus[J].Korean J Ophthalmol,2004,18 (2):168-174.
10 Troger J,Humpel C,Kremser B,Kralinger M,Teuchner B,Kunze C,et al.The effect of streptozotocin-induced diabetes mellitus on substance P and calcitonin gene-related peptide expression in the rat trigeminal ganglion[J].Brain Res,1999,842(1):84-91.
11 Watanabe M,Nakayasu K,Iwatsu M,Kanai A.Endogenous substance P in corneal epithelial cells and keratocytes[J].Jpn J Ophthalmol,2002,46(6):616-620.
12 Cousen P,Cackett P,Bennett H,Swa K,Dhillon B.Tear production and corneal sensitivity in diabetes[J].J Diabetes Complicat,2007,21(6):371-373.
13刘晓燕,朱学军.糖尿病性角膜神经病变的研究进展[J].国际眼科杂志,2008,8(7):1438-1440.
14 Rosenberg ME,Tervo TM,Immonen IJ,Müller LJ,Grönhagen-Riska C,Vesaluoma MH.Corneal structure and sensitivity in type 1 diabetes mellitus[J].Invest Ophthalmol Vis Sci,2000,41 (10):2915-2921.
15 Alves Mde C,Carvalheira JB,Módulo CM,Rocha EM.Tear film and ocular surface changes in diabetes mellitus[J].Arq Bras Ophthalmol,2008,71(S6):96-103.
16 Fujishima H,Tsubota K.Improvement of corneal fluorescein staining in post cataract surgery of diabetic patients by an oral aldose reductase inhibitor[J].Br J Ophthalmol,2002,86(8): 860-863.
17安 娜,朱秀萍.泪液乳铁蛋白的研究进展[J].国际眼科杂志,2008,8(5):1012-1014.
18 Grus FH,Sabuncuo P,Dick HB,Augustin AJ,Pfeiffer N.Changes in the tear proteins of diabetic patients[J].BMC Ophthalmol,2002,2(1):1-6.
19 Yu L,Chen X,Qin G,Xie H,Lv P.Tear film function in type 2 diabetic patients with retinopathy[J].Ophthalmologica,2008,222 (4):284-291.

