乙草胺对昆明小鼠肝脏病理性变化的研究
王志勇,许晓曦,李 莹,卓志国,滕国新
(1.东北农业大学食品学院,哈尔滨 150030;2.黑龙江农业工程职业学院动物科技学院,哈尔滨 150088;3.哈尔滨市质量技术监督局,哈尔滨 150001;4.黑龙江中医药大学成人教育学院,哈尔滨 150040;5.北京三元食品有限责任公司,北京 100085)
乙草胺(Acetochlor),分子式C14H20ClNO2,分子质量为269.8。乙草胺原药的危险等级是9类,属于持久性有机污染物(POP)。大鼠急性口服LD50为 2 593 mg·kg-1。
乙草胺为内吸性酰胺类除草剂,是选择性芽前除草剂。它具有较长的降解周期,对人、动植物有一定的毒害作用[1]。乙草胺已经被美国环境保护局定为B-2类致癌物,并规定地下水中的乙草胺残留量不得超过0.10 μg·L-1[2-3]。日本肯定列表名录中严格限制乙草胺的残留量,最低限量为0.020 mg·kg-1[4]。随着我国20世纪90年代初乙草胺生产的产业化,它的使用日益广泛,2003年我国乙草胺的消耗量已经达到了l.0×104t[5]。同时,资料显示地表水、地下水,甚至饮用水中也被检测出含有不同含量的乙草胺[6-9]。因此,乙草胺的安全性也越来越受到人们的关注,但目前关于乙草胺对动物体及人体的损伤研究尚未见报道:根据本研究结果,后续研究可以对奶牛食料中的乙草胺残留量进行检测分析,同时对原料奶进行检测,确立奶牛食用含有乙草胺的食物,通过消化吸收转移到原料乳中的剂量-反应关系。最终根据风险评估的方法,对原料乳中乙草胺的残留进行风险评估,为今后的预防工作指引方向,为政府部门采取适当的管理措施提供依据,降低食源性疾病的发生。
1 材料与方法
1.1 仪器与试剂
受试物为乙草胺农药标准品,购自Sigma公司(纯品,分子质量为269.77 g·mol-1);超纯水,由娃哈哈纯净水制得;昆明小鼠,哈尔滨市汉方试验鼠类养殖所提供,许可证scxk(京)(2007-0001);带盖塑料鼠笼;灌胃器;电子天平,Acculab ALC-1100.2与ALC-310.3型;组织切片机,莱卡2135型;显微镜,莱卡Leica DM IRB等。
1.2 方法
1.2.1 昆明小鼠饲养
1.2.1.1 试验动物分组
选用同一天出生的,2月大的健康昆明系小鼠120只,购自哈尔滨市汉方试验鼠类养殖所。将体重平均为(25±2)g雄性和雌性的健康小鼠,按体重随机分成5组,组间平均体重相差小于0.5 g,每组雌雄各12只,共120只,每组12只再分成3只鼠笼饲养,驯化饲养1周后开始灌胃。设计浓度参考小鼠急性口服LD50、日本进口食品对其限量实行“一律标准”及90 d喂养试验标准。灌胃剂量和分组如表1所示。
1.2.1.2 动物饲养和管理
昆明小鼠饲养在专用饲养动物舍中,室内平均温度 (22±4)℃,湿度55%±10%,自然光光照,空气经过滤,换气4次·d-1,噪音60 dB以下,采用自动饮水装置供动物饮用,动物在悬挂式塑料笼内饲养,饲料为无菌粉料。试验期间动物自由摄食饮水。
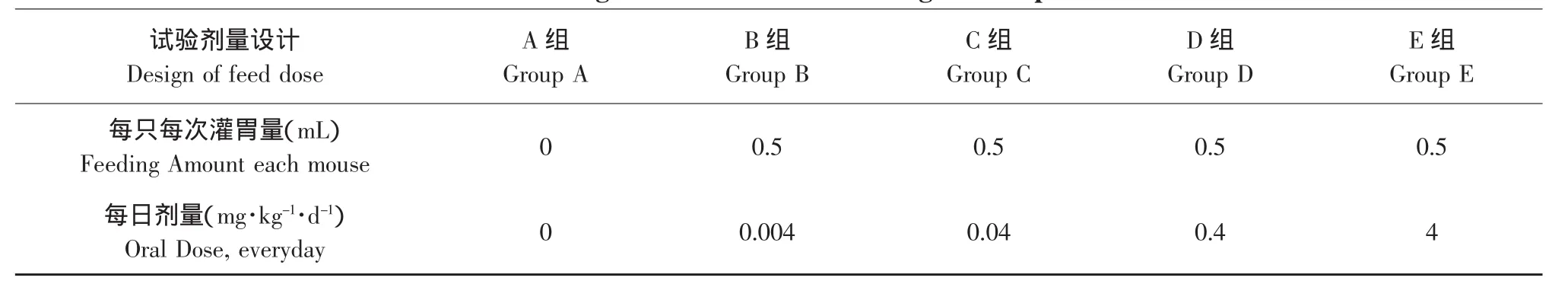
表1 昆明小鼠灌胃试验剂量设计Table 1 Design of feed dose in Kunming mice experimen
1.2.2 临床观察
体重称量10 d 1次,每天观察2次昆明小鼠,濒临死亡的昆明小鼠每天观察4次。
1.2.3 病理检查
试验期间濒临死亡或者自然死亡的昆明小鼠,随时解剖,活体在试验终期全部解剖。取肝脏,称肝脏重与体重。标本经体积分数为10%的中性福尔马林缓冲液固定5~7 d,取材之后再次固定12 h。组织以乙醇脱水,二甲苯透明,石蜡包埋,切片,HE染色,树胶封固,光镜检查。记录病变的种类及程度。
1.3 数据处理
应用Statistix 8.1软件、LSD方法对比试验数据分析小鼠试验期间的体重变化差异是否显著,数据采用平均值±标准差(X±S)表示。
2 结果与分析
2.1 昆明小喂养期间临床表现
试验前期,各组昆明小鼠均有死亡现象,经病理检查为非中毒原因死亡,肝脏无明显病变,个别死亡原因不明。随着试验的进行,试验后期死亡的昆明小鼠,都出现少动、被毛蓬松、并出现轻微震颤等中毒症状。经解剖观察发现,有3只昆明小鼠肝脏明显出现肿大现象,HE染色镜检发现,这3只昆明小鼠肝脏脂肪粒增多,肝细胞出现了纤维化的现象。其余动物在整个试验期间外貌、活动及一般状况均正常,未明显中毒表现。昆明小鼠喂养期间死亡情况如表2所示。
2.2 喂养期间体重和进食变化
试验开始后各组动物摄食量基本稳定。E组雄性小鼠第5周摄食量略有减少,但与对照组相比差异无统计学意义。试验期间每十天测量一次每组小鼠平均体重,雌性、雄性小鼠各剂量组体重变化量见表3、4。

表2 昆明小鼠90 d喂养期间死亡情况Table 2 Death Status of Kunming mice during feeding period
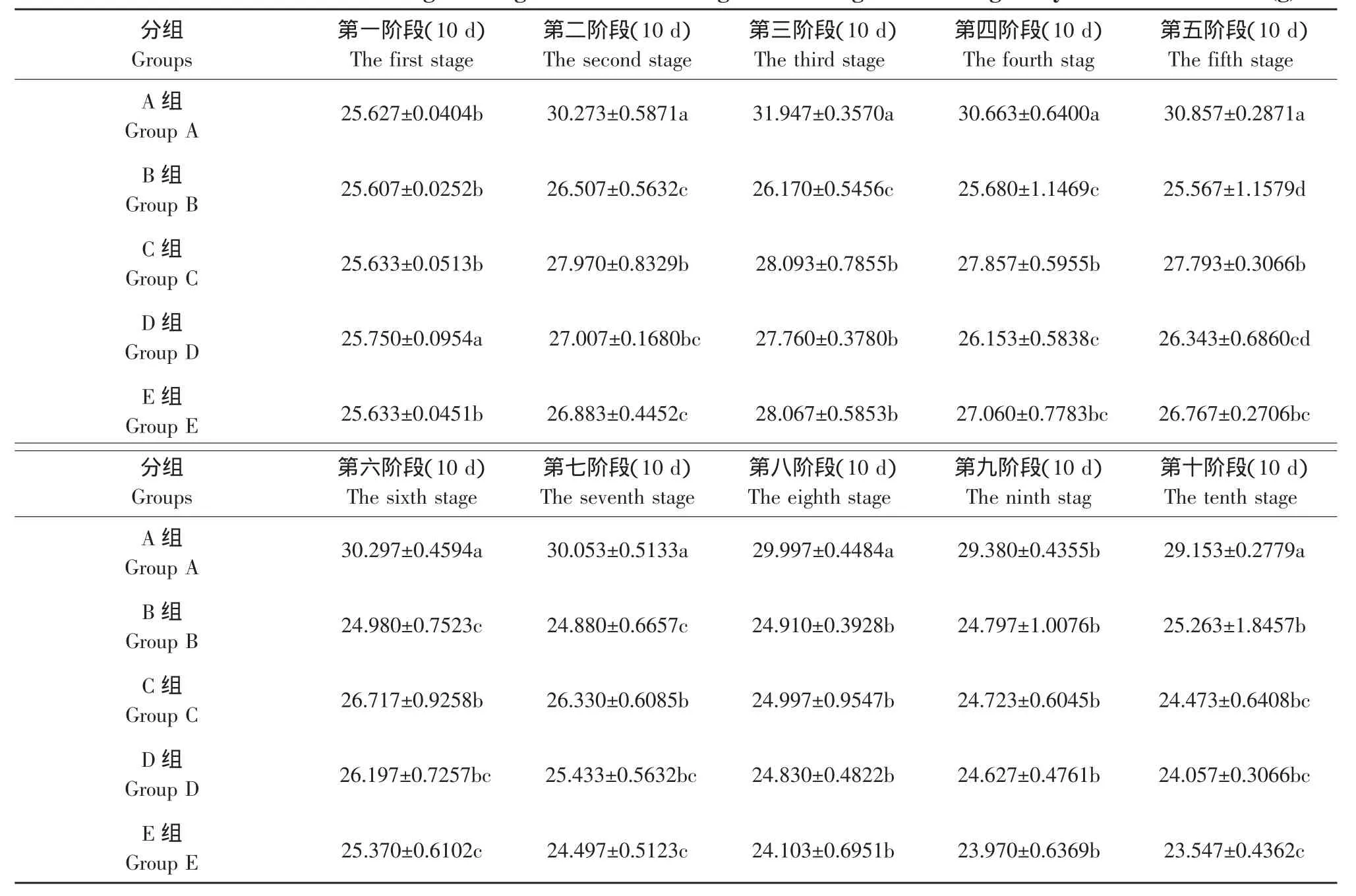
表3 雄性昆明小鼠90 d喂养试验体重变化Table 3 Weight change of male Kunming mice during 90 d feeding study (g)
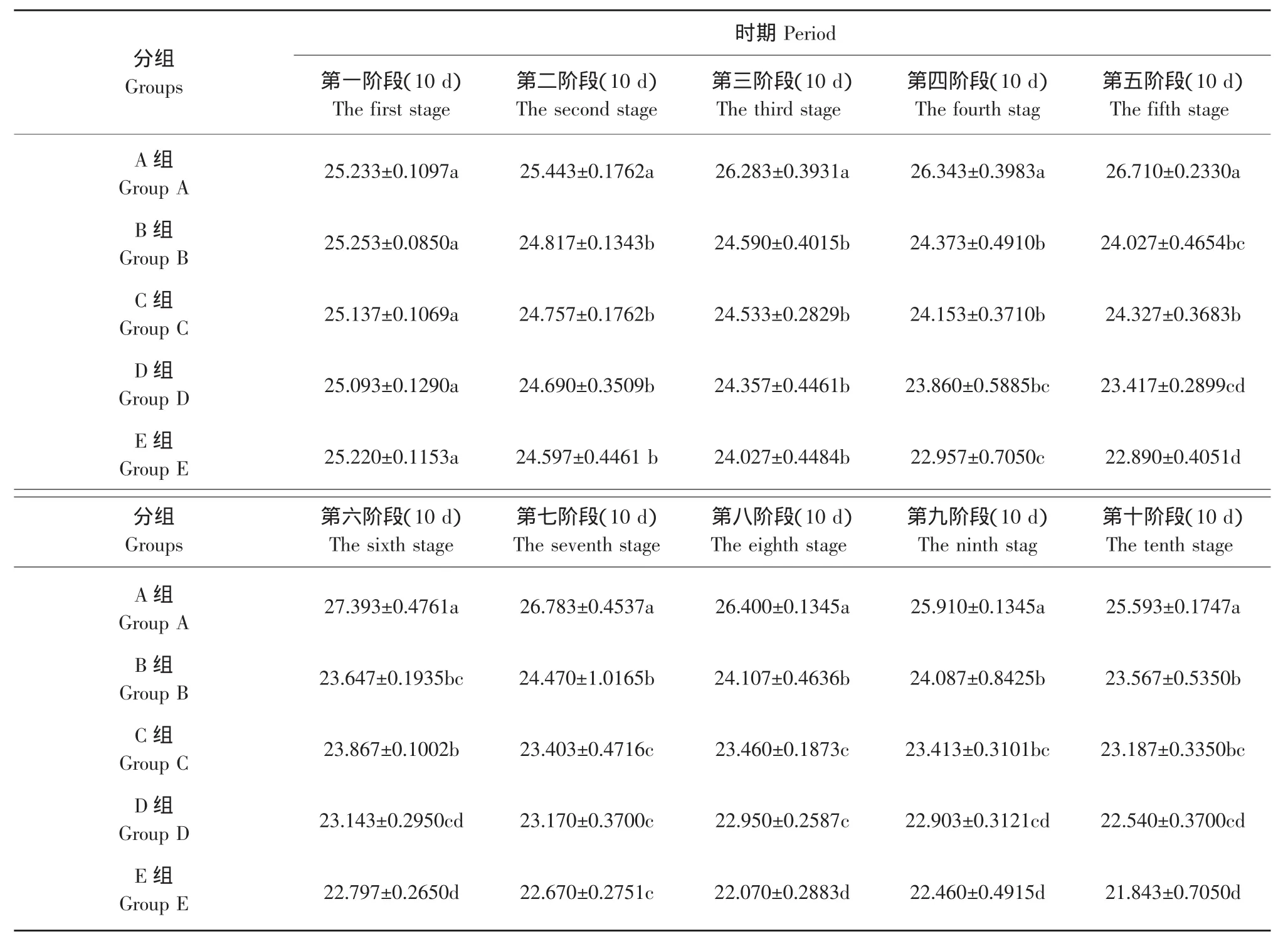
表4 雌性昆明小鼠90 d喂养试验体重变化Table 4 Weight change of female Kunming mice during 90 d feeding study (g)
应用Statistix 8.1软件LSD方法对比分析表明,受试物组雄性小鼠与空白对照组雄性小鼠相比,体重下降差异显著(P<0.05)。
通过表3、4对比可以发现,用乙草胺灌胃的小鼠体重明显下降,而空白对照组体重基本保持不变,E组与A组体重雄性降低约19.2%、雌性降低约14.7%。由于各组灌胃剂量低于LD0,乙草胺在试验动物体内积累需要一个过程,同时小鼠达到成年后还有一个体重增加过程,因此在试验前期各试验组小鼠体重均有明显的增加趋势,空白对照组小鼠由于饲养期间温度、喂食量、小鼠的年龄等因素的影响以及饲养过程中小鼠的死亡都会对小鼠的平均体重有一定的影响,因此在试验的后半段小鼠的平均体重有一个降低的趋势。随着试验的进行,乙草胺在小鼠的体内积累到一定数量,即产生了毒副作用,使小鼠出现了一系列病理反应:体重下降、活动减少、被毛蓬松、有轻微颤抖等,这与李华文、陆丹等做的乙草胺经皮毒性的研究中的乙草胺中毒现象相似[12]。试验结束前两周内死亡的小鼠体重都小于平均体重,受试物组小鼠与空白对照组相比体重下降差异显著(P<0.05)。
2.3 实验小鼠肝脏与体重比
刘阳等研究发现,乙草胺可以使其靶器官--肝脏中的抗氧化酶受到抑制、损伤肝脏细胞的DNA、诱发肝脏组织细胞损伤[10]。林丽白等研究表明乙草胺中毒机制主要在肝内经非特异性酰胺酶作用,迅速水解为相应的酸或在某些情况下以原形排出,从而影响机体组织所需的氧量,导致窒息、死亡[11]。
因此本研究通过测量肝脏与体重之比,来反映肝脏受损伤程度。肝脏与体重之比如表5所示。
试验结束后,解剖小鼠测量小鼠肝脏和体重,雄性鼠肝脏与体重比值平均值差异不显著(P>0.05),而雌性鼠肝脏与体重比值平均值差异显著(P<0.05)。这表明了与雄性鼠相比,在喂食相同剂量的乙草胺的情况下,雌性鼠肝脏更易受到损伤。
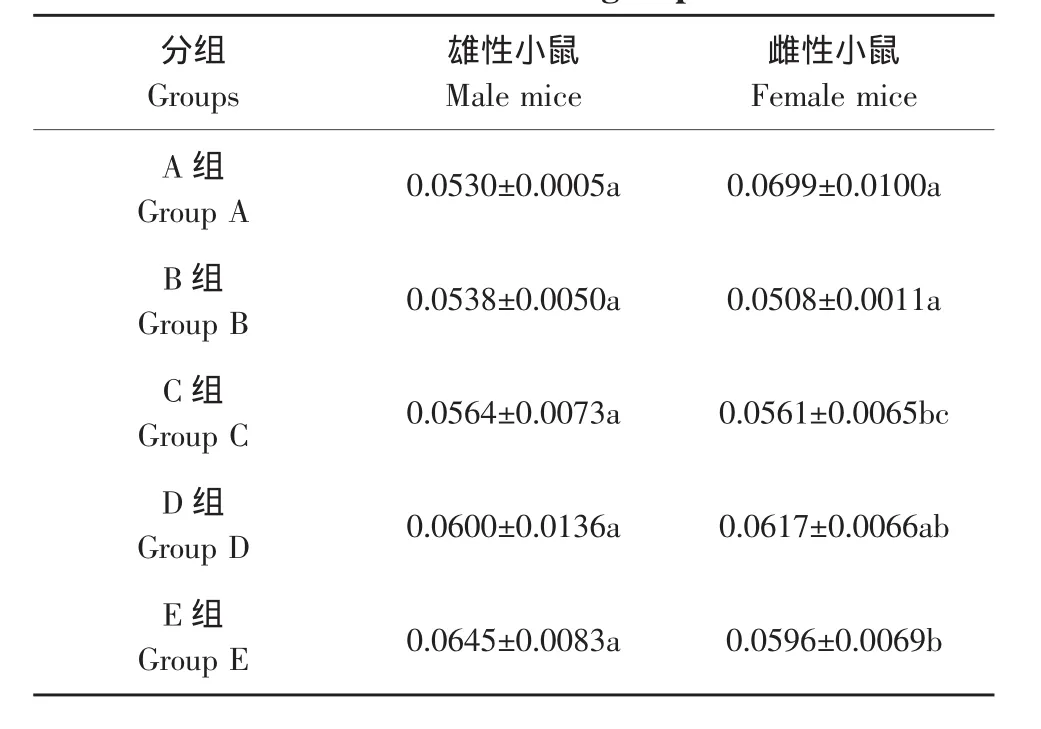
表5 不同剂量组昆明小鼠肝脏与体重比值的平均值Table 5 Ratio of liver to body weight of Kunming mice in different dose groups
2.4 HE染色镜检观
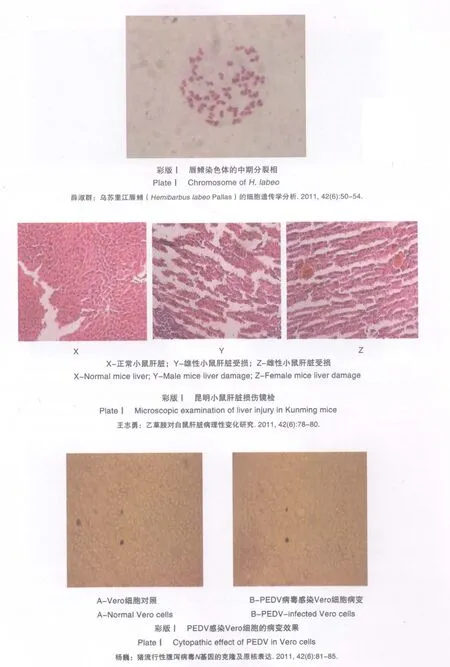
试验期间濒临死亡或者自然死亡的小鼠,随时解剖,活体在试验终期全部解剖。取肝脏,称肝脏重与体重。标本经体积分数为10%的中性福尔马林缓冲液固定5~7 d,取材之后再次固定12 h。组织以乙醇脱水,二甲苯透明,石蜡包埋,切片,HE染色,树胶封固。光镜图片放大倍数为目镜10×物镜20,即200倍放大条件下镜检。肝脏损伤镜检图见彩版Ⅰ。
经HE染色镜检观察小鼠肝脏切片发现,受试物组与空白对照组相比脂肪明显增多、肝脏细胞明显出现纤维化,剂量越大差异越明显,这表明昆明小鼠肝脏已经受到了不同程度的损伤。
3 讨论
通过对试验期间小鼠体重的监测,以及试验结束后对测量小鼠脏器比并对肝脏进行HE染色镜检,记录数据,应用Statistix 8.1软件LSD方法对比分析数据发现:
a.灌胃乙草胺的小鼠体重明显下降,而空白对照组体重基本保持在一个相对稳定的体重上下波动,在试验的后期开始下降。这是由于小鼠已经成长到相当于人的四五十岁的年龄阶段,过了壮年时期,进入了中老年时期,体重和身体机能都开始下降了。同时饲养期间温度、喂食量、小鼠的年龄、以及饲养过程中小鼠的意外死亡等因素对空白对照组小鼠体重的称量结果会产生一定的影响,因此在试验中空白对照组小鼠的平均体重在一定的体重范围内波动,试验后期有降低的趋势(如表3与表4中A组所示)。
b.E组与A组体重相比 (如表3、4中所示),雄性小鼠体重降低约19.2%、雌性小鼠体重降低约14.7%。由于各组灌胃剂量低于LD0,乙草胺在试验动物体内积累需要一个过程,同时老鼠达到成年后还有一个体重增加过程,因此在试验前期各试验组小鼠体重均有明显的增加趋势。随着试验的进行,乙草胺在小鼠的体内积累到一定量,产生了毒副作用,小鼠出现了一系列病理生理反应,开始出现体重下降、活动减少、被毛蓬松、有轻微颤抖等中毒现象,这与李华文、陆丹等做的乙草胺经皮毒性的研究中的乙草胺中毒现象相似[12]。试验结束前两周内死亡的小鼠体重都在23 g以下,受试物组小鼠与空白对照组相比体重下降差异显著(P<0.05)。
c.试验结束时宰杀活体小鼠,取肝脏计算各剂量组的小鼠肝脏与体重的比值,如表5所示,雄性小鼠脏器比差异不显著(P>0.05),雌性小鼠脏器比差异显著(P>0.05),这表明与雄性小鼠相比,在灌胃相同剂量乙草胺的情况下,雌性小鼠肝脏更易受到损伤,同时对比试验期间雄性小鼠与雌性小鼠的体重变化可知,乙草胺对雌性小鼠的毒性作用比雄性小鼠强。说明乙草胺的毒性作用存在着性别的差异。
d.经HE染色镜检观察小鼠肝脏切片发现(见彩版Ⅰ),受试物组与空白对照组相比脂肪明显增多、肝脏细胞之间的间隙变大、肝脏细胞明显出现纤维化,投药剂量越大这种差异越明显,这表明小鼠肝脏已经受到了不同程度的损伤。而刘阳等研究发现,乙草胺可以使其靶器官—肝脏中的抗氧化酶受到抑制、造成肝脏细胞的DNA损伤、诱发肝脏组织细胞损伤[10]。
4 结论
通过上述研究表明,即使低浓度乙草胺长期摄入,也能够导致昆明小鼠出现累积性中毒反应,使其肝脏内脂肪增加,并导致肝脏出现组织纤维化,个别动物肝脏肿大。从病理学角度,继续摄入必将发展为肝硬化,导致肝功能丧失,而肝癌与肝硬化
关系密切。因此,人们如果长期低剂量的摄入乙草胺,会大大增加肝脏癌变的几率。
[1] 姚宝玉,王捷,于峰,等.乙草胺致癌病理学试验的评价[J].卫生毒理学杂志,2000,14(4):216.
[2] 裴道国,崔淑华,王雄,等.免疫亲合柱净化-气相色谱质谱法测定花生和大蒜中乙草胺残留量[J].中国食品卫生杂志,2008,20(5):418-420.
[3] 郑和辉,叶常明.乙草胺和丁草胺在土壤中的移动性[J].环境科学,2001,22(5):117-121.
[4] 李爱军,王明泰,宋立国,等.植物源性饲料中乙草胺残留量的快速测定法[J].饲料研究,2007(10):14-16.
[5] Ye C.Environmental behavior of the herbicide acetochlor in soil[J].Environmental Contamination and Toxicology,2003,71:919-923.
[6] Barbash J E,Thelin Q P,KoiPin D W.Major herbicides in ground water:results from the national water-quality assessment[J].Enviorn,2001,30:831-845.
[7] Xue N D,Xu X B,Jin Z L.Screening 31 endocrine-disrupting pesticides in water and surface sediment samples from Beijing cuanting reservoir[J].Chemosphere,2005,61:1594-1606.
[8] Clark G M,Goolsby D A.Occurrence and transport of acetochlor in streams of the missisipi river basin[J].Journal of Environmental Quality,1999,28:1787-1795.
[9] Karlkhoff S J,Kolpin D W,Thurman E M,et al.Degradation of chloroacetanilide herbicide:The prevalence of sulfonic and oxanilic acid metabolites in Iowa ground waters and surface waters[J].Environmental Science Technology,1998,32:1738-1740.
[10] 刘阳,张迎梅.除草剂乙草胺对花背蟾蜍肝脏的影响及机理[C].兰州:兰州大学,2006.
[11] 林丽白,陈家,陈小微,等.新型除草剂乙草胺原油的急性毒性研究[J].中国职业医学,1995(2):12-13.
[12] 李文华,陆丹,吴军,等.乙草胺经皮毒性的研究[J].毒理学杂志,2008,22(4):327-329.

