酿酒酵母拮抗作用的蛋白组分析
沈海萍,朴永哲,祖国仁,夏先锋,赵长新,*
(1.大连工业大学生物工程学院,辽宁大连 116034;
2.大连民族学院生命科学学院,辽宁大连 116600)
酿酒酵母拮抗作用的蛋白组分析
沈海萍1,朴永哲2,祖国仁1,夏先锋1,赵长新1,*
(1.大连工业大学生物工程学院,辽宁大连 116034;
2.大连民族学院生命科学学院,辽宁大连 116600)
为研究混菌发酵过程中酿酒酵母胞外蛋白对克鲁维酵母的拮抗作用并初步分离毒蛋白,采用超滤法提取酿酒酵母纯培养及透析培养的胞外蛋白,分别加入克鲁维酵母纯培养液中,通过平板菌落计数法,动态观测酿酒酵母胞外蛋白对克鲁维酵母生长的影响;双向电泳结合PDQuest软件分离解析酿酒酵母两种培养条件下的胞外蛋白图谱。实验结果表明,纯培养下的酿酒酵母胞外蛋白对克鲁维酵母无拮抗作用,而透析培养得到的酿酒酵母胞外蛋白可以导致克鲁维酵母提前死亡;纯培养图谱共79个蛋白点;透析培养图谱共109个蛋白点,比纯培养的新增30个蛋白点。由此推断:酿酒酵母可以分泌导致克鲁维酵母提前死亡的分子量大于10ku的蛋白类毒素,并且这种毒素的分泌不是自发的,而是在克鲁维酵母分子量小于10ku分泌物的诱导作用下才会产生。这30个新增蛋白点包括对克鲁维酵母的拮抗蛋白。
酵母,胞外蛋白,拮抗作用,双向电泳,透析培养
葡萄酒自然发酵是由两类酵母,即酿酒酵母和非酿酒酵母共同完成的。在发酵初期,作为优势菌株的非酿酒酵母(如克鲁维酵母)的生长,有助于酒体风味的形成,特别是甘油、酯类和高级醇等物质的产生对酒的风味物质形成有积极作用[1-2]。而随着发酵的进行,非酿酒酵母逐渐死亡,具有高酒精耐受性的酿酒酵母成为优势菌株,完成后期酒精发酵[3]。因此,非酿酒酵母存活时间的长短对葡萄酒风味物质的形成有着很大的影响。近年来,国际上有学者在实验室条件下,观测到在混菌发酵中酿酒酵母的存在导致非酿酒酵母的提前死亡的现象[4],并尝试解释这一有趣的现象。传统观点认为酿酒酵母和非酿酒酵母的这种交替是由各菌种对外界不良环境的抵御能力上的差异导致的,比如酒精浓度的升高、有机酸的积累、pH显著降低以及营养物质的消耗等都可能导致非酿酒酵母的提前衰亡[5]。近年,这种观点的通用性受到了质疑,细胞间相互作用的理论逐渐成为研究热点并被广泛认可。这种相互作用包括两方面:一些研究表明,酵母在发酵过程中产生的一些代谢产物会抑制其他菌的生长,如中长链脂肪酸,一些有毒化合物如糖蛋白、多肽等,小分子量的信号分子等[6-7];也有一些研究表明,酿酒酵母与非酿酒酵母间的交替作用是由于在高细胞浓度下细胞间争夺生存空间造成的[8-9]。国际上,丹麦学者论证了混菌发酵中酿酒酵母CCMI 885蛋白类分泌物对几种非酿酒酵母具有拮抗作用,并且用单项电泳分离出分子量在2~10ku的蛋白毒素[10]。国内,翟明昌等[11]发现了酿酒酵母FFC2144的存在导致了克鲁维酵母FCC2116的提前死亡,并排除空间争夺、溶氧、酒精度、pH、氮源等因素,确定是酿酒酵母的分泌蛋白导致了克鲁维酵母的提前死亡,并指出酿酒酵母大分子量分泌蛋白对克鲁维酵母也具有拮抗作用;并采用双向电泳方法研究了克鲁维酵母非程序衰亡的胞内蛋白组表征[12]。本实验在前人研究的基础上,通过双向电泳技术,从蛋白组学层面进一步研究酿酒酵母分泌的哪些蛋白导致了克鲁维酵母的提前死亡,并试图揭示酿酒酵母产生抑菌蛋白的机制。
1 材料与方法
1.1 材料与仪器
酿酒酵母(Saccharomyces cerevisiae FFC2144)大连工业大学菌种保藏中心;耐热克鲁维酵母(K luyveromyces Thermotolerans FCC2116) 大连工业大学菌种保藏中心;培养基采用改良的全合成培养基(L)[13]40g葡萄糖,6g柠檬酸,6g DL-苹果酸,1.5g酒石酸,6.7g YNB(Yeast nitrogen base without am ino acids,Difco),10g(NH4)2SO4,0.5g色氨酸,0.5g组氨酸,0.5g精氨酸,pH 3.3。
圆盘式电泳仪及垂直板电泳槽 北京六一厂;1L螺口瓶 纱布封口。
1.2 菌体培养
培养条件:28℃,摇床转速100r/m in。
透析培养:将克鲁维酵母接种于透析袋(截留分子量为10ku)的内部,接种后袋内共计15m L发酵液,酿酒酵母接种于透析袋的外部,接种后袋外共计485m L发酵液,接种浓度均为1×104cfu/m L。
1.3 菌体生长曲线测定
自接种时刻开始,每5h在无菌室取发酵液,稀释涂平板(YPDA培养基[12]),培养12~24h,单菌落计数,并合算成该时间段的菌体浓度(cfu/m L)。
1.4 蛋白提取
根据酿酒酵母FFC2144菌体浓度(生长进入平衡期)、残糖[14](少于2g/L)及酵母细胞完整性,选择发酵60h为酿酒酵母FFC2144胞外蛋白提取时间。
胞外蛋白提取方法-超滤法:发酵液于6000r/m in离心,得上清液。上清液用10ku的超滤膜冰浴浓缩,双蒸水多次冲洗以去掉杂质及小分子物质,再通过反冲洗滤膜,将截留的大分子物质冲洗下来。将蛋白浓缩液冷冻干燥,待用。
1.5 抑菌实验
离心后的发酵上清液用超滤方法除去糖、酸、醇、酯等较小分子量物质,并且通过冷冻干燥法将其体积从的150m L左右体积的溶液浓缩到约10m L,将得到的胞外蛋白浓缩液加入到刚刚接种的克鲁维酵母FCC2116的纯菌发酵液中,进行培养。动态观测克鲁维酵母的生长情况(即各时段菌体浓度)。
1.6 双向电泳
样品制备:在冰浴条件下,将冻干的蛋白溶解于适量的蛋白溶解液(8mol/L尿素,50mmol/L DTT,5% Triton×100,2.5%pH4~6两性电解质,0.5%pH3~10两性电解质)中,并辅助超声及漩涡振荡促进溶解。目测蛋白溶解后,于13000r/m in离心10m in,取上清液,用考马斯亮蓝法测定溶解液中蛋白浓度,添加新鲜溶解液,混匀,使各样品蛋白终浓度为150μg/15μL(上样量),并按上样量分装,冷冻保藏。上样前样品中加入微量溴酚蓝指示剂,充分混匀。
胶条制作:在王祥余等[15]方法基础上略加修改,注胶量不以体积计,而保证每根胶长度为7cm。
等电聚焦条件:200V 0.5h,500V 1h,1350V 4h;每次升高电压时,按约200V/m in速度匀速缓慢提升电压。
平衡条件:两步平衡。平衡液1∶6mol/L尿素,2% SDS,100mmol/L Tris(pH 8.8),30%甘油,1%DTT,15min;平衡液2∶6mol/L尿素,2%SDS,100mmol/L Tris(pH 8.8),30%甘油,2%碘乙酰胺,15m in。
SDS-PAGE:5%的浓缩胶,12%分离胶。染色方法:Neuhoff考染法[16]。
1.7 凝胶图像分析
凝胶通过BINTA 2020D型凝胶成像系统进行拍照,利用PDQuest 8.0软件完成对凝胶图像的剪裁、斑点检测、匹配、差异比较。
2 结果与讨论
2.1 酿酒酵母胞外蛋白对克鲁维酵母的影响
对图1中三组关键差异数据进行整理分析,得表1(各组数据重复性标准偏差以±标注)。通过Excel数据分析,空白组和纯培养胞外蛋白添加组的p为0.2316,而空白组比对透析蛋白添加的p为0.000813<0.05,因此可以判断:酿酒酵母FFC2144纯培养的大分子量蛋白(大于10ku)的添加对克鲁维酵母FCC2116生长影响不大,而透析培养得到的胞外蛋白对FCC2116有显著影响。由此可以推断,酿酒酵母FFC2144分泌出对鲁维酵母生长具有拮抗作用的蛋白类物质这一现象并非自发;即在透析培养中,克鲁维酵母FCC2116产生一种小分子信号物质,诱导酿酒酵母FFC2144分泌出特异蛋白。其中部分新增的特异蛋白(包含于2DE图谱的总新增蛋白点中),最终导致了克鲁维酵母的提前死亡。
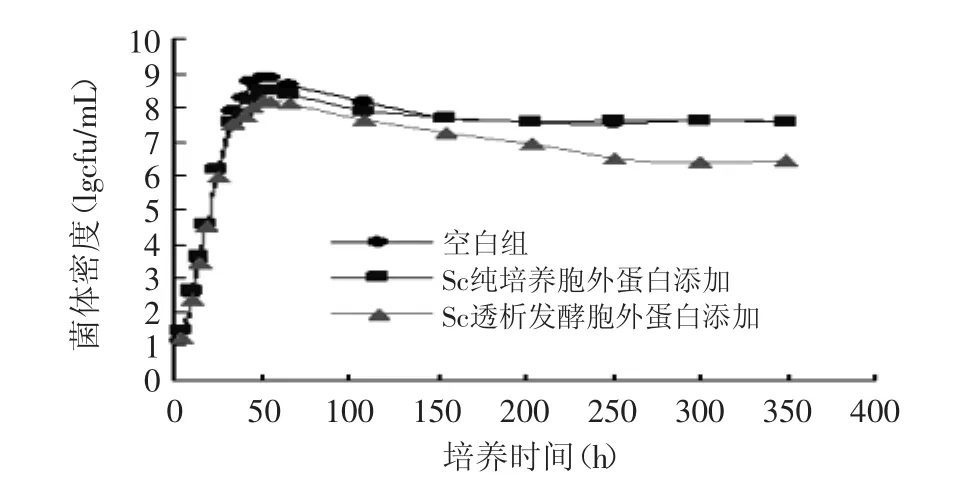
图1 不同条件下克鲁维酵母生长曲线Fig.1 Curves of Kluyveromyces Thermotolerans concentration under different conditions

表1 不同条件下克鲁维酵母数量的变化(lgcfu/mL)Table 1 Changes of Thermotolerans concentrationquantity under different conditions(lgcfu/mL)
2.2 纯培养和透析培养的酿酒酵母胞外蛋白图谱比较
通过PD Quest软件,可对两张双向电泳图谱进行蛋白点总数计算、同一蛋白点匹配以及差异蛋白分析(本实验中仅对新增蛋白点进行定性分析,不进行蛋白含量的差异比较)。图2a中,酿酒酵母FFC2144纯培养胞外蛋白双向电泳图谱中共有79个点,主要分布在分子量大于40ku的酸性区域。图2b中,从透析培养中提取的酿酒酵母FFC2144胞外蛋白双向电泳图谱中包含109个点,分布集中在分子量大于20ku的酸性和中性区域。比较图2中a、b两图谱,发现透析培养蛋白图谱上新增30个点,占纯培养总蛋白种类的54%。变化如此巨大,反映了酵母蛋白分泌对环境的灵敏度,也体现了胞外蛋白分泌机制对酵母环境适应性的重大意义。增加点多分布于pH 6~8区间,分子量在30ku以上。由2.1结果可推断,这新增30个蛋白点中必包括对FCC2116的拮抗蛋白。

图2 酿酒酵母两种培养条件下胞外蛋白双向电泳图谱Fig.2 2DE images of Saccharomyces Cerevisiae extracellular proteins from the two cultures
3 结论
酿酒酵母可以分泌导致非酿酒酵母提前死亡的分子量大于10ku的蛋白类毒素(有别于国际上发现的酵母小分子量抑菌蛋白),并且这种毒素的分泌不是自发的,而是在非酿酒酵母分子量小于10ku分泌物的诱导作用下才会产生。酿酒酵母透析培养胞外蛋白图谱比纯培养图谱新增30个蛋白点,其中包括对非酿酒酵母的毒蛋白。研究结果有望为酿酒酵母拮抗蛋白的相关诠释作补充。
[1]Romano P,Suzzi G,Com I G,et al.Glycerol and other fermentation products of apiculate wine yeasts[J].Journal of Applied Microbiology,1997,82(6):615-618.
[2]Eglic M,EDnger W D,Mitrakul C M,et al.Dynamics of indigenous and inoculated yeast populations and their effect on the sensory character of Riesling and Chardonnay wines[J]. Journal of Applied Microbiology,1998,85(12):779-789.
[3]Clan IM,Picciott IG.The growth kinetics and fermentation behaviour of some non-Saccharomyces Cerevisiae yeasts association with wine-making[J].Biotechnology Letters,1995,17(11):1247-1250.
[4]Nevado P F,Albergaria H,Hogg T,et al.Cellular death of two non-Saccharomyces Cerevisiaes wine-related yeasts during mixed fermentations with Saccharomyces Cerevisiae[J]. International Journal of Food Microbiology,2006,108(3):336-345.
[5]Pretorus I S.Tiabring wine yeast for new millennium:novel approaches to the ancient art of winemaking[J].Yeast,2000,16(2):675-729.
[6]Edwards C G,Beelman R B,Bartley C E,et al.Production of decanoic and other volatile compounds and the growth of yeast and malolactic bacteria during vinification[J].American Journal of Enology and Viticulture,1990,41(3):48-56.
[7]FleetGH.Yeast interactions and wine flavour[J].International Journal of Food Microbiology,2003,86(9):11-22.
[8]Nissen P,Nelsen D,Arnegorg N.Viable Saccharomyces Cerevisiae cells athigh concentrations caused early growth arrest of Non-Saccharomyces Cerevisiae mechanism[J].Yeast,2003,20(9):331-341.
[9]Nissen P,Arneborg N.Characterization of early deaths of Non-Saccharomyces yeasts inmixed cultureswith Saccharomyces Cerevisiae[J].Archives of Microbiology,2003,180(7):257-263.
[10]Albergaria H,Francisco D,Gori K et al.Saccharomyces Cerevisiae CCMI 885 secretes peptides that inhibit the growth of some non-Saccharomyces wine-related strains[J].Applied Microbiology Biotechnology,2010,86(3):965-972.
[11]翟明昌,朴永哲,王祥余,等.葡萄酒发酵过程中酵母菌之间相互抑制作用的研究[J].中国微生态学杂志,2011,23(1):18-21.
[12]翟明昌,朴永哲,王祥余,等.混菌发酵中不同分子量代谢产物对非酿酒酵母胞内蛋白及酒体有机酸的影响[J].微生物学通报,2011,38(9):1443-1448.
[13]Nissen P,Arneborg N.Characterization of early deaths of non-Saccharomyces yeasts inmixed cultureswith Saccharomyces cerevisiae[J].Archives of Microbiology,2003,180(4):257-263.
[14]黄洁,宋纪蓉,史红兵,等.苹果发酵液中残余还原糖的测定方法比较[J].工业微生物,2011,31(3):38-40.
[15]王祥余,朴永哲,翟明昌,等.酿酒酵母FFC2146胞内蛋白及胞外蛋白双向电泳条件优化及图谱建立[J].微生物学通报,2011,38(2):270-274.
[16]Neuhoff V,Arold N,Taube D,et al.Improved staining of proteins in polyacrylamide gels including isoelectric focusing gels with clear background at nano-gram sensitivity using Coomassie Brilliant Blue G-250 and R-250[J].Electrophoresis,1988,9(6):255-262.
Proteom ic analysis on the antagonism of Saccharom yces Cerevisiae
SHEN Hai-ping1,PIAO Yong-zhe2,ZU Guo-ren1,XIA Xian-feng1,ZHAO Chang-xin1,*
(1.School of Biological Engineering,Dalian Polytechnic University,Dalian 116034,China;
2.College of Life Science,Dalian Nationalities University,Dalian 116600,China)
To study the antagonism of Saccharomyces Cerevisiae’s extracellular p roteins against Kluyveromyces Thermotolerans in the m ixed culture,and to p relim inarily separate the toxic p roteins,extracellular p roteins of Saccharomyces Cerevisiae from sing le culture and dialysis tube fermentation were extracted by ultrafiltration,added into the sing le culture of Kluyverom yces Thermotolerans respec tively,for further population dynam ic analysis of Kluyveromyces Thermotolerans under the influence of Saccharomyces Cerevisiae extracellular p roteins by p late countmethod.The extracellular p roteins of Saccharomyces Cerevisiae from the two cultures were seperated and analyzed using two-d imensional electrophoresis combined w ith PDQuest software. Statistics showed that extracellular p roteins of Saccharomyces Cerevisiae from sing le culture d isp layed no antagonistic action on Kluyverom yces Thermotolerans,while those extrac ted from the d ialysis tube fermentation induced the early death Kluyveromyces Thermotolerans.79 spots were detected on the sing le culture p rofile while 109 spots were found on the dialysis tube fermentation one.By com parison,30 new spots appeared on the d ialysis tube fermentation image.In conc lusion Saccharom yces Cerevisiae could secrete high molecular weight(>10ku)p roteins that could be toxic to Kluyverom yces Thermotolerans.Moreover,the secretion of toxic p roteins was not spontaneous,but by the induction of secretion smaller than 10ku from non-Saccharomyces Cerevisiae.The antagonistic p roteins were inc luded w ithin the 30 new spots.
yeast;extracellular p roteins;antagonism;two-dimensionalelec trophoresis;dialysis tube fermentation
TS201.3
A
1002-0306(2012)22-0178-04
2012-05-08 *通讯联系人
沈海萍(1986-),女,硕士研究生,研究方向:微生物学。

