淋浇发酵法生产细菌纤维素的结构与性质研究
张丽平,卢红梅,*,彭湘屏,戴 锐
(1.贵州大学贵州省发酵工程与生物制药重点实验室,贵州贵阳 550003;2.贵州大学化学与化工学院,贵州贵阳 550003)
淋浇发酵法生产细菌纤维素的结构与性质研究
张丽平1,2,卢红梅1,2,*,彭湘屏1,2,戴 锐1,2
(1.贵州大学贵州省发酵工程与生物制药重点实验室,贵州贵阳 550003;2.贵州大学化学与化工学院,贵州贵阳 550003)
主要对淋浇发酵生产的细菌纤维素的外观形态、微观结构、化学结构、纯度、持水性、孔隙度和热重特性进行了研究,将其与静态和摇瓶培养方式得到的细菌纤维素进行了比较。结果表明,培养方式不同,细菌纤维素的外观形态、合成模式和微观结构都不相同;淋浇发酵法得到的细菌纤维素的-OH缔合度、聚合度、纯度、持水性、孔隙度、热稳定性均高于静态发酵细菌纤维素和摇瓶发酵细菌纤维素,但结晶度和晶体粒度小于静态发酵细菌纤维素,大于摇瓶发酵细菌纤维素。
细菌纤维素,淋浇发酵,结构,性质
与植物和动物纤维素相比,细菌纤维素具有高纯度、高结晶度、高聚合度、高持水性和高复水性等独有的优良性质[1],在传统食品、食品基料、低肉肠、发酵香肠和茶饮料中都有广泛的应用,是目前最具发展前景的生物基础和纳米生物材料[2]。淋浇发酵法的生产设备是淋浇塔,液体培养基从塔顶加入,可与填料层充分接触,淋浇发酵法低剪切力和高溶氧量且可控的优势主要依靠填料吸附菌种和淋浇回流增氧两大工艺来实现。在淋浇发酵过程中,菌种吸附于填料之上,为细菌纤维素的合成提供了充足的三维空间,细菌纤维素的形成过程与静态和摇瓶培养时可能有所不同。因此,对淋浇发酵法生产的细菌纤维素的性能进行研究,同时与静态和摇瓶培养方式进行比较,可以为其今后在食品及材料领域的应用提供理论依据。
1 材料与方法
1.1 材料与仪器
木醋杆菌(Acetobacter xylinum) 贵州大学发酵工程与生物制药重点实验室保藏;纤维素酶酶活为10,000U/g 日本Yakult公司;培养基 蔗糖20g,酵母膏5g,蛋白胨5g,磷酸二氢钾2g,硫酸镁1g,蒸馏水1000m L,pH自然;铜氨溶液 每100m L溶液中,铜1.30g,氨15.00g,氢氧化钠0.70g,蔗糖0.20g。
淋浇发酵塔 德国贝朗国际生物工程公司;S-3400N扫描电镜 云南金诺科技有限公司;NICOLET 5700 FT-IR显微红外光谱仪 山东三瑞科技有限公司;乌氏粘度计 毛细管直径为0.80mm,上海天平仪器厂;SMART APEXⅡ单晶衍射仪 德国Bruker公司;NETZSCH STA 449C热重质谱(TG-MS)分析仪
德国耐驰公司。
1.2 实验方法
1.2.1 培养方法 分别准确量取50m L发酵培养基置于250m L三角瓶中,121℃下灭菌20m in,冷却后在无菌条件下补加1m L无水乙醇,接入木醋杆菌种子液10%(5m L),将一部分装有50m L发酵培养基的三角瓶置于30℃下静置培养,将另一部分装有50m L发酵培养基的三角瓶置于30℃、150r/min条件下摇瓶培养144h。
淋浇发酵培养:准确量取8L发酵培养基加入经沸水消毒30m in的淋浇发酵塔中,将121℃下灭菌的玉米芯5kg趁热转移至淋浇发酵塔假底之上,盖好顶盖后强制冷却至35℃后进一步自然冷却至30℃,然后按10%(v/v)接种量迅速接入培养好的种子液,静置培养12h后,每隔2h淋浇一次,直至发酵结束(144h),整个过程采用33℃左右的温水进行控温,使塔内温度维持在28~31℃。
1.2.2 细菌纤维素的分离纯化方法 静态发酵细菌纤维素的分离纯化参照文献[3];摇瓶发酵细菌纤维素的分离纯化是将发酵液集于离心管中在4000r/min下离心15m in得细菌纤维素沉淀,后续处理同文献[3];淋浇发酵细菌纤维素的分离纯化是将细菌纤维素膜从玉米芯上小心撕下,后续处理同文献[3]。
1.2.3 样品制备 细菌纤维素膜的制备:将细菌纤维素湿膜平铺于平板上于105℃下烘干至恒重;细菌纤维素粉末的制备:取适量烘干的细菌纤维素膜于清洁研钵中充分研磨。
1.3 分析方法
聚合度的测定采用乌氏粘度计法[4]。
纯度分析采用将含纤维素酶的柠檬酸-磷酸氢二钠缓冲液的上清液加入到纤维素粉末中,再烘干称重的方法[5]。
持水性分析:将细菌纤维素湿膜称重后放入105℃烘箱中烘干,称其重量,再将其放入常温水中直到纤维素膜不再吸水为止,取出称重。
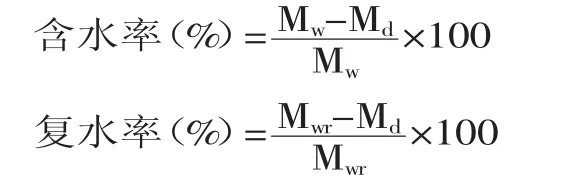
式中,Mw代表湿膜的质量;Md代表干膜的质量;Mwr代表复水膜的质量。
孔隙度分析:将上述复水膜采用细线系捆,采用文献[6]中的装置,称量其悬浮在水中的质量,记为Mww[7],则:
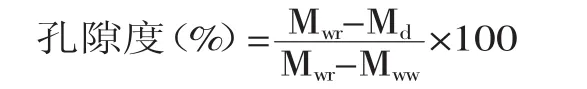
式中,Mw代表湿膜的质量;Md代表干膜的质量;Mwr代表复水膜的质量。
1.4 检测方法
1.4.1 扫描电镜(SEM) 将细菌纤维素干膜用喷金镀膜后利用扫描电子显微镜观察其微观结构,电压25kV。
1.4.2 傅里叶红外光谱 将经提纯后的细菌纤维素薄膜自然干燥,测试其红外光谱,450mW,1064nm扫描范围400~4000cm-1,设定分辨率4cm-1,扫描速度为0.2cm/s,扫描次数为16次,室温下操作。
1.4.3 X-射线衍射 将细菌纤维素干膜平整固定在样品架上,铜靶,测试电压40kV,测试电流l00mA,速率5°/m in,步宽0.02°,2θ为0~80°大范围扫描。根据X衍射参数,由下面两个计算公式分别计算细菌纤维素的结晶度(Xc)和晶体的粒径L[8-9]。
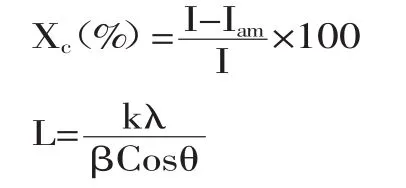
式中,I代表衍射峰的衍射强度;Iam代表无定形区衍射强度;β代表半峰宽(rad);k代表常数,通常取
0.89;λ代表X射线波长(0.15406nm);θ代表布拉格衍射角。
1.4.4 热重质谱分析 适量称取细菌纤维素干膜样品,利用STA 449C热分析仪,N2氛围,以10℃/min的升温速率从20℃升温至800℃[10],观察样品质量随温度的变化情况,得到TG-DSC曲线。
2 结果与讨论
2.1 外观形态
三种培养方式下获得的细菌纤维素的外观形态有所不同,其中淋浇发酵细菌纤维素(Tr-BC)贴于玉米芯表面生成,呈不规则片状薄膜,每片薄膜的厚度不一;静态培养细菌纤维素(St-BC)为层状薄膜,膜的形态取决于发酵容器的形状,膜的厚度相对均匀;摇瓶培养细菌纤维素(Ag-BC)表现为薄丝带状。
2.2 微观结构
采用扫描电子显微镜观察三种培养方式下获得的细菌纤维素的微观结构,结果如图1所示。

图1 不同培养方式下细菌纤维素SEM图Fig.1 SEM figure of bacterial cellulose in different cultivationmethods

表1 不同培养方式下细菌纤维素红外光谱分析结果Table 1 Infrared spectral analysis results of bacterial cellulose in different cultivationmethods
放大倍数为2000倍时,观察细菌纤维素膜的表面结构,可以看出Tr-BC表面粗糙,纤维丝并不完全表现为同一平面内的交织排列,也表现出了垂直伸展,这说明Tr-BC能以三维的模式合成。相对而言,St-BC呈层状,而Ag-BC呈层层包裹的球形。放大倍数为20,000倍时,观察细菌纤维素膜的内部结构,可以看出三种细菌纤维素均为纤维丝带相互交织而成的网状结构,且纤维丝带粗细相当(20~65nm),但Tr-BC和St-BC的网状更加紧密,而Ag-BC的网状结构相对疏松。这说明了培养方式对细菌纤维素的微观结构有较大影响。

图2 不同培养方式下细菌纤维素红外光谱图Fig.2 Infrared spectra of bacterial cellulose from different cultivationmethods
2.3 化学结构
2.3.1 红外光谱分析 三种细菌纤维素样品红外光谱分析结果如表1和图2所示,吸收峰1、12、13、14证实了样品中大量—OH的存在;吸收峰3、7、8、17、18证实了—CH2—、>CH—和C—H的存在;吸收峰9、16证实了环C—O—C的存在;吸收峰10、15证实了直链C—O—C的存在。以上结果显示为细菌纤维素葡聚糖的特征吸收,可以推断出三种样品的主要成分均为细菌纤维素。由图2可以看出,三者的图谱基本一致,说明淋浇发酵细菌纤维素(Tr-BC)、静态发酵细菌纤维素(St-BC)、摇瓶发酵细菌纤维素(Ag-BC)的化学组成非常相似。但图2中标记的Ⅰ、Ⅱ、Ⅲ处存在细微差异,经分析,红外图谱中Ⅰ处的差异可能是因为Tr-BC的—OH的缔合程度相对较高,使吸收峰发生偏移所致[11];Ⅱ处吸收强度不同可能主要是因为样品中羰基和氨基含量不同所致;Ⅲ处的差异可能是由于三种样品聚合度存在一定差异,C—O—C振动吸收峰发生偏移所致。
2.3.2 聚合度 三种培养方式所得细菌纤维素样品的聚合度如表2所示,三者聚合度顺序为:Tr-BC>St-BC>Ag-BC,由此可见,不同的培养方式对细菌纤维素的聚合度有较大的影响。其中,St-BC的聚合度与王敏[12]报道的结果相近,但低于Kunihiko Watanabe等[13]报道的结果,这可能是因为菌种或培养基不同导致的,具体原因还有待深入研究。

表2 不同培养方式下细菌纤维素聚合度分析结果Table 2 Polymerization degree analysis results of bacterial cellulose in different cultivationmethods
2.3.3 XRD分析 三种培养方式下合成的细菌纤维素的X-射线衍射图谱如图3所示。与静态发酵细菌纤维素(St-BC)和摇瓶发酵细菌纤维素(Ag-BC)相似,淋浇发酵细菌纤维素(Tr-BC)分别在14.1°、16.9°和22.9°附近存在三个衍射峰,此三个峰分别对应纤维素晶体的<101>、<101>和<002>晶面,据此可知Tr-BC亦为I型纤维素[9,14]。

图3 不同培养方式下细菌纤维素X-射线衍射图(Cu-Ka)Fig.3 X-ray diffraction figure of bacterial cellulose in different cultivationmethods(Cu-Ka)
各样品的结晶度与晶体粒径的结果如表3所示,以I型纤维素的特征衍射峰(22.9°)和实际最强衍射峰(16.9°)计算的结晶度不同,但两种计算方法下的结晶度均表现为Ag-BC<Tr-BC<St-BC,细菌纤维素晶体粒径大小顺序也为Ag-BC<Tr-BC<St-BC,这是由于剪切力的存在影响了纤维素的晶型情况,使纤维素的超分子结构发生了改变,其原因是纤维素分子间的氢键在不同培养方式中发生了变化[15]。据颜志勇等[16]报道,结晶度与纤维的抗张强度、杨氏模量、硬度、伸长率、吸湿性、润胀度、柔软性等性质有一定的关系,晶体粒径与透明度、撕裂因子和裂断长有关,这可为细菌纤维素的应用提供依据。
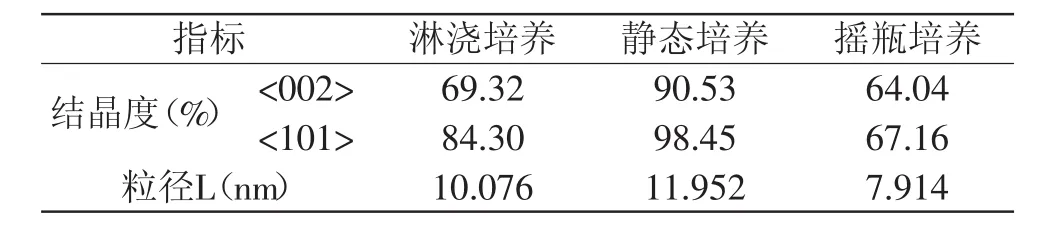
表3 不同培养方式下细菌纤维素的结晶度与晶体粒径(nm)大小分析Table 3 Crystallinity and crystal size(nm)analysis of bacterial cellulose in different cultivationmethods
2.4 纯度分析
分析三种培养方式下的细菌纤维素样品,结果如表4所示。三者的纤维纯度均较高,介于96%~98%之间,这与其他文献[13,15]报道相一致,证实了细菌纤维素的高纯度的特性。相比之下,Tr-BC的纤维纯度高于St-BC和Ag-BC,这可能是因为静态发酵时菌种生长于气液界面,细菌纤维素层状叠加成膜,由于膜面积较大,中间包裹的大量菌体和培养基难以处理彻底,故纯度相对较低,此结论与红外分析中波峰4、5反映的结果一致。

表4 不同培养方式下细菌纤维素的纯度Table 4 Purity of bacterial cellulose in different cultivationmethods
2.5 持水性分析
细菌纤维素的持水性能以含水率和复水率表征[17]。三种培养方式下BC含水率和复水率如表5所示,Tr-BC的复水率在三种培养方式下最高,其含水率也高达98.18%,由此可知Tr-BC具有较好的持水性能。此外,三种样品的复水率均低于含水率,St-BC更为明显,这可能是因为烘干过程破坏了细菌纤维素原来的结构,使其不能恢复到烘干前的溶胀状态。

表5 不同培养方式下细菌纤维素的持水性Table 5 Water holding capacity of bacterial cellulose in different cultivationmethods
2.6 孔隙度分析
由表6可知,Tr-BC的孔隙度高于St-BC和Ag-BC。此外,本实验结果比Weihua Tang等[18]报道的结果(92%)要低,这可能是由于采用不同干燥方式导致的结果。
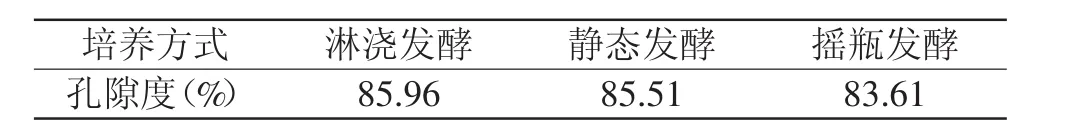
表6 不同培养方式下细菌纤维素的孔隙度Table 6 Porosity of bacterial cellulose in different cultivationmethods
2.7 热重分析
图4~图6分别是淋浇发酵细菌纤维素(Tr-BC)、静态发酵细菌纤维素(St-BC)和摇瓶发酵细菌纤维素(Ag-BC)的TG-DSC图谱(TG表示样品在某个温度下的失重率、DSC表示单位重量样品在某个温度下所造成的热电偶的电位差)进行比较可知,三种培养方式下获得的BC的TG曲线大致相同,根据三者的失重温度范围可以看出均包括失水、降解、煅烧三个阶段,但每个阶段的失重率各不相同,失水阶段失重率大小顺序为Tr-BC<St-BC<Ag-BC,这与前面所描述的三种细菌纤维素的含水率高低有关。降解阶段中,质量损失率大小顺序为Tr-BC>Ag-BC>St-BC,这与降解阶段持续时间长短有关。煅烧阶段结束后,样品残渣剩余率大小顺序为Tr-BC>St-BC>Ag-BC。
但三种培养方式下细菌纤维素的DSC曲线可以发现三者之间存在一定的差异。首先,降解阶段的起始温度和持续时间不同,起始降解温度顺序为Tr-BC>St-BC>Ag-BC,而持续时间顺序为Tr-BC>Ag-BC>St-BC,这说明Tr-BC的热稳定性高于St-BC和Ag-BC。其次,St-BC和Ag-BC分别在373.6、366.1℃出现明显的吸热峰,而Tr-BC在346.0、501.6℃出现两个放热峰,这说明三者在降解过程中发生的物理化学反应不同,进一步反映出三种细菌纤维素的结构存在差异。
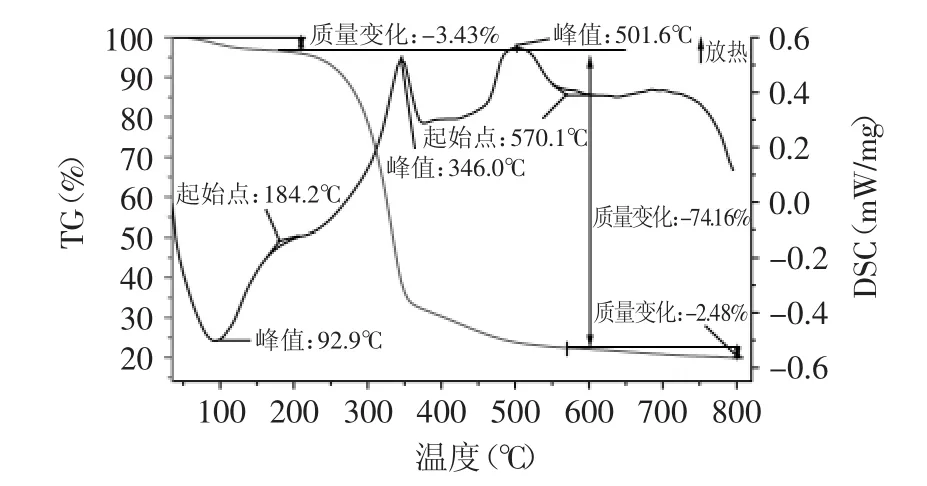
图4 淋浇发酵细菌纤维素TG-DSC图谱Fig.4 TG-DSCmap of tricking fermentation bacterial cellulose
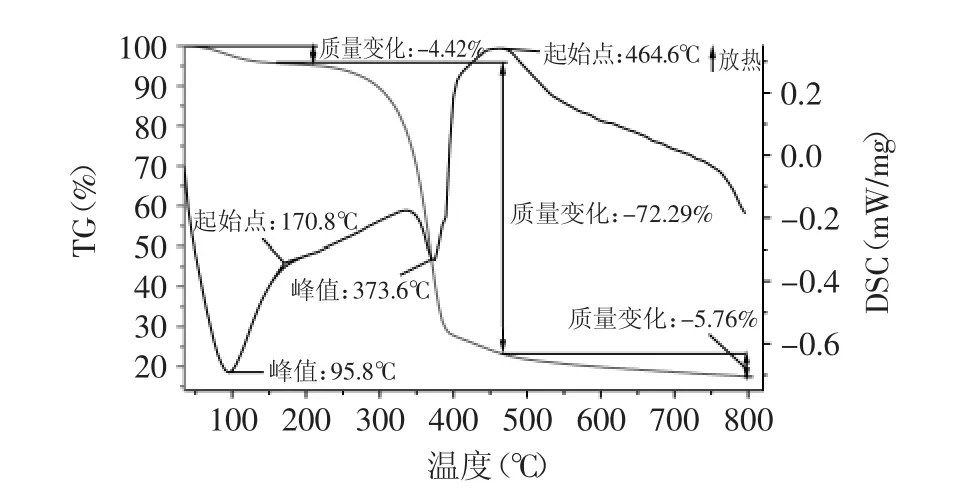
图5 静态发酵细菌纤维素TG-DSC图谱Fig.5 TG-DSCmap of static fermentation bacterial cellulose
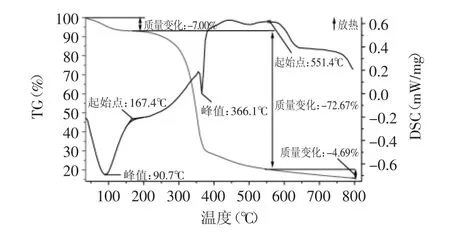
图6 摇瓶发酵细菌纤维素TG-DSC图谱Fig.6 TG-DSCmap of shake fermentation bacterial cellulose
3 结论
不同培养方式对细菌纤维素的外观形态、合成模式和微观结构有较大影响;Tr-BC在化学组成上与St-BC和Ag-BC无显著差异,但其—OH的缔合程度稍高;Tr-BC的聚合度高于St-BC和Ag-BC;Tr-BC的纤维纯度高于St-BC和Ag-BC;由X-射线衍射分析结果可知,本实验所得细菌纤维素为Ⅰ型纤维素,Tr-BC的结晶度和晶体粒径小于St-BC大于Ag-BC;Tr-BC的含水率低于St-BC和Ag-BC,其复水率和孔隙度均高于St-BC和Ag-BC;热重分析结果反映,Tr-BC的热稳定性略高于St-BC和Ag-BC,且三者在降解过程中发生的物理化学反应不同,进一步反映出三种细菌纤维素的结构存在差异。这些结果为细菌纤维素在食品及材料领域的应用提供了参考。
[1]崔思颖,朱明军,邓毛程,等.不同培养方式制备的细菌纤维素性质的比较[J].造纸科学与技术,2010,29(1):67-70.
[2]谢明霞,周媛.微生物纤维素的生物合成及其商业化应用[J].三峡大学学报,2008,30(5):76-80.
[3]Masayuki Onodera,Ikuro Harashima,Kiyoshi Toda,et al. Silicone Rubber Membrane Bioreactors for Bacterial Cellulose Production[J].Biotechnol Bioprocess Eng,2002,7:289-294.
[4]绍自强.纤维素醚[M].北京:化学工业出版社,2007:226-227.
[5]诸葛健,王正祥.工业微生物学实验技术手册[M].北京:中国轻工出版社,1994:209-213.
[6]CEMancini,CCBerndt,L Sun,etal.Porosity determinations in thermally sprayed hydroxyapatite coatings[J].Journal of Materlals Science,2001,36:3891-3896.
[7]Kitaoka K,Yamamoto H,Tani T,et al.Mechanical strength and bone bonding of a titanium fibermesh block for intervertebral fusion[J].JOrthop Sci,1997(2):106-113.
[8]张俐娜.高分子物理近代研究方法[M].武汉:武汉大学出版社,2006:192-193.
[9]Kuan-ChenCheng,Jeffrey M Catchmark.Effect of different additiveson bacterial cellulose production by Acetobacter xylinum and analysis of material property[J].Cellulose,2009,16(6):1033-1045.
[10]Feng Yuhong,Li Jiacheng,Lin Qiang,et al.Crystallinity and thermal decomposition of dialdehyde celluloses from bacterial cellulose[J].Key Engineering Materials,2007,330-332 II:1289-1292.
[11]孟令芝,龚淑玲,何永炳.有机波谱分析[M].武汉:武汉大学出版社,1997:265-290.
[12]王敏.细菌纤维素的溶解、成形工艺与性能研究[D].青岛:青岛大学,2009.
[13]KunihikoWatanabe,Mari Tabuchi,Yasushi Morinaga,et al. Structural features and properties of bacterial cellulose produced in agitated culture[J].Cellulose,1998(5):187-200.
[14]赵晓霞,朱平,王敏,等.细菌纤维素再生前后结构与性质上的差异[J].合成纤维,2009(1):6-10.
[15]黄丹,王清路.木醋杆菌QAX993发酵生产细菌纤维素条件的探讨[J].中国酿造,2008(12):36-37.
[16]颜志勇,王华平,陈仕艳,等.细菌纤维素的晶体结构[J].材料导报,2008,22(8):127-131.
[17]Oikawa T,Morimo T,AmeyamaM.Production ofcellulosefrom D-arabitol by Acetobacter xylinum[J].Bioscience Biotechnology and Biochemistry,1995,59:1564-1565.
[18]Weihua Tang,Shiru Jia,Yuanyuan Jia,et al.The influence of fermentation conditionsand post-treatmentmethodson porosity ofbacterial cellulosemembrane[J].World JMicrobiol Biotechnol,2009(8):173-180.
Study on structure and properties of bacterial cellulose produced by trickling fermentation
ZHANG Li-ping1,2,LU Hong-mei1,2,*,PENG Xiang-ping1,2,DAIRui1,2
(1.Guizhou Province Key Laboratory of Fermentation Engineering and Biopharmacy,Guizhou University,Guiyang 550003,China;
2.College of Chemistry and Chemical Engineering,Guizhou University,Guiyang 550003,China)
Bacterial cellulose(BC)p roduced by trickling fermentation were stud ied,inc lud ing extrinsic shape,m ic rostructure,chem icalstructure,purity,water holding capacity,porosity and thermo g ravimetric characteristics. With the com parison to bacterial cellulose p roduced by static fermentation and shaking fermentation.The result showed that:for d ifferent BC cultivation methods,the extrinsic shapes,synthetic mode and m icrostructure were d ifferent.The-OH associating deg ree,the polymerization degree,purity,water holding capacity,porosity,
thermal stability of trickling fermentation BC was higher than those of static fermentation BC and shaking fermentation BC.But the c rystallinity and crystal grain size were less than that of static fermentation BC and greater than that of shaking fermentation BC and.
bac terial cellulose;trickling fermentation;structure;p roperty
TS201.3
A
1002-0306(2012)22-0197-05
2012-05-24 *通讯联系人
张丽平(1987-),女,硕士研究生,研究方向:食品生物技术。
国家自然科学基金(31160338);贵州省科学技术基金(黔科合字[2010]2066)。

