NOTCH1基因3'-UTR段双荧光素酶报告载体的构建及其活性鉴定
邵新宏 韩 渊 于 游 张才全 (新疆医科大学第五附属医院普外科,乌鲁木齐 8300002)
目前研究结果显示:NOTCH1过度表达或突变表达是结直肠癌(Colorectal cancers,CRC)和T细胞淋巴瘤 (T cell lymphoblastic leukemia,T-ALL)患者中常见的一种基因异常,常与此类疾病的不良预后有密切关系[1,2]。NOTCH1是 NOTCH 基因编码的蛋白家族成员之一,它是一种单跨膜受体蛋白,其组成为:胞外区包括29~36个表皮生长因子样重复序列和3个富含半胱氨酸(lin12/notch repeat)的Notch重复区;胞内区(Intracellular domain of notch,ICN)由细胞膜向内依次是RAM结构区、6个细胞分裂周期基因10重复区、2个核定位信号、谷氨酸胺丰富区和富含PEST序列(即富含脯氨酸、谷氨酸、丝氨酸、苏氨酸的区域,与Notch受体的稳定性有关),并且NOTCH1在肿瘤细胞的分化、增殖和凋亡过程中发挥着重要作用。在某些恶性肿瘤中,NOTCH1蛋白的高表达和某些miRNA的异常表达常常共同存在,这说明某些miRNA可能通过调节NOTCH1蛋白的表达从而引起肿瘤的发生。
miRNA是含18~24碱基的短链非编码RNA,通过与靶基因的3'端非编码区完全或不完全互补结合,在转录后水平抑制蛋白质翻译或降解靶mRNA,从而调控目标基因的表达。目前研究结果发现:miRNA在调节生物发育,细胞分化,增殖和凋亡等生物过程中均扮演了重要的角色,并且发现大约50%的miRNA主要定位于与肿瘤相关的基因组的脆性位点[3],这些均说明miRNA在肿瘤发生过程中可能起了至关重要的作用[4-6]。因此,miRNA 与肿瘤的关系已逐渐成为近年来的研究热点。为了研究NOTCH1在结直肠癌发生发展中的作用及调节机制,我们使用一种改良的双荧光素酶报告质粒以更加准确评价miRNA靶向调控基因的荧光素酶的活性。我们成功构建了含NOTCH1基因3'非编码区(3'untranslated region,3'-UTR)双荧光素酶报告载体,预测出负性调控NOTCH1基因表达的miRNA,并证明了 miRNA-34a能够负性调节 NOTCH1的表达。
1 材料与方法
1.1 主要试剂和仪器 人胚肾上皮细胞系293T细胞为本实验室保存;质粒 pmir-RB-REPORTTM(广州锐博公司产品);hsa-miR-34a inhibitor、hsa-miR-34a inhibitor control均购自江苏百奥公司;双荧光素酶检测试剂盒(Dual-Luciferase Reporter Assay System)为Genecopoeia公司产品、T4 DNA连接酶、DNA提取试剂盒(Wizard Genomic DNA Purification Kit)均购自天根生化科技有限公司;限制性内切酶EcoRI和PstI、LA-Taq DNA 聚合酶、dNTP 购自 TaKaRa公司;PCR产物回收试剂盒(QIA quick GelExtraction Kit)、质粒提取试剂盒(E.Z.N.A Plasmid Mini Kit)购自OMEGA公司;lipofectamine2000购自Invitrogen公司;胎牛血清购自杭州四季青公司;DMEM培养基购自Gibico公司;PCR引物合成由广州锐博公司合成;测序由北京六合华大基因科技股份公司完成;荧光检测仪为Promega公司产品;感受态(DH5α)购自北京鼎国生物科技有限公司。
1.2 双荧光素酶报告载体的构建 从Entrez核酸数据库调取 NOTCH1基因3'-UTR段的碱基序列(NM-017617),采用 Primer Premier 5.0软件设计PCR引物,引物合成由广州锐博生物公司。引物序列 如 下:NOTCH1-F1648:5'CCG CTCGAG ACGGCGCGCCCCACGAGA 3';NOTCH1-R1648:5'GAAT GCGGCCGC TCACCATCAGTATCATTTTTATTGCAA ATC 3'加黑体分别为XhoⅠ,NotⅠ酶切位点序列,之前序列为保护碱基,引物扩增长度为1 648 bp。以HEK293T细胞基因组DNA为模板行PCR扩增,反应为30μl体系:5×PrimeSTAR Buffer 6μl;2.5 mmol/L dNTPmix 2μl;上下游引物(10 mmol/L)各1 μl;PrimeSTAR HSDNA 聚合酶(2.5 U/μl)0.3 μl,DNA模板 1μl(约100 ng);用灭菌水补足30μl。反应条件为(降落PCR):95℃预变性5分钟,98℃变性10秒,从65℃每个循环降1℃退火,72℃延伸100秒,共10个循环;在55℃退火,进行18个循环;72℃继续延伸7分钟,然后4℃ 保存。PCR反应完取2μl产物进行1%琼脂糖电泳分析。按照凝胶纯化试剂盒说明书进行纯化产物后,用Xhol、NotI对上述PCR产物和载体进行双酶切后,采用T4 DNA连接酶将线性化改良的双荧光素酶报告载体(pmir-RB-REPORTTM)与 NOTCH1 基因 3'-UTR 片段相连。反应体系是PCR产物与荧光素酶报告载体以3∶1比例混合。取连接反应产物100μl加入转化感受态DH5α,用PstI和EcoR I双酶切后用琼脂糖凝胶验证正确后,再将重组双荧光素酶报告载体送测序鉴定,此项工作北京六合华大基因科技股份有限公司完成。测序鉴定正确的重组载体命名为pmir-RBREPORTTM-NOTCH1-3'-UTR。
1.3 靶向NOTCH1基因3'-UTR的 miRNA 预测将NOTCH1作为检索词,放入在线Target Scan 5.1软件(http://www.targetscan.org)的检索框中进行检索,搜索可能与NOTCH1基因3'-UTR相互作用的miRNA。遵循生物信息学预测的规则,找出与NOTCH1基因的3'UTR不完全配对的miRNA。即在miRNA的第2位碱基以后,与其靶基因的种子序列成完全配对或不完全配对;并且比较其结合的自由能及在多物种是否有保守性。
1.4 细胞瞬时转染 HEK293T细胞用含10%胎牛血清的DMEM高糖培养液,于37℃、5%CO2条件下培养、传代。细胞瞬时转染采用Invitrogen公司的lipofectamine 2000转染试剂,具有操作方法遵循说明书进行。将HEK293T细胞以每孔4×104个接种于96孔培养板中,第二天,按实验分组将25 ul不含血清的DMEM高糖培养液与空质粒或重组质粒(0.2 μg)和 miR-34a inhibitor或 control inhibitor(20 umol/L)0.25μl加入EP管中混合5分钟;同法将lipofectamine2000 0.25 μl与 25 μl不含血清的DMEM培养基加入EP管中混合5分钟。然后将每组的质粒混合液与转染试剂混合液加入到EP管中,再次混合25分钟后加入96孔培养板中,混合均匀后,放入到培养箱中培养6小时后换用含10%血清的培养基。具体实验分组如下;①转染pmiR-RBREPORTTM;②共转染 pmiR-RB-REPORTTM及 control inhibitor;③共转染 pmiR-RB-REPORTTM及 miR-34a inhibitor;④ 转 染 pmiR-RB-REPORTTM-NOTCH1-3'-UTR 组;⑤共转染 pmiR-RB-REPORTTM-NOTCH1-3'-UTR 及 control inhibitor组;⑥共转染 pmiR-RB-REPORTTM-NOTCH1-3'-UTR 及 miR-34a inbibitor 组。转染24小时后收集细胞,检测荧光素酶活性。上述实验每组设3个平行孔,每组实验重复3次。
1.5 荧光素酶活性测定 按照Genecopoeia公司的双荧光素酶检测试剂盒提供的操作方法检测在HEK293T 细胞中 miR-34a 对 NOTCH1-3'-UTR 的荧光素酶活性的改变。用只含PBS的孔将荧光检测仪校准,吸去96孔板中的培养基,用PBS洗涤细胞后向每孔加入100μl的 Working Solution I,在避光均匀摇动10分钟,用Promega公司的Glomax 20/20 luminometer荧光检测仪检测。测量萤火虫荧光素酶活性(Rn),再加入100μl的 Working SolutionⅡ,测量海肾素荧光素酶活性(Ff)。以萤火虫荧光素酶活性/海肾素荧光素酶活性的值作为荧光素酶活性。以只转染pmiR-RB-REPORTTM载体(空载体)的HEK293T细胞作为对照,并将该组的荧光素酶活性值进行归一化,其他各组的荧光素酶活性为其相对值。
2 结果
2.1 NOTCH1基因3'-UTR双荧光素酶报告载体成功构建 我们使用PCR方法扩增得到了NOTCH1基因3'-UTR序列(图1),经琼脂糖电泳鉴定其长度为1 648 bp,这与核酸数据库中提供的长度一致。将该片段经PstI/EcoR I双酶切后插入线性化的pmir-RB-REPORTTM载体,然后转化感受态。随机挑取克隆扩增后提取质粒DNA,再用PstI和EcoRI双酶切鉴定,证实酶切后得到的1 648 bp的NOTCH1基因3'-UTR片段与预期大小相符(图2)。并将重组载体送北京六合华大基因科技股份公司进行测序,正向及反向测序图显示重组载体中的NOTCH1基因3'-UTR序列与PCR产物长度完全一致,也与GeneBank数据库上的所提供的NOTCH1基因的CDS序列相同,故将该报告重组载体命名为pmiRRB-REPORTTM-NOTCH1-3'-UTR。
2.2 生物学信息学预测结果 我们得到的预测结果显示:has-miR-449a、has-miR-449b、has-miR-34a、has-miR-34c-5p 均与 NOTCH1 基因 3'-UTR 存在互补结合位点。其中miR-34a从第二位碱基开始与NOTCH1基因的3'-UTR相互配对(图3);且两者结合的自由能为-22.1 kcal/mol;并且保守序列即“种子序列”在人、大鼠、小鼠、犬等物种有严格的保守性。这些均符合生物信息学预测靶基因的规则。

图1 NOTCH1基因3'非编码区聚合酶链扩增产物的琼脂糖电泳结果Fig.1 3'-UTR of NOTCH1 was amp lificated by PCR which was vertified by gel
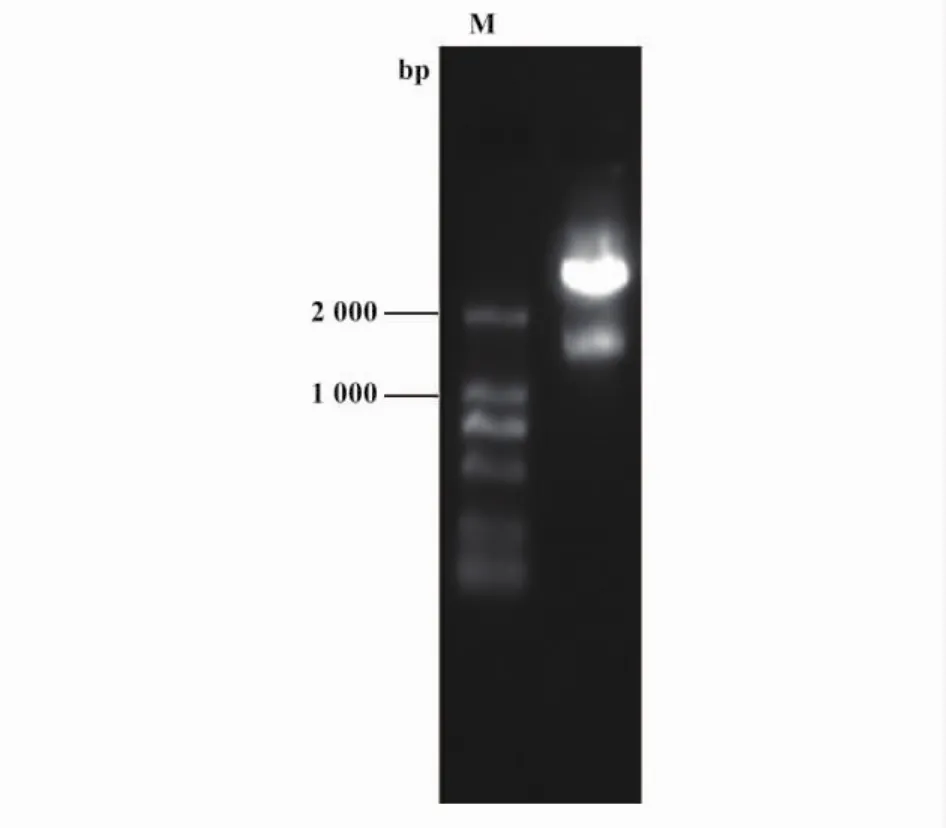
图2 为重组载体经酶切后琼脂糖电泳结果Fig.2 The recombinant vector was digested by enzymes

图3 m iR-34a与预测的NOTCH1 3'UTR结合位点的互补情况Fig.3 Comparison of base pairs between maturem iR-34a and Notch1 3'UTR bs

表1 各实验组中HEK293T细胞中荧光素酶表达的相对值Tab.1 Relative expression level of Luciferase activity of HEK 293T cells

图4 HEK 293T细胞中m iR-34a inhibitor对荧光素酶表达的影响Fig.4 Luciferase activity of various reporters in the presence or absence of m iR-34a inhibitor in HEK293T cells
2.3 miRNA对 NOTCH1基因的3'-UTR 调控 为从以上预测的miRNA结果中筛选出可能对NOTCH1基因3'-UTR有调控作用的miRNA。所有的数据均以±s表示,具体见表1。以荧光素酶结果显示:共转染 pmiR-RB-REPORT-NOTCH1-3'-UTR及micro-34a inhibitor的HEK293T细胞组荧光素酶值是只转染 pmiR-RB-REPORTTM的 HEK293T 细胞组荧光素酶值的145%;两组之间的差异有统计学意义(F=23.15,P <0.01),其余四组与 pmiR-RBREPORTTM的HEK293T细胞组之间的差异没有统计学意义(图4)。
3 讨论
1991年,NOTCH1在人类T淋巴母细胞白血病中首先被鉴定出来,提示了NOTCH信号通路与肿瘤发生有密切相关[7]。目前在脊椎动物中共发现了4个 NOTCH 同 源 体:即 NOTCH1、NOTCH2、NOTCH3、NOTCH4。其中NOTCH1不仅对正常细胞分化有重要作用,而且对一些肿瘤的发生、发展等生物 学 过 程 也 起 调 控 作 用[8,9]。 目 前 研 究 显 示NOTCH1有生物两面性:既可以作为癌基因起作用,又可以作为肿瘤抑制因子存在;NOTCH1在生物过程中具有生物种属特异性及时间特异性。临床研究表明结肠癌中NOTCH1的异常激活,则发挥着癌基因的作用;同时参与了结肠癌的发生、发展;通过抑制Notch1的表达可以起到化疗增敏、治疗肿瘤的作用[10]。在T淋巴母细胞白血病及神经母细胞瘤中NOTCH1也表现为过度表达,并与这两种疾病的预后不良有密切联系[11]。同时NOTCH1的变异可以导致动脉瓣膜疾病[12]。但NOTCH1在某些疾病则作为抑癌基因发挥重要的生物学功能,如宫颈癌,小细胞肺癌等[13,14]。总之,NOTCH1 异常表达均可导致下游信号持续激活,与患者预后有密切的联系。为了进一步研究NOTCH1在结肠癌的发生,发展中的作用及调节机制,我们首先构建含NOTCH1基因3'端非编码区的双荧光素酶报告质粒。
到目前为止,在人类基因组中已发现了近千个miRNA,其中绝大多数的生物学功能尚不完全清楚。目前研究表明:1个miRNA能够靶向多个mRNA,而多个miRNA也可作用于同1个mRNA[15];而且miRNA之间也可以相互作用调节。这些资料说明miRNA很可能作为一个调控网络中一份子发挥重要的生物学作用。不断积累的证据显示:miRNA与肿瘤的发生密切相关,有些miRNA的异常表达已被证实参与结直肠癌的发生与进展,如miR-143、miR-145的表达下调、miR-21的表达上调均与结直肠癌发生有密切关联[16-18]。如果能够筛选到参与调控NOTCH1表达的miRNA,并分析其在结直肠癌中的表达变化及其调控机制,我们就可以明确这些miRNA在生理和病理状态下参与结直肠癌发生和进展中所扮演的角色,从而无论是在明确结直肠癌的发病机理还是在开发潜在的治疗药物中都有重要价值。
目前判定miRNA是否与靶基因的3'-UTR结合主要通过双荧光素酶检测和免疫印迹两种方法联合运用[19-21]。本研究是将目的基因的3非编码区片段构建在经过改造的双荧光素酶报告载体上,即将海肾素荧光素酶基因和萤火虫荧光素酶基因构建在同一个载体上。这样就能明显减少了因微量加样及载体本身误差而引起的实验不准确[22,23],这是本研究为提高结果的准确性及可靠性所采取的改进措施。
在软件预测的基础上,我们仍需要通过实验的方法来验证生物信息学预测的是否准确[24]。我们利用miR-34a抑制剂及对照来验证miR-34a是否与NOTCH1基因的3'-UTR段结合从而对荧光素酶活性的有无影响。结果表明:miR-34a抑制剂对NOTCH1基因3'-UTR荧光素酶报告载体的活性有增强作用,这一作用很可能是由于 miRNA-34a与NOTCH1基因3'-UTR的作用而产生,当然这还有待于进一步检测miRNA-34a对其结合位点突变的NOTCH1基因3'-UTR荧光素酶报告载体活性的影响以及对NOTCH1蛋白水平的调控加以最终验证。
综上所述,本研究成功构建的NOTCH1基因3'-UTR的荧光素酶报告载体,同时初步证明NOTCH1的3'-UTR 与 miR-34a有结合位点,为进一步发掘调控NOTCH1基因表达的miRNA提供了实验基础。
1 Dake Chu,Weizhong Wan.Notch1 expression in colorectal carcinoma determines tumor differentiation status[J].Gastrointest Surg,2009;13(2):253-260.
2 Andrew P,Weng John M etal.c-Myc is an important direct target of Notch1 in T-cell acute lymphoblastic leukemia/lymphoma[J].Genes Dev,2006;20(1):2096-2109.
3 George Adrian Calin,Cinzia Sevignani.Human microRNA genes are frequently located at fragile sites and genomic regions involved in cancers[J].PNAS,2004;101(2):(9)2999-3004.
4 J.P,Hagan C.M.Croce MicroRNAs in carcinogenesis[J].Cytogenet Genome Res,2007;118:252-259.
5 Helen M,Heneghan,Nicola Miller.MiRNAsasbiomarkersand therapeutic targets in cancer[J].Current Opinion in Pharmacology,2010;10(21):543-550.
6 Esquela-Kerscher,Frank J,Slac k Auror.Oncomirs-microRNAs with a role in cancer[J].Nature Reviews,2006;4(5):259-269.
7 Yasuhiro Funahashi,Sonia L.A Notch1 ectodomain construct Inhibits endothelial Notch signaling,tumor growth,and angiogenesis[J].Cancer Res,2008;68(1):4727-4735.
8 Lucio Miele.Notch signaling[J].Clin Cancer Res,2006;12(7):1074-1079.
9 Maria Maddalena Lino1,Adrian Merlo.Notch signaling in glioblastoma:a developmental drug target[J].BMCMedicine,2010;8(2):72-81.
10 Meng D R,Christopher C.γ-secretase inhibitors abrogate Oxaliplatin-induced activation of the Notch-1 signaling pathway in colon cancer cells resulting in enhanced chemosensitivity[J].Cancer Res,2009;69(2);573-582.
11 Komeno Y,Kitaura J,Watanabe-Okochi N et al.AID-induced T-lymphoma or B-leukemia/lymphoma in a mouse BMT model[J].Leukemia,2010;24(5);1018-1024.
12 Vidu Garg,Muth A N.Mutations in NOTCH1 cause aortic valve disease[J].Nature,2010;437(2):270-274.
13 Monideepa Roy1,Pear W S.The multifaceted role of Notch in cancer[J] .Current Opinion in Genetics & Development,2007;17(11):52-59.
14 Koch U,Radtke F.Notch and cancer:a double-edged sword[J].Cell Mol Life,2007;5(64):2746-2762.
15 William C SCho.OncomiRs:the discovery and progress ofmicroRNAs in cancers[J].Molecular Cancer,2007;6(2):60-67.
16 Slaby O,Svoboda M.Altered expression ofmiR-21,miR-31,miR-143 andmiR-145 is related to clinicopathologic features of colorectal cancer[J].Oncology,2007;72(1):397-402.
17 Bandrés E,Cubedo E.Identification by Real-time PCR of 13 maturemicroRNAs differentially expressed in colorectal cancer and nontumoral tissues[J].Molecular Cancer,2006;5(3):29-38.
18 Asangani1 IA,Rasheed SA K.MicroRNA-21(miR-21)post-transcriptionally downregulates tumor suppressor Pdcd4 and stimulates invasion,intravasation and metastasis in colorectal cancer[J].Oncogene,2008;4(27);2128-2136.
19 Paguio A,Stecha P,Wood K V et al.Improved dual-luciferase reporter assays for nuclear receptors[J].Curr Chem Genomics,2010;4(1);43-49.
20 Li S,Li Z,Guo F et al.miR-223 regulatesmigration and invasion by targeting Artemin in human esophageal carcinoma[J].Biomed Sci,2011;18(2);24-31.
21 Araujo P R,Burle-Caldas G A,Silva-Pereira R A et al.Development of a dual reporter system to identify regulatory cis-acting elements in untranslated regions of Trypanosoma cruzi mRNAs[J].Parasitol Int,2011;60(2):161-169.
22 Xie Y,Rosser JM,Thompson T L et al.Characterization of L1 retrotransposition with high-throughput dual-luciferase assays[J].Nucleic Acids Res,2011;39(3):e16-e20.
23 Kim SK,Kim JY,Choi Y S etal.A dual-reporter system for specific tracing of pancreatic cell lines thatnon-invasivelymeasures viable in vivo islet cells[J].Biotechnol Lett,2010;32(1):53-57.
24 Ulf Andersson Ørom,Anders H,Lund.Experimental identification ofmicroRNA targets[J].Gene,2010;15(451):1-5.
25 Dang Hung Tran,Kenji Satou.Computational discovery ofmiR-TF regulatorymodules in human genome[J].Bioinformation,2010;4(8):371-377.

