过表达apoA-I对小鼠非酒精性脂肪性肝炎作用的研究
刘 伟 马东林 刘文文 俞 豪 王宇童
(首都医科大学基础医学院细胞生物学系,肝脏保护与再生调节北京市重点实验室,北京 100069)
非酒精性脂肪性肝病(non-alcoholic fatty liver disease,NAFLD)是以无过量饮酒史病人的肝细胞发 生 脂 肪 性 变 为 病 理 特 征 的 临 床 综 合 症[1,2]。NALFD的临床症状主要有脂肪变性、肝小叶出现不同程度的炎症、气球样变及纤维化,非酒精性脂肪性肝炎(non-alcoholic steatohepatitis,NASH)是其中的一种病理分型。NASH是单纯性脂肪肝向肝纤维化、肝硬化进展的重要中间环节[3]。据报道NAFLD在发达国家的发病率成人约为30%,儿童约为13%。而在肥胖或糖尿病患者中发病率约为80%。大约10%的NALFD病人会发展为NASH,而这些NASH病人中约有20%在10年内会发展成为肝硬化[4]。由此可见,NASH已成为目前备受重视的临床综合症之一。NASH的发病机制暂不明确,目前国际上比较公认的机制为“二次打击学说”。所谓的“第一次打击”是指游离脂肪酸(free fatty acid,FFA)和甘油三酯(triglyceride,TG)在肝细胞内大量蓄积,使肝细胞发生脂肪性变,影响细胞的生理和生化功能。这种“第一次打击”几乎在所有代谢综合征患者中出现[5]。变性的肝细胞在受到外界的刺激,例如氧化应激、细胞因子刺激等,很容易引发细胞凋亡和坏死。这些外界刺激所造成的肝细胞损伤统称为“二次打击”[6]。研究结果表明,沉积在细胞内的FFA主要集中在线粒体、微粒体和过氧化酶体等细胞器,它们不仅作为“第一次打击”使肝细胞发生脂肪变性,而且在它们发生过氧化反应时,产生的超氧离子及自由基会对肝细胞造成“第二次打击”[7]。
众所周知,胆固醇(cholesterol,Chol)和磷脂等脂质的转运过程主要在肝脏完成。而在经典的胆固醇逆向转运过程中,载脂蛋白A-1(apolipoprotein A-I,apoA-I)起到非常重要的作用。apoA-I是由243个氨基酸编码而成的蛋白质,在肝细胞合成,分泌到肝细胞外[8],而 ATP 结合盒转运子 (ATP-binding cassette transporter A1,ABCA1)则负责将肝细胞内的胆固醇和磷脂接到转运到乏脂的apoAI上。这些部分脂质化的apoA-I可以在外周细胞中接收更多通过ABCA1转运的胆固醇和磷脂,形成高密度脂蛋白(HDL),并回到肝脏,经过进一步加工代谢,最终以胆汁的方式排出体外[9]。国内外对于apoA-I的研究主要是在动脉粥样硬化中。例如最近的研究表明,apoA-I的糖基化与二型糖尿病人的动脉斑块进展有关[10]。但是在NASH的领域中,apoA-I的研究却处于空白。越来越多的证据表明,二型糖尿病患者所伴随高血糖和脂质代谢失调是引发NASH的重要原因[11];无论是一型糖尿病患者还是二型糖尿病患者,他们体内的FFA都会增高,并且二型糖尿病患者在代谢失调的另一个危险因素是HDL降低[12]。这些均提示FFA有可能直接参与胆固醇逆转运过程,从而影响糖尿病病人血脂水平,也有可能在NASH过程中,对于FFA也起到类似的作用。所以研究FFA,apoA-I及NASH之间的关系就有着非常重大的意义。
研究apoA-I在 NASH 中的治疗作用,选择NASH动物模型很重要。目前的动物模型主要为三种:①基因敲除或基因突变模型;②营养、药物或毒物诱发模型;③复合模型(联合应用基因模型和营养模型)[13]。由于很少的NASH病人是遗传基因缺陷的先天原因造成,因此饮食引起的NASH动物模型和人类的NASH有很大的相关性。饮食造成的NASH动物模型也有很多,各自都有优缺点:如普通高脂饲料主要的病理特征和NASH病人很相似,但是饲养周期长[14];蛋氨酸胆碱缺乏饮食(methionine and choline-deficient,MCD)饲养周期短,造模快,但是动物往往无肥胖,高胆固醇以及胰岛素抵抗等并发症[15]。由此可见,MCD可作为研究NASH的良好模型。本研究旨在探索在MCD构建的NASH小鼠模型中过量表达apoA-I对于肝细胞内脂质堆积的影响。
材料和方法
1.材料
小鼠抗甘油醛-3-磷酸脱氢酶(glyceraldehyde-3-phosphatedehydrogenase,GAPDH)抗体(上海康辰生物有限公司);小鼠抗apoA-I抗体(Cell Signaling Technology公司,美国);辣根过氧化物酶标记羊抗小鼠IgG(北京中杉金桥生物技术有限公司);Western blotting超敏化学发光液、游离脂肪酸超敏测定试剂盒、组织细胞总胆固醇酶法测定试剂盒、三酰甘油测定试剂盒(北京蒂诺奥基因技术有限公司);对照腺病毒 (ad-Null)、apoA-I腺病毒(adapoA-I)购于北京诺赛基因组研究中心有限公司;6-8周龄C57/BL6雄性小鼠,体重20-25g(军事医学科学院动物部);MCD饲料参考国外文献配方[16]并由北京华阜康有限公司制作;其他试剂均为国产分析纯。
2.模型制备及分组
20只C57/BL6雄性小鼠饲喂普通饲料适应性饲养1周后随机分成正常饲料组对照组(control)、MCD饲料组(MCD)、MCD+对照腺病毒组(MCD+Null)和 MCD+apoA-I腺病毒组(MCD+apoAI)4组,每组5只。MCD+Null组小鼠以1×108PU/只的剂量通过股静脉注射ad-Null,MCD+apoA-I以1×108PU/只的剂量通过股静脉注射腺病毒ad-apoA-I,注射病毒24h后,饲喂 MCD饲料。实验动物自由摄食、饮水。
3.取材
两周实验结束,小鼠禁食水12h后,称重;4%水合氯醛麻醉;下腔静脉取血,分离血清。-80℃保存;肝脏称重后部分液氮冻存,部分4%多聚甲醛固定。
4.指标检测
4.1 一般情况
观察各组小鼠行为活动、形体状态、毛发,饮食及死亡情况,称取体重和肝脏湿重,计算肝脏指数〔肝指数(%)=肝脏重量(g)/体重(g)×100%〕。
4.2 肝组织病理学检测
取小鼠肝组织制作冰冻切片,进行油红O染色;同时制作肝组织石蜡切片,进行H&E染色。在光镜下分别观察油红O染色切片机H&E染色切片,并对肝脏脂肪变性和炎症情况进行评估。病理学诊断采用由美国国立卫生研究院NASH临床研究网络病理委员会2005年所定的指南[17],根据其制定的NAFLD活动度积分(NAFLD Activity Score,NAS)进行评估。NAS组织学评分系统对14项病理改变,3项指标进行了半定量评估计分:肝脂肪变(按发生脂肪变性实质细胞/总细胞数,<5%、5%-33%、33%-66%、>66%,分别计0-3分)、小叶内炎症(按无病灶、<2、2-4、>4,分别计0-3分)、肝细胞气球样变(按无、少量气球样细胞、较多/显著气球样变,分别计0-2分),其中NAS≥5分者可明确NASH的诊断,NAS<3分则可排除NASH,两者之间者为NASH可能。油红O及H&E切片使用Leica摄像系统进行观察和摄片。
4.3 血清学检测
通过下腔静脉取血获取血清,保存于-80℃冰箱中。采用全自动生化分析仪测定血清谷丙转氨酶(alanine aminotransferase,ALT),谷草转氨酶(aspartate aminotransferase,AST),TG和Chol。
4.4 肝组织TG,FFA,Chol含量测定
精确称取0.5mg肝组织,按照三酰甘油酶法测定试剂盒、游离脂肪酸超敏测定试剂盒以及组织总胆固醇酶法测定试剂盒说明书中针对组织提取脂质的方法研磨萃取脂质,随后按照说明书操作,得到相应的OD值,依标准曲线,分别得到组织内三酰甘油、游离脂肪酸以及总胆固醇的浓度,结果以mmol/L表示。
5.Western blot
取0.5mg肝组织,用RIPA裂解液裂解提取总蛋白,用BCA定量法测定样品浓度。取适量样品进行SDS-PAGE。样品在浓缩胶恒压80V电泳,进入分离胶后电压调制120V,电泳1h。电泳后将胶中的蛋白转移至PVDF膜上,通过Bio Rad mini-ProteinⅡ电转系统(美国Bio Rad公司)进行湿转,转后PVDF膜经5%脱脂奶粉在室温封闭1h,而后加入相应稀释的一抗,4℃孵育过夜。TBST缓冲液洗膜3次,每次10min,稀释后的二抗(1∶5000)室温孵育1h,TBST缓冲液洗膜3次,每次10min,于暗室内化学发光液孵育后对X光片曝光。
6.统计学分析
采用SPSS13.0软件分析,组间比较采用单因素方差分析;以P<0.05为差异有统计学意义。
结 果
1.构建的ad-apoA-I腺病毒在肝脏中过量表达apoA-I蛋白
注射ad-Null腺病毒或ad-apoA-I腺病毒2w后提取小鼠肝组织蛋白进行apoA-I蛋白 Western blot检测显示,与注射ad-Null腺病毒的小鼠肝脏组织比较,在注射ad-apoA-I腺病毒的小鼠肝脏中可apoA-I蛋白表达水平明显增高(图1)。
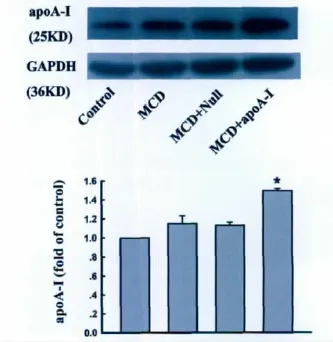
图1 ad-apoA-I腺病毒注射对小鼠肝内apoA-I蛋白质水平影响的 Western blot检测.*P<0.05Fig.1 Western blot detection of effect of ad-apoA-I virus injection on apoA-I level in the MCD diet-mouse liver.*P<0.05
2.过表达apoA-I减轻由MCD饲喂所引起的小鼠体重下降及小鼠肝脏指数下降
饲养过程中各组小鼠均无死亡,对照组小鼠体毛整齐有光泽,体重正常,且稳步增长,活动度正常,精神良好,进食正常,垫料干燥。与对照组相比,MCD组及MCD+Null组小鼠的体毛凌乱、无光泽,体重减轻,活动减弱,精神萎靡,进食量明显下降,进水量上升,垫料潮湿;而MCD+apoA-I组小鼠体活动度尚可,精神较好,进食量无明显下降,进水量微有上升,垫料稍微潮湿。比较各组小鼠体重、肝湿重和肝脏指数可以看出,MCD组比对照组小鼠体重下降明显,而 MCD+apoA-I组体重明显大于 MCD组及MCD+Null组(图2A);MCD组小鼠肝湿重较对照组明显下降,MCD+apoA-I组肝湿重较MCD组和MCD+Null组明显增加(图2B);MCD组肝脏指数较对照组显著下降,MCD+apoA-I组肝脏指数较MCD组和MCD+Null组明显增加(图2C)。
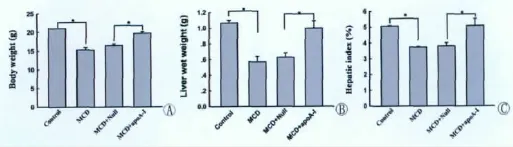
图2 每组小鼠的体重、肝湿重和肝脏指数比较。A,体重;B,肝湿重;C,肝脏指数。*P<0.05。Fig.2 Comparision of body weight,liver wet weight and hepatic index of mice in each group.A,body weight;B,liver wet weight;C,hepatic index.*P<0.05.
3.过表达apoA-I改善由MCD饲喂所引起的小鼠肝脏病理学变化
H&E染色显示,对照组小鼠肝组织肝窦清晰可见,肝索排列整齐,形态结构均正常(图3Aa);MCD组小鼠及MCD+Null组肝细胞内充满大量大小不一的脂肪空泡,肝细胞结构紊乱呈气球样变,多数细胞脂肪化发生,肝小叶内多淋巴结细胞浸润(图3Ab和图3Ac);MCD+apoA-I组小鼠肝组织部分肝细胞内存在脂肪空泡,与MCD组比较脂肪空泡明显减少,少部分区域出现肝索结构紊乱,偶见炎性细胞浸润(图3Ad)。
油红O染色显示,对照组小鼠肝组织未见红色脂滴(图3Ae);MCD组及MCD+Null组小鼠肝组织可见大量红色脂滴,部分融合成片,表现为脂滴弥漫浸润入肝细胞中,肝小叶内含脂滴细胞数/总细胞数约为45-60%(图3Af和图3Ag);MCD+apoA-I组小鼠肝组织可见局部散在红色脂滴,成小颗粒状,肝小叶内含脂滴细胞数/总细胞数约为0-10%(图3Ah)。
肝组织病理评分显示,MCD组肝组织评分较对照组显著升高,总分>5分,符合NASH组织学诊断,表明模型复制成功;MCD+Null组病理评分略低于MCD组,而MCD+apoA-I组显著低于 MCD+Null组(图3B)。
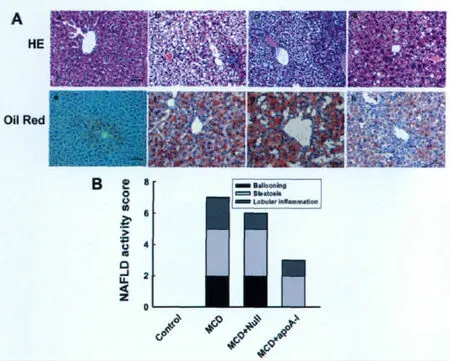
图3 过表达apoA-I对由MCD饲喂所引起的小鼠肝脏病理损害的影响。A,肝脏病理学的H&E染色(HE)和油红O染色(Oil Red);a和e,对照组;b和f,MCD组;c和g,MCD+Null组;d和h,MCD+apoA-I组;B,病理评分分析。Fig.3 Effect of apoA-I overexpression on pathological impairment in MCD diet-mouse liver.A,H&E and Oil Red O staining of mouse liver pathology;a and e,control group;b and f,MCD group;c and g,MCD+Null group;d and h,MCD+apoA-I group;B,Histogram of pathological score of liver.
4.过表达apoA-I抑制由MCD饲喂所引起的血清ALT、AST浓度升高和Chol、TG浓度降低
ALT、AST是反应肝脏功能的重要指标,apoAI作为一种载脂蛋白,对肝脏脂质变化具有重要影响,于是,我们检测了血清中的ALT、AST、TG和Chol水平。结果显示,血清ALT和AST浓度在MCD组和 MCD+Null组较对照组显著上升,在MCD+apoA-I组较对照组略有升高,但明显低于MCD组和 MCD+Null组(图4A和图4B);血清TG和Chol浓度在MCD组和MCD+Null组较对照组显著降低,在 MCD+apoA-I组较 MCD组和MCD+Null组明显升高(图4C和图4D)。
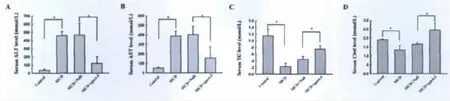
图4 过表达apoA-I对由MCD饲喂所引起的血清ALT、AST、Chol和TG水平改变的影响。*P<0.05。Fig.4 Effect of apoA-I overexpression on the change of serum level of ALT,AST,Chol and TG in MCD diet-mouse.*P<0.05.
5.过表达apoA-I抑制由MCD饲喂所引起的肝组织TG、Chol、FFA堆积
对小鼠肝组织中脂质存留量的检测显示,饲喂MCD饲料后,MCD组小鼠肝组织中的TG、Chol及FFA的含量相对于对照组均有不同程度的升高,而过表达apoA-I小鼠肝组织中的TG、Chol及FFA的含量相对于MCD+Null组有显著降低(图5)。
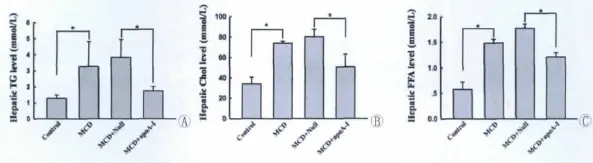
图5 过表达apoA-I对由MCD饲喂所引起的肝组织TG、Chol、FFA堆积的影响。*P<0.05。Fig.5 Effect of apoA-I overexpression on accumulation of TG,Chol and FFA in MCD diet-mouse liver.*P<0.05.
讨 论
MCD饲料饲喂诱导的动物模型是国际上公认的研究NAFLD中炎症及纤维化的最好的动物模型之一[15]。MCD饲喂小鼠后,小鼠肝组织会发生进展性脂肪性病变,并进一步发展为纤维化,并伴有无胰岛素抵抗,无肥胖,无血脂异常,血清学TG水平降低,体重下降明显,肝重及肝指数下降[18]。本实验获得数据中,MCD组小鼠体重、肝重及肝指数均下降,与该模型的描述相符。H&E染色及油红O染色中获得的病理评分及血清学ALT、AST水平进一步说明本实验成功复制了MCD饲料饲喂的小鼠NASH模型。
我们的实验表明,apoA-I腺病毒载体注入小鼠体内后,可以稳定持续地表达目的蛋白。由H&E和油红O结果可以看出,过表达apoA-I可以有效地抑制脂质在肝脏中的沉积,从而减轻肝脏的病变,ALT和AST均有不同程度的降低,这证明apoA-I对小鼠肝脏功能具有一定的保护作用。apoA-I可以降低肝脏组织中TG,Chol及FFA的含量,与此同时,血清中TG与Chol的含量有所升高。由此表明,apoA-I可以通过将肝细胞内的过量脂质转运出肝脏,进入血清中,从而减少肝脏内的过量脂质沉积,降低脂质对肝细胞的“第一次打击”,这也从根源上减缓了NASH的进程,起到有效的治疗作用。在肝细胞的脂质堆积中,危害作用最大的是高浓度的FFA。长期高脂饮食使FFA摄入增加、胰岛素抵抗增加、肝细胞线粒体脂肪酸β氧化减少,以上因素都会造成肝脏和血清中FFA增加。FFA与NASH的发生发展有重要关系,与疾病的严重程度呈负相关[19,20]。而抑制FFA能够提高肝细胞对胰岛素的敏感性,降低肝生化酶活性[19,21]。所 以 apoA-I可以通过其降低FFA浓度的作用,有效地预防和改善NASH。
综上所述,apoA-I在小鼠体内稳定表达后,可以通过将肝细胞内的脂质转运出肝脏,进入血清,从而减少脂质在肝细胞内的蓄积,减少脂质氧化反应原料,降低氧化应激反应,最终对NASH起到防治的作用。而在此过程中,apoA-I是否对于脂质代谢中的酶(如抗氧化酶SOD、GSH-PX等)具有调节作用,仍有待进一步研究。
[1]Marchesini G,Bugianesi E,Forlani G,et al.Nonalcoholic fatty liver,steatohepatitis,and the metabolic syndrome.Hepatology,2003,37(4):917-923
[2]Kashi MR,Torres DM,Harrison SA.Current and emerging therapies in nonalcoholic fattyliver disease.Semin Liver Dis,2008,28(4):396-406
[3]Farrell GC,Larter CZ.Nonalcoholic fatty liver disease:from steatosis to cirrhosis.Hepatology,2006,43(2Suppl 1):S99-S112
[4]Cave M,Deaciuc I,Mendez C,et al.Nonalcoholic fatty liver disease:predisposing factors and the role of nutrition.J Nutr Biochem,2007,18(3):184-195
[5]Marra F.NASH:are genes blowing the hits?J Hepatol,2004,40(5):853-856
[6]Romics L Jr,Kodys K,Dolganiuc A,et al.Diverse regulation of NF-κB and peroxisome proliferation-activated receptors in murine nonalcoholic fatty liver.Hepatology,2004,2(40):376-384
[7]Seki S,Kitada T,Yamada T,et al.In situ detection of lipid peroxidation and oxidative DNA damage in non-alcoholic fatty liver diseases.Hepatology,2002,37(1):56-62
[8]Nicholls SJ,Gordon A,Johannson J,et al.ApoA-I induction as a potential cardioprotective strategy:rationale for the SUSTAIN and ASSURE studies.Cardiovasc Drugs Ther,2012,26(2):181-187
[9]Sorci-Thomas MG,Thomas MJ.High density lipoprotein biogenesis,cholesterol efflux,and immune cell function.Arterioscler Thromb Vasc Biol,2012,11(32):2561-2565
[10]Pu LJ,Lu L,Zhang RY,et al.Glycation of apoprotein A-I is associated with coronary artery plaque progression in type 2diabetic patients.Diabetes Care,2012,Dec.10(Epub ahead of print)
[11]Hayden JM,Reaven PD.Cardiovascular disease in diabetes mellitus type 2:apotential role for novel cardiovascular risk factors.Curr Opin Lipidol,2000,11(5):519-528
[12]Sartippour MR,Renier G.Up-regulation of macrophage lipoprotein lipase in patients with type 2diabetes:role of peripheral factors.Diabetes,2000,49(4):597-602
[13]London RM,George J.Pathogenesis of NASH:animal models.Clin Liver Dis,2007,11(1):55-74
[14]Adams LA,Angulo P.Treatment of non-alcoholic fatty liver disease.Postgrad Med J,2006,82(967):315-322
[15]Anstee QM,Goldin RD.Mouse models in non-alcoholic fatty liver disease and steatohepatitis research.Int J Exp Pathol,2006,87(1):1-16
[16]Lee GS,Yan JS,Ng RK,et al.Polyunsanturated fat in the methinine-choline-deficient diet influences hepatic inflammation but not hepatocellular injury.J Lipid Res,2007,48(8):1885-1896
[17]Kleiner DE,Brunt EM,Van Natta M,et al.Design and validation of a histological scoring system for nonalcoholic fatty liver disease.Hepatology,2005,41(6):1313-1321
[18]Tiniakos DG,Vos MB,Brunt EM.Nonalcoholic fatty liver disease:pathology and pathogenesis.Annu Rev Pathol,2010,5:145-171
[19]Kass CE.Mitochondrial involvement in drug-induced hepatic injury.Chem Biol Interact,2006,163(1-2):145-159
[20]Toye AA,Lippiat JD,Proks P,et al.A genetic and physiological study of impaired glucose homeostasis control in C57BL/6Jmice.Diabetologia,2005,48(4):675-686
[21]Schattenberg JM,Wang Y,Singh R,et al.Hepatocyte CYP2E1overexpression and steatohepatitis lead to impaired hepatic insulin signaling.J Biol Chem,2005,280(11):9887-9894

