缺血预处理对兔脊髓缺血再灌注损伤水通道蛋白-4表达的影响
方 波 赵 曦 王 赫 孙学军 马 虹
(中国医科大学附属第一医院麻醉科,沈阳 110001)
胸腹主动脉手术通常需要阻断主动脉,造成脊髓缺血再灌注损伤,引起截瘫[1]。尽管人们已做了大量研究来防治脊髓缺血,但至今仍未取得令人满意的效果。如何提高脊髓自身的抗损伤能力引起了国内外有关学者的关注。缺血预处理(Ischemic precondi-tioning,IPC)是通过短暂缺血使该组织耐受随后长时间缺血的现象。研究表明IPC能够有效的保护缺血脊髓[2,3]。迄今为止,IPC治疗脊髓缺血再灌注损伤的机制研究集中在热休克蛋白合成[1],腺苷[4]和牛磺酸释放[5],增加局部血流[6],激活神经营养因子[7]及抗凋亡[3]等方面。组织水肿是脊髓缺血再灌注损伤的主要继发性病理改变。水通道蛋白-4(apuaporin-4,AQP-4)主要分布在中枢神经系统[8],在脑和脊髓的许多生理及病理过程中发挥重要作用[9]。本研究拟探讨IPC对兔脊髓缺血再灌注损伤后AQP-4表达的影响,阐明其脊髓保护的机制。
材料和方法
1.动物选择及分组
成年日本大耳白兔72只,由中国医科大学实验动物中心提供,体重1.8-2.6kg。采用随机数字表法,随机分为3组(n=24):假手术组(S组)、脊髓缺血再灌注组(I/R组)和缺血预处理组(IPC组),每组设两个观察时点,分别是损伤后4h和24h。S组打开腹腔暴露游离肾下腹主动脉,但不阻断;I/R组阻断腹主动脉30min造成脊髓缺血再灌注损伤;IPC组短暂阻断腹主动脉5min,灌注10min,再阻断5min,灌注25min实施预处理,之后阻断腹主动脉30min造成缺血再灌注损伤。
2.脊髓缺血再灌注模型的建立
兔耳缘静脉注射20%乌拉坦(1g/kg)麻醉,保留自主呼吸。耳缘中动脉置管测量近端动脉血压,股动脉置管测量远端血压。直肠内置入温度传感器,持续监测体温,应用电热毯维持核心温度38℃左右。腹部皮肤剪毛后消毒,取腹正中切口,沿腹白线0.25%布比卡因局部浸润,剪开腹壁肌肉,暴露左肾及腹主动脉,用组织钳钝性分离左肾下腹主动脉。全身肝素化(200U/kg)后,肾动脉下1cm处用无损伤动脉夹阻断腹主动脉30min,以远端平均动脉压(MAP)低于20mmHg为完全阻断的标准。之后撤动脉夹开放腹主动脉,造成脊髓缺血再灌注损伤。之后丝线缝合,回笼饲养。
3.神经运动功能评价
以改良的Tarlov评分标准对下肢运动功能进行评价。评分标准:0分,没有可觉察的下肢活动;1分,有可觉察的关节自主活动;2分,后肢可自由活动但无法站立;3分,可站立但无法行走;4分,后肢功能完全恢复,能正常行走。
4.脊髓水肿测定
采用干湿法测定脊髓含水量,评价脊髓水肿。分别取新鲜脊髓缺血节段(L4-6)标本用滤纸吸除表面水分后,置于电子天平称取湿重 (W),再经110℃恒温烤箱烘烤24h后称取干重(D)。应用公式:脊髓含水量 (%)= (W-D)/W×100,计算脊髓含水量。
5.脊髓组织AQP-4表达的测定
取脊髓缺血节段,以10%甲醛溶液固定,石蜡包埋,切片。每个标本随机选取12张切片,进行免疫组化检测。一抗为兔抗AQP-4多克隆抗体,由北京博奥森生物技术有限公司提供。Olympus光学显微镜下观察染色积分光密度(integrated optical density,IOD),取均值为该样本脊髓的 AQP-4染色IOD。
6.统计学处理
采用SPSS 13.0统计学软件进行分析,数据以±s表示,统计学处理采用单因素方差分析,P<0.05为差异有统计学意义。
结 果
1.神经运动功能评分
动物均于术后2h内苏醒,各组分别于脊髓缺血再灌注损伤后4h和24h按照Talov评分进行评估。与S组相比,I/R组和IPC组损伤后4h和24h Talov评分组均明显降低(P<0.01),与I/R组相比IPC组损伤后4h和24hTalov评分均增高(P<0.01),见图1。
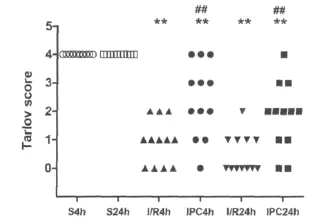
图1 各组脊髓缺血再灌注损伤后4h、24h神经运动功能评分(n=12)Fig.1 Tarlov score at 4hand 24hafter spinal ischemiareperfusion injury(±s,n=12)*P<0.01vs S group,#P<0.01vs I/R group
2.脊髓含水量
脊髓缺血再灌注损伤后4h脊髓含水量即有明显增加(P<0.01),24h增加更多(P<0.01);与I/R组相比,IPC组损伤后4h和24h脊髓含水量均明显减少(P<0.05),见表1。
表1 各组脊髓缺血再灌注损伤后4h、24h脊髓组织含水量(n=6,±s)Table1 Spinal water content at 4hand 24hafter spinal ischemia-reperfusion injury(n=6,±s)

表1 各组脊髓缺血再灌注损伤后4h、24h脊髓组织含水量(n=6,±s)Table1 Spinal water content at 4hand 24hafter spinal ischemia-reperfusion injury(n=6,±s)
*P<0.05,**P<0.01vs S group,##P<0.01vs I/R group
S I/R IPC 4h61.84±1.52 68.95±1.84** 64.15±1.59*##24h61.65±1.13 75.12±2.47** 67.92±1.76**##
3.脊髓组织中AQP-4表达
AQP-4主要分布在毛细血管周围的星型胶质细胞膜表面及终足上,还见于软脊膜细胞,脊髓中央管的室管膜细胞表面。脊髓损伤后4hAQP-4IOD较假手术组显著增加(P<0.05),24h增加更显著(P<0.01);与I/R组相比,IPC组损伤后4h和24h AQP-4IOD明显减少(P<0.01),见图2。

图2 各组脊髓缺血再灌注损伤后脊髓组织AQP-4表达(n=6,±s)。(A)脊髓组织AQP-4免疫组化染色。a:S组(×100);b:S组(×200);c:I/R组24h(×100);d:I/R组24h(×200);e:IPC组24h(×100);f:IPC组24h(×200);g:S组全景分布(×25)。(B)AQP-4染色IOD值。Fig.2 AQP-4expression at 4hand 24hafter spinal ischemia-reperfusion injury(n=6,±s).(A)Representative immunostaining of AQP-4in spinal cords.a:S group(×100);b:S group(×200);c:I/R 24h(×100);d:I/R 24h(×200);e:IPC 24h(×100);f:IPC 24h(×200);g:distribution of overall view in S group(×25).(B)Quantitative analysis of AQP-4IOD.
讨 论
脊髓缺血再灌注损伤是去除导致脊髓缺血的因素后,脊髓恢复血供,但神经功能不仅没有改善,反而在原来缺血损伤的基础上进一步加重,甚至出现不可逆性脊髓神经元迟发性死亡的现象[10]。缺血/再灌注损伤机制十分复杂,虽然有些药物或处理措施对实验动物有效,但能成功应用于临床的仍然很少。自从IPC应用于心肌保护,很多学者致力于研究IPC在中枢神经系统中的保护作用。IPC包括早期预处理和延迟预处理两种保护作用。早期IPC是在短暂缺血后几分钟至几小时内提高缺血耐受性,而延迟IPC则是在短暂缺血后一天或几天发挥有益的作用。本研究发现IPC在脊髓缺血再灌注损伤后4h和24h抑制AQP-4表达,减轻脊髓水肿,并改善神经功能,可能是分别通过早期保护和延迟保护的作用机制。
水通道蛋白(apuaporins,AQPs)是近十余年来发现的一组膜通道蛋白,广泛存在于各种生物的细胞膜上,介导水分子的跨膜转运,调节血脑屏障对水分子、K+的通透和神经细胞外间隙的大小。其中,AQP-4在中枢神经系统损伤后血脑屏障的破坏和组织水肿的形成过程中起重要作用,而它的缺失可减轻水中毒和局部缺血所引起的水肿症状[11]。研究表明各种大脑损伤都导致损伤区胶质细胞AQP-4mRNA的高表达,加重损伤区及其周围部位水肿[12],而 AQP-4表达的下调可在渗透压梯度和静水压促进水进入脑实质时降低血脑屏障对水的通透性,防止脑水肿的发生[13,14]。研究发现脊髓损伤后1dAQP-4及其mRNA表达开始增加,脊髓损伤后3d达高峰,相应的水肿形成[15],因此推断AQP-4表达增加可能是促使脊髓组织水肿发生的重要因素之一。但也有研究持相反的观点,Joshi等[16]认为脊髓损伤时血管性水肿是过多的水分可能通过受损的血脊髓屏障进入细胞外间隙,而不依赖AQP-4。本研究采取经典的阻断腹主动脉的方法制备脊髓缺血再灌注损伤模型,结果表明脊髓缺血再灌注损伤后AQP-4表达增加,脊髓出现水肿,神经功能降低,相比之下IPC组AQP-4表达增加受到抑制,脊髓水肿减轻,神经功能改善。其他的研究[17-19]同样发现应用骨髓间充质干细胞和嗅鞘细胞移植或中药治疗脊髓损伤也可通过抑制AQP-4表达,消除脊髓水肿,减轻脊髓继发性损伤,从而保存残存的脊髓组织并促进脊髓功能恢复,支持本研究的结果。
综上所述,IPC能通过抑制脊髓损伤后AQP-4的表达,减轻脊髓损伤部位水肿、减轻脊髓缺血再灌注损伤,这可能是IPC脊髓保护的机制之一。
[1]Coselli JS,LeMaire SA,Miller CC,et al.Mortality and paraplegia after thoracoabdominal aortic aneurysm repair:a risk factor analysis.Ann Thorac Surg,2000,69(2):409-414
[2]Kyrou IE,Papakostas JC,Ioachim E,et al.Early ischaemic preconditioning of spinal cord enhanced the binding profile of heat shock protein 70with neurofilaments and promoted its nuclear translocation after thoraco-abdominal aortic occlusion in pigs.Eur J Vasc Endovasc Surg,2012,43(4):408-414
[3]Yang C,Ren Y,Liu F,et al.Ischemic preconditioning suppresses apoptosis of rabbit spinal neurocytes by inhibiting ASK1-14-3-3dissociation.Neurosci Lett,2008,441(3):267-271
[4]Zvara DA,Colonna DM,Deal DD,et al.Ischemic preconditioning reduces neurologic injury in a rat model of spinal cord ischemia.Ann Thorac Surg,1999,68(3):874-880
[5]Miyamoto TA,Miyamoto KJ.Mechanisms of acute ischemic preconditioning.Ann Thorac Surg,2000,70(6):2186
[6]Ueno T,Chao ZL,Okazaki Y,et al.The impact of ischaemic preconditioning on spinal cord blood flow and paraplegia.Cardiovasc Surg,2001,9(6):575-579
[7]Wick A,Wick W,Waltenberger J,et al.Neuroprotection by hypoxic preconditioning requires sequential activation of vascular endothelial growth factor receptor and Akt.J Neurosci,2002,22(15):6401-6407
[8]Frigeri A,Gropper M A,Umenishi F,et al.Localization of MIWC and GLIP water channel homologues in neuromuscular,epithelial and glandular tissues.Cell Sci,1995,108(9):2993-3002
[9]Rash JE,Yasumura T,Hudso n CS,et al.Direct immunogold labeling of aquaporin-4in square arrays o f astrocyte and ependymocyte plasma membranes in rat brain and spinal cord.Neurobiology,1998,95(20):11981-11986
[10]王鹏,殷国勇,曹晓建.脊髓缺血-再灌注损伤机制及防治措施研究进展.医学综述,2006,12(20):1256-1258
[11]Verkman AS,Yang B,Song Y,et al.Role of water channels in fluid transport studied by phenotype analysis of aquaporin knockout mice.Exp Physiol,2000,85:233-241
[12]Vizuete ML,Venero JI,Vargas C,et al.Differential up-regulation of aquaporin-4mRNA expression in reactive astrocytes after brain iniury:potential role in brain edema.Neurobiol Dis,1999,6(4):245-258
[13]Ke C,Poon WS,Ng HK,et al.Heterogenous responses of aquaporin-4in edema formation in a replicated severe traumatic brain injury model in rat.Neurosci Lett,2001,301(1):21-24
[14]Kiening KL,Landeghem FK,Schreiber S,et al.Decreased hemispheric aquaporin-4is linked to evolving brain edema following controlled cortical impact injury in rats.Neurosci Lett,2002,324(2):105-108
[15]王伟,谢杰,方坚等.水通道蛋白-4在实验性脊髓损伤大鼠的表达.神经解剖学杂志,2005,21(2):139-142
[16]Joshi M,Fehlings MG.Development and characterization of a novel,graded model of clip compressive spinal cord injury in the mouse:Part 2.Quantitative neuroanatomical assessment and analysis of the relationships between axonal tracts,residual tissue,and locomotor recovery.J Neurotrauma,2002,19(2):191-203
[17]吴碧莲,贾小力,陈少强.静脉注射骨髓间充质干细胞可抑制大鼠损伤脊髓水通道蛋白-4的表达.解剖学杂志,2008,31(5):691
[18]彭忠勇,陈志斌,修波等.嗅鞘细胞移植对大鼠脊髓损伤后水通道蛋白-4的影响.贵阳医学院学报,2009,34(4):378-381
[19]王伟,谢杰,方坚等.补阳还五汤对实验性脊髓损伤大鼠水通道蛋白-4表达的影响.中国康复,2005,20(1):3-5

