丙型肝炎病毒核心蛋白上调基质金属蛋白酶组织抑制因子-1的表达
王巧侠,李文凡,成 军
1.西安市中心医院感染科,陕西 西安 710003;2.甘肃省人民医院消化科;3.北京地坛医院传染病研究所
丙型肝炎病毒(HCV)是慢性肝炎的主要致病因子之一,全世界约有一亿七千万人受到感染,HCV的感染很容易持续存在,造成肝脏慢性炎症,导致肝脏纤维化以及肝硬化。目前认为,HCV 进入肝细胞后,病毒基因组及其编码的蛋白与肝细胞基因与蛋白之间的相互作用,是决定HCV 复制、表达、免疫逃逸、慢性感染、肝纤维化以及致HCC(肝细胞肝癌)的关键因素之一[1]。其中核心蛋白作为一种多功能蛋白质,能够影响多种细胞信号转导途径,激活多种病毒及细胞基因启动子,调控多种基因的转录[2]。基于以往的研究成果,我们推测HCV 核心蛋白可能参与了细胞外基质合成与降解的调控,从而影响着肝纤维化、肝硬化的发生、发展。本研究通过观察HCV 核心蛋白对TIMP-1表达的影响,以探讨HCV 核心蛋白的致肝纤维化机制。
1 材料与方法
1.1 材料 人肝癌细胞系HepG2 细胞、人肝星状细胞系LX-2 细 胞、PcDNA3.1 (-)-HCVcore 质 粒、pCAT3-TIMP-1P 质粒及大肠杆菌DH 5α 菌株为北京地坛医院传染病研究所保存。Tag DNA 聚合酶、T4 DNA 连接酶及限制性内切酶均购自Takara 公司。质粒DNA 提取试剂盒,中间载体pGEM-Teasy及报告质粒pCAT3-Basic 均购自Promega 公司;CAT-ELISA 检测试剂盒及质粒DNA 转染试剂盒购自Roche 公司。玻璃奶纯化试剂盒购自博大公司,其他生化试剂购自Sigma 公司。DNA 序列测定由上海诺华公司完成。
1.2 pCAT3-TIMP-1 报告载体的构建 根据参考文献[3],设计合成一对寡核苷酸引物,上游引物P1:5'-GCTAGCAGAACCGGTACCCATCTCAG-3'。下游引物P2:5'-CTCGAGCTGTACCTCTGGTGTCTCTC-3',在上下游引物的5'-端分别引入NheI和XhoI 单一酶切位点(划线部分),以HepG2 细胞基因组DNA为模板,PCR扩增TIMP-1 基因启动子DNA 片段。反应条件:94℃预变性5 min,94℃变性1 min、65℃褪火1 min、72℃延伸1 min,循环35次,72℃保温10 min。1%琼脂糖凝胶电泳鉴定扩增结果。玻璃奶法回收纯化PCR 产物。回收产物与pGEM-Teasy中间载体连接,转化感受态DH5α 大肠杆菌,挑取在含有氨苄西林钠的选择平皿上生长的白色菌落提取质粒。酶切(KpnⅠ/MluⅠ)鉴定后,Kpn Ⅰ/Mlu Ⅰ双酶切重组质粒pGEMTeasy-TIMP-1P,玻璃奶纯化回收酶切产物,DNA测序鉴定无误后定向克隆至pCAT3-basic 载体,构建成重组质粒pCAT3-TIMP-1p,经NheI和XhoI 双酶切鉴定。磁珠法提取质粒以备转染。
1.3 pCAT3-TIMP-1 报告载体转录活性的鉴定 在35 mm 培养皿中常规培养HepG2 细胞,细胞生长至50%~80%融合时瞬时转染pCAT3-TIMP-1P 1μg,同时以转染pCAT3-basic的HepG2 细胞作阴性对照,以转染pCAT3-promoter的HepG2 细胞作阳性对照。转染48 h 后,收集细胞裂解液,用于CAT 活性检测。
1.4 CAT 表达水平的检测 按照试剂盒说明书进行。取1.0 ng/ml的CAT 标准品(试剂盒提供)及细胞裂解液200μl 加入已包被抗体的96 孔板中,37℃温育1 h,再依次加入第一抗体(地高辛标记的抗-CAT)、第二抗体(偶联有过氧化物酶的地高辛抗体anti-DIG-POD)各200μl,37℃温育1 h 后,加入过氧化物酶的底物室温显色10~30 min。用酶标仪测量标本在波长415 nm 处的吸光度值,其数值反映细胞提取物中的CAT 表达水平。以未作转染的细胞裂解液作空白对照进行平行实验。
1.5 pCAT3-TIMP-1P 与PcDNA3.1(-)-HCVcore质粒共转染实验 pCAT3-TIMP-1P、PcDNA3.1(-)-HCVcore各1μg 以脂质体法共转染LX-2 细胞,同时以转染pCAT3-basic的LX-2 细胞作阴性对照,以转染pCAT3-promoter的LX-2 细胞作阳性对照。转染48 h后,收集细胞裂解液,检测CAT 活性。所有实验严格平行操作。
2 结果
2.1 pCAT3-TIMP-1P 重组质粒的鉴定 PCR 产物经1%琼脂糖凝胶电泳分析显示扩增片段约800 bp(见图1)。DNA 测序结果与基因库中TIMP1 启动子序列比对,扩增片段位于TIMP-1 启动子974~1774 bp。构建的pCAT3-TIMP-1p 重组质粒经转化感受态DH5α 细菌后,进行菌落PCR,PCR 产物经1%琼脂糖凝胶电泳,显示扩增片段约为800 bp,符合预期大小,无非特异性扩增现象。提取的质粒应用NheI和XhoI酶切鉴定,结果表明TIMP-1P DNA 与pCAT3-Basic 报告基因载体正确连接(见图2)。

图1 TIMP-1p PCR 扩增 M:2 000 bp marker;1:TIMP-1p PCR 产物;图2 Pcat3-TIMP-1p 双酶切鉴定(NheI/XhoI)Fig 1 TIMP-1p PCR amplification M:2 000 bp marker;1:TIMP-1p PCR product;Fig 2 Idengified Pcat3-TIMP-1p by NheI/XhoI
2.2 pCAT3-TIMP-1P 启动子活性的鉴定 pCAT3-TIMP-1p 转染入HepG2 细胞后,以ELISA 法进行检测,结果显示pCAT3-basic的吸光度值为0.004±0.002,pCAT3-promoter为2.029±0.650,pCAT3-TIMP-1p为2.329±0.685,各组差异有统计学意义(F=26.075,P<0.05),LSD 法两两比较均显示P<0.05,提示pCAT3-TIMP-1p 在HepG2 细胞中能够启动CAT的表达,具有较强的启动子活性(见表1)。

表1 Pcat3-TIMP-1p 重组质粒转染HepG2的CAT 吸光度值Tab 1 The OD of Pcat3-TIMP-1p after transfecting HepG2
2.3 PcDNA3.1(-)-HCVcore 与pCAT3-TIMP-1p共转染后报告基因CAT 表达活检的检测 PcDNA3.1(-)-HCVcore 与pCAT3-TIMP-1p 共转染LX-2 细胞后,pCAT3-TIMP-1p 吸光度值为0.833±0.040,同期单独转染LX-2 细胞的pCAT3-TIMP-1p 吸光度值为0.677± 0.049,pCAT3-basic为0.193± 0.090,pCAT3-promoter为0.354±0.052,方差分析F=132.401(P<0.05),各组差异有统计学意义(见表2),LSD 法两两比较均显示P<0.05,提示PcDNA3.1(-)-HCVcore与pCAT3-TIMP-1p 共转染后,pCAT3-TIMP-1p的表达增加(见表2)。说明HCV 核心蛋白能够上调TIMP-1启动子的转录活性。
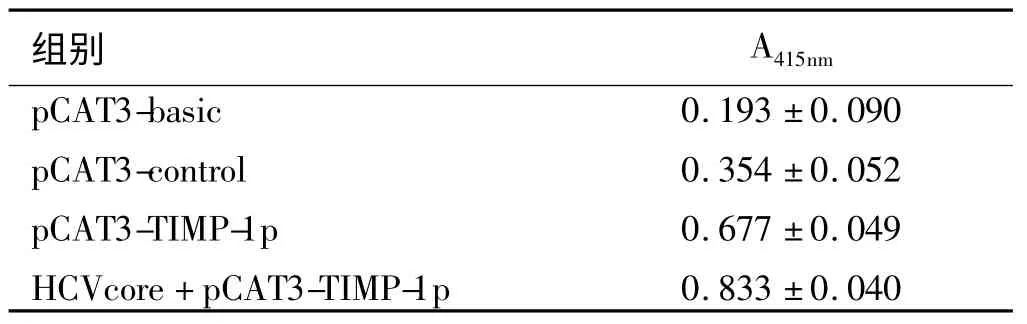
表2 PcDNA3.1(-)-HCVcore 与pCAT3-TIMP-1p 共转染LX-2的CAT 吸光度值Tab 2 The OD of PcDNA3.1(-)-HCVcore and Pcat3-TIMP-1p cotransfect LX-2
3 讨论
肝纤维化和肝硬化是连续的发展过程。在致病因子的作用下由于肝脏的持续炎症活动,肝纤维化进一步发展破坏了正常的小叶结构,假小叶和再生结节形成,则进入肝硬化。阻断、抑制甚至逆转肝纤维化是治疗慢性肝病的重要目标之一。因此,研究肝纤维化和肝硬化的发生、发展机制有着深远的意义。
肝纤维化发生的始动步骤在于肝星状细胞(HSC)的激活。HSC 激活后,一方面通过增殖使细胞数量增加;另一方面单个HSC 合成细胞外基质(ECM)的能力增强,使ECM的量和质均发生显著变化。以胶原为主的ECM 成份可较正常肝增加3~8 倍;各型胶原之间、糖蛋白之间及蛋白多糖之间的比值也出现异常[4]。而肝脏ECM的代谢主要由基质金属蛋白酶(MMPs)及其天然抑制剂-TIMPs 调节,MMPs 几乎能降解ECM的所有成分,而TIMPs 通过与MMPs 成员结合成复合物而抑制其活性,阻止ECM的降解,从而形成和促进肝纤维化。在肝纤维化早期,MMPs 酶解活性较为活跃,持续地降解正常基底膜,破坏肝脏的正常结构。ECM的成份和三维空间结构的改变又进一步刺激HSC 活化,调节HSC的形态、增殖及胶原合成[5],并使HSC 持续激活并维持活化状态。随着肝纤维化的发展,HSC 完全活化,大量合成ECM和TIMPs,TIMPs 进行性升高,与MMPs 特异性结合,使后者酶解活性显著下降,基质降解被抑制,ECM 在细胞外沉积增加,形成纤维化[6]。因而,学者们认为TIMPs 是肝纤维化发展过程中的一个非常重要的促进因素[7],目前在肝脏中主要有TIMP-1、TIMP-2 表达。TIMP-1可以结合除MMP-14、MMP-19 以外的所有MMP,并使其活性减弱,主要是抑制MMP-1的活性,TIMP-1可与MMP-1 酶原非催化位点结合,抑制酶原的活化。同时TIMP-1可与活化的MMP-1、MMP-3 形成复合物抑制两者的活性,还能以非共价键形式与明胶酶原结合,抑制明胶酶原自活化,与明胶酶原结合的TIMP-1 仍可抑制MMP-1的活性。研究发现肝组织内TIMP-1 水平与肝组织炎症和肝纤维化程度密切相关,在正常肝组织中既有表达,随着肝纤维化的发生、发展表达逐渐增强,而随着纤维的自然消散则迅速下降[8]。因此,研究抑制TIMP-1 继续活化的方法成为近年来治疗肝纤维化的突破点之一[9]。
HCV 是一个由脂膜包裹的正链RNA 病毒。根据所编码蛋白的结构和功能,其基因组分为结构基因(structural gene)和非结构基因(unstructural gene)。大量的研究表明HCV 核心蛋白具有广泛的反式调节作用,并参与肝纤维化的发生。那么HCV 核心蛋白对TIMPs的表达是否同样具有调节作用?是否HCV的核心蛋白通过对TIMPs 表达的影响而参与了肝纤维化向肝硬化的发展?这一假设的提出,要求我们从DNA水平或转录水平去研究HCV 核心蛋白对TIMPs 表达的影响。本研究采用脂质体转染技术将PcDNA3.1(-)-HCVcore 与pCAT3-TIMP-1p 共同转染入人肝星状细胞系LX-2中,同时分别设立阴性对照组和阳性对照组。采用ELISA 法检测各个细胞组CAT 表达的差异,结果显示PcDNA3.1(-)-HCVcore 与pCAT3-TIMP-1p 共同转染的细胞组,其CAT 表达明显高于同期单独转染pCAT3-TIMP-1p的细胞组,方差分析提示各组差异有统计学意义,LSD 法比较均显示两组之间差异有统计学意义,提示PcDNA3.1(-)-HCVcore 与pCAT3-TIMP-1p 共转染后,pCAT3-TIMP-1p的表达增加。因而得出结论,HCV 核心蛋白通过激活TIMP-1启动子的活性而上调TIMP-1的表达,进一步证实了HCV 引起肝纤维化和肝硬化的可能分子机制。从另一个角度阐明了经过积极抗病毒治疗的患者,他们的肝脏解剖结构可以改善、逆转的原因。
[1]Cheng D,Jiang YF,Xiao XQ,et al.Hepatitis C virus strain JFH1 down-regulates expression of growth arrest and DNA damage-inducible gene 45a in human hepatoma Huh7.5.1 cells[J].Zhonghua Gan Zang Bing Za Zhi,2012,20(11):807-810.
[2]Inoue K,Tsukiyama-Kohara K,Matsuda C,et al.Impairment of interferon regulatory factor-3 activation by hepatitis C virus core protein basic amino acid region 1[J].Biochem Biophys Res Commun,2012,428(4):494-499.
[3]Ohtake N,Nakai Y,Yamamoto M,et al.Separation and isolation methods for analysis of the active principles of Sho-saiko-to (SST)oriental medicine[J].J Chromatogr B Analyt Technol Biomed Life Sci,2004,812(1-2):135-148.
[4]Zhao Q,Qin CY,Zhao ZH,et al.Epigenetic modifications in hepatic stellate cells contribute to liver fibrosis [J].Tohoku J Exp Med,2013,229(1):35-43.
[5]Ramachandran P,Iredale JP.Liver fibrosis:a bidirectional model of fibrogenesis and resolution[J].QJM,2012,105(9):813-817.
[6]Hold GL,Untiveros P,Saunders KA,et al.Role of host genetics in fibrosis[J].Fibrogenesis Tissue Repair,2009,2(1):6.
[7]Zeisberg M,Kalluri R.Cellular mechanisms of tissue fibrosis.1.Common and organ-specific mechanisms associated with tissue fibrosis[J].Am J Physiol Cell Physiol,2013,304(3):C216-C225.
[8]Attallah AM,Badr El-Din NK,Omran MM,et al.Assessment of matrix metalloproteinase-1 for marking liver cirrhosis in chronic hepatitis C patients[J].Egypt J Immunol,2011,18(1):33-42.
[9]Liu DP,Lu FM,Wang MF,et al.Rhodiola rosea influence the expression of TIMP-1,Smad4 in the liver tissue of liver fibrosis rat[J].Chinese Journal of Gerontology,2012,32(12):2556-2558.刘东璞,卢凤美,王明富,等.红景天对大鼠肝纤维化肝脏组织中TIMP-1、Smad4 表达的影响[J].中国老年学杂志,2012,32(12):2556-2558.

