中国淡水绿藻纲新记录属——麦可属(Mychonastes)
李艳晖 胡明明 沈银武 刘永定 李敦海 李根保
(1.中国科学院水生生物研究所, 武汉 430072; 2.中国科学院大学, 北京 100049)
超微浮游植物(Picophytoplankton, <3 μm)广泛分布于各种类型和不同营养水平的湖泊中, 是水体的重要初级生产者[1,2], 包括超微蓝藻(Picocyanobacteria)和超微真核藻(Eukaryotic picoalgae)。
一般来说, 典型的真核超微浮游生物的特征为:细胞球状, 形态简单, 以似亲孢子或二分裂营无性生殖[3]。由于其细胞较小, 形态特征简单, 使用普通光学显微镜甚至电子显微镜观察也很难鉴定到纲水平[4], 因此常被描述为“Small coccoid 或Chlorellalike cells; little round green balls”(LRGT)或Nannochloris-like algae”[1,2], 导致了对这类藻进行分类学描述和鉴定上的困难, 同时也人为降低了其在自然水体中的多样性。
目前, 国外已报道的常见淡水真核超微藻种类主要有:Choricystis minor(Skuja) Fott[5—8]、Pseudodictyosphaerium jurisii(Hindák) Hindák[9]、Mychonastes homosphaera(Skuja) Kakina & Punčochářová[10,11]、Nannochloropsis limneticaKrienit, Hepperle, Stich &Weiler[4,12], 欧洲、北美、以色列等都有超微浮游植物分离、形态学、超微结构和系统发育方面的报道。我国尚未有关于淡水超微真核浮游植物的分布和多样性方面的研究, 最新的藻类分类学资料《中国淡水藻类—系统、分类及生态》[13]中也没有关于超微真核藻属和种的描述。作者于2006年自滇池分离获得 2株单种真核超微藻, 对其进行了形态学、细胞超微结构特征观察, 同时结合 18S rRNA基因序列构建系统发育树确定其分类学地位, 填补我国淡水真核超微浮游植物分类学研究方面的空白。
1 材料与方法
1.1 藻株的分离与培养
取一定体积新鲜采集的水样预过 Whatman GF/C玻璃纤维滤膜或Whatman 2.0 µm孔径的聚碳酸酯膜, 取过滤水样(或原水样)划平板或铺平板接种于含 1%琼脂的 BG11[14]或 BBM[15]固体培养基,用封口膜封好后将其倒置于光照培养箱内, 于20—30 µmol photons/(m2⋅s)、光暗周期 12h∶12h、温度(25±1)℃条件下培养, 待平板上长出可见藻落,挑取单藻落进行镜检, 进一步分离纯化目的藻落,挑单藻落至BG11液体培养基, 于相同条件下培养。获得藻株 DC-10和 DC-11 (分别于 2006年 7月和2006年10月分离自滇池水样)。
1.2 形态学和细胞超微结构观察
取培养至指数生长阶段的藻细胞进行光镜及电镜的样品制备。分别用生物显微镜(Nikon ECLIPSE E600)、扫描电镜(荷兰FEI公司的Quanta 200)和透射电镜(日本JEOL公司的JEM-1230)观察。
1.3 藻细胞基因组DNA提取
方法参照《精编分子生物学实验指南》(第四版)[16]。取适量体积指数生长期的藻液, 于 20℃,12000 r/min离心5min收集藻细胞并用无菌水洗涤3次, 加 567 µL的 TE缓冲液[100 mmol/L Tris-HCl(pH 8.0), 20 mmol/L Na2EDTA]反复吹打使藻细胞重悬浮, 加 30 µL 10%的 SDS和 3 µL 20 mg/mL的蛋白酶K, 混匀, 37℃温育1h, 期间不断轻轻摇动; 加100 µL 5 mol/L的 NaCl, 充分混匀后加入 80 µL 10%的 CTAB/NaCl溶液, 混匀, 于 65℃温育 30min; 加等体积的酚∶氯仿∶异戊醇(25∶24∶1), 混匀, 于20℃, 10000 r/min离心10min, 小心吸取上清至新管中,加等体积氯仿/异戊醇(24/1), 混匀, 20℃, 10000 r/min离心 10min, 重复 1次; 转移上清至新管中, 加 0.6倍体积的冰冷异丙醇沉淀DNA, 于4℃, 12000 r/min,10min离心收集DNA沉淀; 70%乙醇清洗2次后加50—100 µL 无菌水溶解 DNA, –20℃保存。
1.4 藻株18S rRNA基因序列分析18S rRNA基因扩增
使用真核生物通用18S rRNA基因引物对 18F(5′-ACCTGGTTGATCCTGCCAG-3′)和 18R (5′-TGA TCCTTCT/CGCAGGTTCAC-3′) (Moon-van der Staay,2001)[17]扩增藻株18S rRNA基因片段, 引物由上海英骏合成。PCR反应体系为 20 μL, 包括: 10×PCR缓冲液[200 mmol/L (NH4)2SO4, 750 mmol/L Tris-HCl (pH 8.8), 0.1% TWEEN 20], 1.5 mmol/L MgCl2,dNTP 200 μmol/L, 引物各 0.15 μmol/L, 1 μL 模板DNA, 0.2 UTaqDNA聚合酶(Fermentas), 加水补足至20 μL。反应条件为: 94℃预变性5min; 94℃ 60s,58℃ 60s, 72℃, 90s, 循环29次; 72℃延伸 10min。PCR扩增产物用1.2%琼脂糖凝胶电泳检测, 扩增片段大小在1800 bp左右。
PCR产物的回收、纯化与克隆 扩增的PCR产物使用 OMEGA (USA)试剂盒回收纯化, 连接至pMD 18-T vector (Takara, Japan), 转化大肠杆菌E.coliDH 5α感受态细胞, 使用引物对18F/18R进行阳性克隆检验, 对重组质粒进行测序, 由上海Invitrogen生命技术有限公司完成测序。
藻株系统发育分析 使用软件 Clustal X(1.83)进行多序列比对; MEGA 4.0采用邻接法(NJ)和最大简约法(MP)构建系统树, 自展率(Bootstrap)进行1000次重复, 获得一致系统树。用于构建系统进化树的藻株及其GenBank信息(表1)。藻株DC-10和DC-11在GenBank中的登录号分别为: JF834168和JF834169。

表1 用于构建系统进化树的藻株及其GenBank信息Tab.1 Strains used for phylogenetic tree construction and their GenBank information
2 结果
2.1 形态学特征分析
藻株 DC-10(图 1a)和 DC-11均为单细胞, 细胞球形, 直径 1.5—4 μm, 在光镜下观察细胞壁平滑,多见母细胞包被2个似亲孢子进行繁殖。
2.2 藻株DC-10的细胞超微结构观察
在扫描电镜下观察藻株 DC-10, 细胞球形, 不同于普通光学显微镜下观察到的平滑细胞壁, 细胞壁表面具有不规则的肋网(图1b)。
藻株 DC-10的超薄切片观察结果(图 1c-f): 细胞壁2层, 外层宽20—25 nm, 为三层结构, 表现为暗–明–暗三层。每个细胞具备一套简单的细胞器,主要包括: 1个细胞核, 1个线粒体和1个叶绿体。叶绿体周生, 杯状, 占据细胞大部分体积, 不具蛋白核; 类囊体一般2—6层平行堆叠, 淀粉粒散布在其中, 但数量不多且并没有在每个细胞中都观察到。细胞核常位于叶绿体凹面对面, 线粒体则常位于细胞核和叶绿体之间, 脊数目较少, 三者占据了细胞的绝大部分体积, 在细胞质中分布着数量众多的核糖体(图 1c-e)。
DC-10营似亲孢子的无性繁殖方式, 如图1c显示的是由母细胞壁包被2个大小相同、具相同细胞器的似亲孢子。似亲孢子母细胞的外层细胞壁具典型的TL–层(Trilaminar Layer)结构, 2个暗层之间为透明电子层。
2.3 藻株DC-10、DC-11的18S rRNA基因序列分析
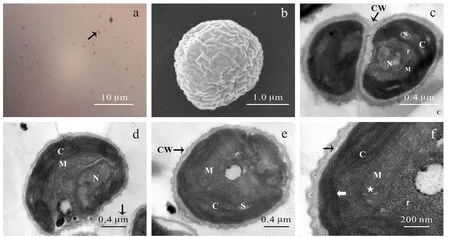
图1 藻株DC-10显微镜照片Fig.1 Micrographs of green alga strain DC1-10
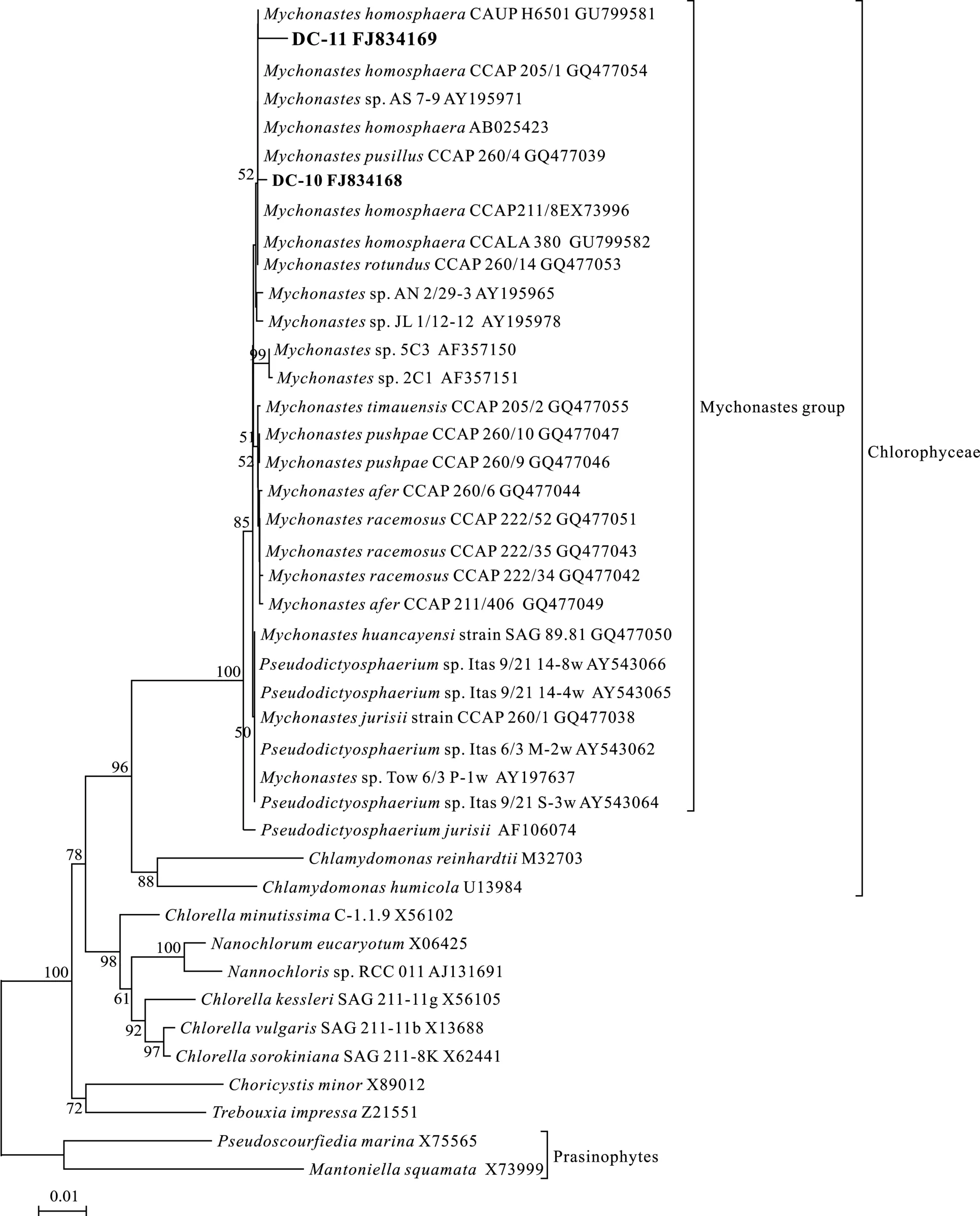
图2 采用邻接法(NJ)基于部分18S rRNA基因序列构建的系统进化树Fig.2 Phylogenetic tree (neigh bor-joining) inferred from partial 18S rRNA gene sequences
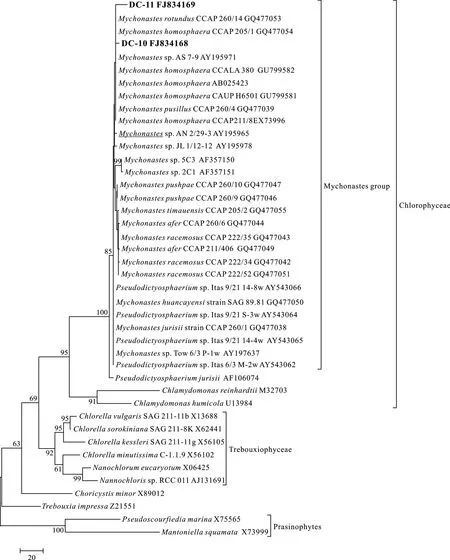
图3 采用最大简约法(MP)基于部分18S rRNA基因序列构建的系统进化树Fig.3 Phylogenetic tree (Maximum parsimony) inferred from partial 18S rRNA gene sequences
使用真核生物通用引物对 18F/18R扩增藻株DC-10和 DC-11的 18S rRNA基因片段长度约为1800 bp, 同Mychonastes homosphaera(X73996和AB025423)相似性为99%, 在构建的18S rRNA系统发育树(图2、图3)中, DC-10和 DC-11同MychonasteshomosphaeraCCAP211/8E(X73996)、M.Homosphaera(AB025423)、M.homosphaeraCCAP 205 等Mychonastes(Simpson & van Valkenburg)属的其他藻株以 85%的 bootstrap值组成麦可群, 为单起源,同Pseudodictyosphaerium jurisii以100%的bootstrap值分成 2个独立的进化枝, 均属于绿藻纲(Chlorophyceae), 同小球藻属(ChlorellaBeijerinck)、Choricystis(Skuja) Fott等淡水中常见的真核超微藻属种类所在的特波藻纲(Trebouxiophyceae)进化枝相邻。
2.4 麦可属(Mychonastes Simpson et Van Valkenburg)
该属特征同小球藻属类似, 但不具蛋白核。细胞球形、卵形或椭圆形, 细胞壁厚, 2层, 外层细胞壁表面具肋网; 单生或多个细胞聚集成群; 叶绿体1—4个, 周生, 盘状或杯状, 常有淀粉粒; 通过似亲孢子生殖; 不具动孢子; 细胞核1个, 营养细胞中其大小有差异; 线粒体1个[10,22]。
藻株DC-10的细胞大小、形状、叶绿体形态、细胞壁结构及似亲孢子繁殖方式同麦可属M.homosphaera基本相同[10]。在构建的18S rRNA基因系统发育树中, DC-10和DC-11位于麦可属群进化枝上, 属于绿藻纲。但由于选取的18S rRNA基因序列保守性高, 突变频率低, 在构建的进化树中不能进一步确定其种水平。因此我们将DC-10和DC-11归为麦可属种类, 为我国首次报道的淡水超微真核藻。
3 讨论
麦可属由Simpson和Van Valkenburg于1978年首次描述, 其模式种为M.ruminatesSimpson & Van Valkenburg, 分离自美国马里兰州切萨皮克湾。随后原先为小球藻属的C.homosphaeraSkuja和C.zofingiensisDönz被划分至麦可属, 分别重新命名为M.homosphaera和M.zofingiensis(Dönz) Kalina &Punčochářová[10,11]。M.homosphaera同M.ruminates形态相似, 只是生境不同,M.homosphaera分离自淡水, 而M.ruminates分离自半咸水。M.zofingiensis的细胞大小、叶绿体形状和似亲孢子数目不同于M.homosphaera, 细胞大小约 2倍于后者, 叶绿体几个或多数, 形成的似亲孢子数目可达64个[10]。
同M.homosphaera不同之处在于, 在DC-10中我们观察到的似亲孢子的数目多为 2个, 偶见母细胞包被 4个似亲孢子, 这可能与使用的培养基不同或是处于不同的生长阶段有关。另外, 同分离自以色列Kinneret湖的藻株相比, DC-10细胞壁上的肋网要密集一些。
麦可属呈世界性分布, 生境广泛, 包括溪流和大型静止水体[11], 在肯尼亚Baringo湖和Victoria湖,瑞典Erken湖, 德国Stechlin湖, 印度Gandhi湖[11],以色列Kinneret湖[10], 瑞士Hagel湖、Lucerne湖和Alpnach湖[8], 美国北达科他州 Arrowwood国家野生动植物保护区内浅水湖[18]都有分布。
分子系统学研究表明绿藻门似亲孢子类球状绿藻具有很多分类单元, Friedl基于18S rDNA序列分析, 将这类藻归为 2个不同的纲, 分别是特波藻纲(Trebouxiophyceae)和绿藻纲(Chlorophyceae)[19]。根据Huss,et al.基于生物化学、生理学、超微结构和分子生物学研究的结果, 小球藻类群(Chlorellataxa)分属于特波藻纲和绿藻纲, 其中M.homosphaera属于绿藻纲。小球藻(C.vulgarisBeijerinck)、凯氏小球藻(C.kessleriFott & Nováková)、C.lobophoraAndreyeva和C.sorokinianaShih.& Krauss 4种属于小球藻属(ChlorellaBeijerinck), 属特波藻纲, 其特征是葡萄糖胺为细胞壁主要成分, 具淀粉鞘且被 2层类囊体嵌入的蛋白核[9,20]。小球藻为小球藻属的模式种, 其细胞壁薄, 不含孢粉类物质, 外层细胞壁不具暗–明–暗三层结构[7]。《中国淡水藻类—系统、分类及生态》[13]中小球藻属有 3个种, 分别为小球藻, 椭圆小球藻(C.ellipsoideaGerneck)和蛋白核小球藻(C.pyrenoidosaChick), 《中国淡水藻志(第八卷)—绿藻门, 绿球藻目》[21]中小球藻属包括 5种,除小球藻和椭圆小球藻外, 还有凯氏小球藻、喜糖小球藻(C.sacharophila(Krueger) Migula)和埃氏小球藻(C.emersoniiShihira & Krauss)。在Huss,et al.构建的小球藻类 18S rRNA基因系统发育树中, 喜糖小球藻、椭圆小球藻、C.luleoviridisChodat和C.mirabilisAndreyeva各以很高的bootstrap值(>88%)聚在一起, 说明它们之间亲缘关系很近, 同小球藻属均属于特波藻纲[20]。可通过观察藻细胞大小和是否含蛋白核来区分小球藻属和麦可属种类, 小球藻属的4种藻细胞均不小于3 μm, 不属于超微浮游植物范畴, 具蛋白核, 而麦可属不具蛋白核。
另外常混淆的小型球状类藻还有Nannochloris(Naumann), 根据 Naumann对Nannochloris属模式种N.bacillaris(Naumann)的原始描述, 它通过二分裂方式繁殖, 属于丝藻目(Ulotrichales)[7], 而麦可属则以似亲孢子方式繁殖。
伪网球藻属(PseudodictyosphaeriumHindák)同麦可属均隶属于绿藻纲, 该属的基本特征为: 单细胞或群体, 细胞直径 2—10 μm, 叶绿体周生, 杯状或带状, 不具蛋白核, 具一套简单的细胞器, 其细胞超微结构同麦可属类似。分布于河流、湖泊和小型水体如池塘中, 德国Stechlin湖[9]和美国明尼苏达州 Itasca湖[3]都有其分离报道。其中,P.jurisii(Hindák) Hindák 最初被描述为Dactylosphaerium jurisiiHindák, 后根据其不具蛋白核和动孢子将其划分至伪网球藻属(Pseudodictyosphaerium), 是一种常见的超微绿藻, 但细胞通常以群体形式存在, 由残存的母细胞壁连接在一起, 使用墨汁负染色法很容易观察到细胞包被在透明的无特殊结构的胶被中,但是在野外或是室内培养条件下, 群体很容易完全解聚[9,11], 因此增加了鉴定小型、球形或椭圆形类绿藻的困难。
球状类超微绿藻由于其细胞小, 形态学特征相同而很难对其进行正确分类, 应结合电镜和分子生物学方法方能更准确地确定其分类学地位。我国有关淡水超微真核藻的分离培养、形态学、生理生态学、多样性及分子系统关系研究起步较国外晚, 因此有待于进一步扩大研究调查范围, 分离培养获得更多的超微浮游植物材料, 以完善我国的淡水超微浮游植物的分类学资料。
致谢:
衷心感谢魏印心先生、胡鸿钧先生及刘其芳老师给予本文的指导和帮助。感谢云南大理洱海湖泊研究中心的卫志宏、孟良和大理州环境监测站工作人员在洱海样品采集过程中的帮助和支持。
[1] Callieri C, Stockner J G.Freshwater autotrophic picoplankton: a review [J].Journal of Limnology, 2002, 61(1): 1—14
[2] Stockner J G, Antia N J.Algal picoplankton from marine and freshwater ecosystems: a multidisciplinary perspective [J].Canadian Journal of Fisheries and Aquatic Sciences, 1986,43: 2472—2503
[3] Fawley M W, Fawley K P, Owen H A.Diversity and ecology of small coccoid green algae from Lake Itasca, Minnesota,USA, includingMeyeralla planktonica, gen.etsp.nov.[J].Phycologia, 2005, 44(1): 35—48
[4] Krienitz L, Hepperle D, Stich H B,et al.Nannochloropsis limnetica(Eustigmatophyceae), a new species of picoplankton from freshwater [J].Phycologia, 2000, 39(3): 219—227
[5] Krienitz L, Huss V A R, Hümmer C.PicoplanktonicChoricystisspecies (Chlorococcales, Chlorophyta) and problems surrounding the morphologically similar ‘Nannochloris-like algae’ [J].Phycologia, 1996, 35(4): 332—341
[6] Belykh O I, Semenova E A, Kuznedelov K D,et al.A eukaryotic alga from picoplankton of Lake Baikal: morphology,ultrastructure and rDNA sequence data [J].Hydrobiologia,2000, 435: 83—90
[7] Hepperle D, Krienitz L.Systematics and ecology of Chlorophyte picoplankton in German inland waters along a nutrient gradient [J].International Review of Hydrobiology, 2001,86(3): 269—284
[8] Hepperle D, Schlegel I.Molecular diversity of eukaryotic picoalgae from three lakes in Switzerland [J].International Review of Hydrobiology, 2002, 87(1): 1—10
[9] Krienitz L, Takeda H, Hepperle D.Ultrastructure, cell wall composition, and phylogenetic position ofPseudodictyosphaerium jurisii(Chlorococcales, Chlorophyta) including a comparison with other picoplanktonic green algae [J].Phycologia, 1999, 38(2): 100—107
[10] Hanagata N, Malinsky-Rushansky N, Dubinsky Z.Eukaryotic picoplankton,Mychonastes homosphaera(Chlorophyceae, Chlorophyta) in Lake Kinneret, Israel [J].Phycological Research, 1999, 47: 263—269
[11] Krienitz K, Bock C, Dadheech P K,et al.Taxonomic reassessment of the genusMychonastes(Chlorophyceae,Chlorophyta) including the description of eight new species[J].Phycologia, 2011, 50(1): 89—106
[12] Fietz S, Bleiβ W, Hepperle D,et al.First record ofNannochloropsis limnetica(Eustigmatophyceae) in the autotrophic picoplankton from Lake Baikal [J].Journal of Phycology, 2005, 41: 780—790
[13] Hu H J, Wei Y X.The Freshwater Algae of China Systematics, Taxonomy and Ecology [M].Beijing: Science Press.2006, 209—903 [胡鸿钧, 魏印心.中国淡水藻类—系统、分类及生态.北京: 科学出版社.2006, 209—903]
[14] Rippka R, Deruelles J, Waterbury J B,et al.Generic assignments, strain histories and properties of pure cultures of cyanobacteria [J].Journal of General Microbiology, 1979,111(1): 1—61
[15] Nichols H W, Bold H C.Trichosarcina polymorphagen.etsp.nov.[J].Journal of Phycology, 1965, 1(1): 34—38
[16] Ausubel F M, Brent R, Kingston R E,et al.Short Protocols in Molecular Biology [M] (4th ed.) John Wiley & Sons, Inc.,Publishers.2000, 55—56 [F.M.奥斯伯, R.布伦特, R.E.金斯顿.精编分子生物学实验指南(第四版).北京: 科学出版社.2000, 55—56]
[17] Moon-van der Staay S Y, De Wachter R, Vaulot D.Oceanic 18S rDNA sequences from picoplankton reveal unsuspected eukaryotic diversity [J].Nature, 2001, 409: 607—610
[18] Phillips K A, Fawley M W.Diversity of coccoid algae in shallow lakes during winter [J].Phycologia, 2000, 39(6):498—506
[19] Friedl T.Inferring taxonomic positions and testing genus level assignments in coccoid green lichen algae: a phylogenetic analysis of 18S ribosomal RNA sequences fromDictyochloropsis reticulataand from members of the genusMyrmecia(Chlorophyta, Trebouxiophyceae cl.nov.) [J].Journal of Phycology, 1995, 31: 632—639
[20] Huss V A R, Frank C, Hartmann E C,et al.Biochemical taxonomy and molecular phylogeny of the genusChlorellasensu lato (Chlorophyta) [J].Journal of Phycology, 1999, 35:587—598
[21] Bi L J, Hu Z Y.Flora Algarum Sinicarum Aquae Dulcis.Tomus VIII.Chlorophyta.Chlorococcales [M].Beijing: Science Press.2005, 30—32 [毕列爵, 胡征宇.中国淡水藻志第八卷 绿藻门 绿球藻目.北京: 科学出版社.2005, 30—32]
[22] Simpson P D, Van Valkenburg S D.The ultrastructure ofMychonastes ruminatesgen.etsp.nov., a new member of the Chlorophyceae isolated from brackish water [J].European Journal of Phycology, 1978, 13: 117—130

