高血糖对大鼠脑缺血再灌注后神经细胞凋亡及细胞色素C表达的影响
林冬融 韩江全 胡泳涛 (遵义医学院第五附属(珠海)医院神经内科,广东 珠海 519100)
研究表明,高血糖是非糖尿病急性卒中患者高发病率和高死亡率的重要独立危险因素,同时也可能是导致局部或广泛缺血后预后更差的危险因素〔1~3〕。细胞色素C(Cyt-C)作为一个普遍的线粒体起源的细胞死亡信号〔4〕,在细胞凋亡过程中起着重要的作用。但高血糖是否影响线粒体的凋亡相关途径,目前尚未明了。本实验检测高血糖条件下大鼠脑缺血再灌注损伤的神经功能评分及Cyt-C的表达,探讨高血糖加重脑缺血再灌注损伤的作用机制。
1 材料与方法
1.1 实验动物与分组 健康雄性SD大鼠70只(遵义医学院珠海校区中心实验室提供),8~9周龄,体重250~300 g,随机分为三大组:高血糖组30只、正常血糖组30只、假手术组10只。前两组再随机按脑缺血2 h再灌注后6、12、24 h分为三个亚组,每组10只。
1.2 方法
1.2.1 高血糖大鼠模型的制备 大鼠实验前禁食12 h,自由进水。高血糖组于造模前30 min尾静脉注射25%葡萄糖4 g/kg,造成高血糖状态。正常血糖组则以同样方法注射等量18%D-甘露醇。用血糖仪在栓线前测定血糖值。
1.2.2 脑缺血再灌注模型的制备 实验大鼠以戊巴比妥钠(40 mg/kg)腹腔麻醉,采用改良Longa线栓法建立大脑中动脉阻塞再灌注模型。所有实验大鼠均栓塞右侧大脑中动脉(MCA)。栓塞2 h拔出栓线,分别于再灌注后6、12、24 h(每个亚组10只)处死。假手术组仅做颈部正中切口,暴露右侧颈总动脉,缝合皮肤。模型成功的标志是动物苏醒后出现同侧的Horner征(眼裂变小,眼球内陷)和对侧以前肢为重的偏瘫。
1.2.3 神经功能评分 参照Zea-Longa5级4分制评分标准,分别于各时间点对实验大鼠进行神经功能评分:0分:无神经功能缺失症状;1分:轻度局灶性神经功能缺失(大鼠被提尾悬空时病灶对侧前肢呈屈曲、抬高、肩内收、肘关节伸直);2分:中度局灶性神经功能缺失(有向瘫痪侧旋转征象);3分:重度局灶性神经功能缺失(有向病灶对侧跌倒征象);4分:无自发活动及意识水平下降。
1.2.4 细胞凋亡检测 采用TUNEL法,严格按照试剂盒(武汉博士德公司)说明书进行。显微镜下在缺血半暗带区取5个高倍视野,计算阳性细胞数(镜下细胞核内有棕黄色颗粒)。
1.2.5 免疫组化检测Cyt-C表达 采用SABC法。石蜡切片常规脱蜡至水后进行扩原修复。阻断内源性过氧化物酶的活性,滴加正常非免疫动物血清封闭。抗体稀释液1∶100稀释Ⅰ抗(Cytochrome C Rabbit mAb,购自武汉博士德生物工程有限公司)。滴加Ⅰ抗,4℃孵育过夜,次日室温复温30 min,移去Ⅰ抗,以0.01 mol/L PBS冲洗,滴加生物素化的羊抗兔IgG,室温孵育10 min,PBS洗。滴加链霉菌抗生物素-过氧化物酶溶液,室温孵育10 min,PBS洗。DAB显色,苏木素复染,返蓝。脱水透明封片,显微镜观察,阳性细胞胞质呈棕黄色。在每张切片皮质区随机取不相重复的5个视野,数码相机拍照,MiVnT显微生物图像分析系统对所拍图象进行分析,统一光饱和度、亮度和色调,取平均灰度级算术均数用于各组间比较。
1.3 统计学处理 数据采用SPSS17.0软件分析系统处理,以±s表示,采用单因素方差分析检验。
2 结果
2.1 造模前血糖值 高血糖组血糖(16.48±1.88)mmol/L水平明显高于正常血糖组(5.91±0.34)mmol/L(P<0.01)。
2.2 神经功能评分 假手术组全部动物均为0分,未见神经功能缺损;其余两组在大鼠麻醉清醒后即出现不同程度的神经功能缺损。正常血糖缺血再灌注组与假手术组比较,神经功能缺损程度明显加重(P<0.01);高血糖组与正常血糖组比较,神经功能缺损加重(P<0.05)。见表1。
2.3 TUNEL染色及光镜下凋亡细胞计数 光镜下假手术组可见少量凋亡细胞(0.50±0.53,细胞核内可见棕黄色颗粒)。正常血糖组再灌注6 h可见凋亡细胞,12 h逐渐增高,于再灌注24 h达高峰。高血糖组于再灌注6、12、24 h凋亡细胞计数多于相同时间段内正常血糖组(P<0.05)。见表2,图1。
2.4 Cyt-C免疫组织化学染色 假手术组未见Cyt-C表达(151.33±3.22);正常血糖组再灌注6 h可见Cyt-C表达,12 h逐渐增高,于再灌注24 h达高峰;高血糖组于再灌注6、12、24 h Cyt-C表达明显高于正常血糖组相应各亚组。见表3,图2。
表1 神经功能评分比较(±s,n=10)

表1 神经功能评分比较(±s,n=10)
与假手术组比较:1)P<0.01;与相同时间点正常血糖组比较:2)P<0.01,3)P <0.05,下表同
组别 正常血糖组 高血糖组再灌注6 h 1.40±0.521) 2.20±0.631)2)再灌注12 h 2.60±0.521) 3.50±0.711)2)再灌注24 h 3.30±0.481) 3.80±0.421)2)
表2 凋亡细胞计数比较(±s,n=10)

表2 凋亡细胞计数比较(±s,n=10)
组别 正常血糖组 高血糖组再灌注6 h 11.40±1.511) 12.80±1.141)3)再灌注12 h 15.40±1351) 18.80±1.481)2)再灌注24 h 17.50±1.081) 19.10±0.991)2)
表3 Cyt-C免疫组化灰度级比较(±s,n=10)

表3 Cyt-C免疫组化灰度级比较(±s,n=10)
组别 正常血糖组 高血糖组再灌注6 h 117.40±1.501) 114.30±1.341)2)再灌注12 h 115.30±1.641) 109.00±1.561)2)再灌注24 h 113.10±1.521) 106.70±1.771)2)
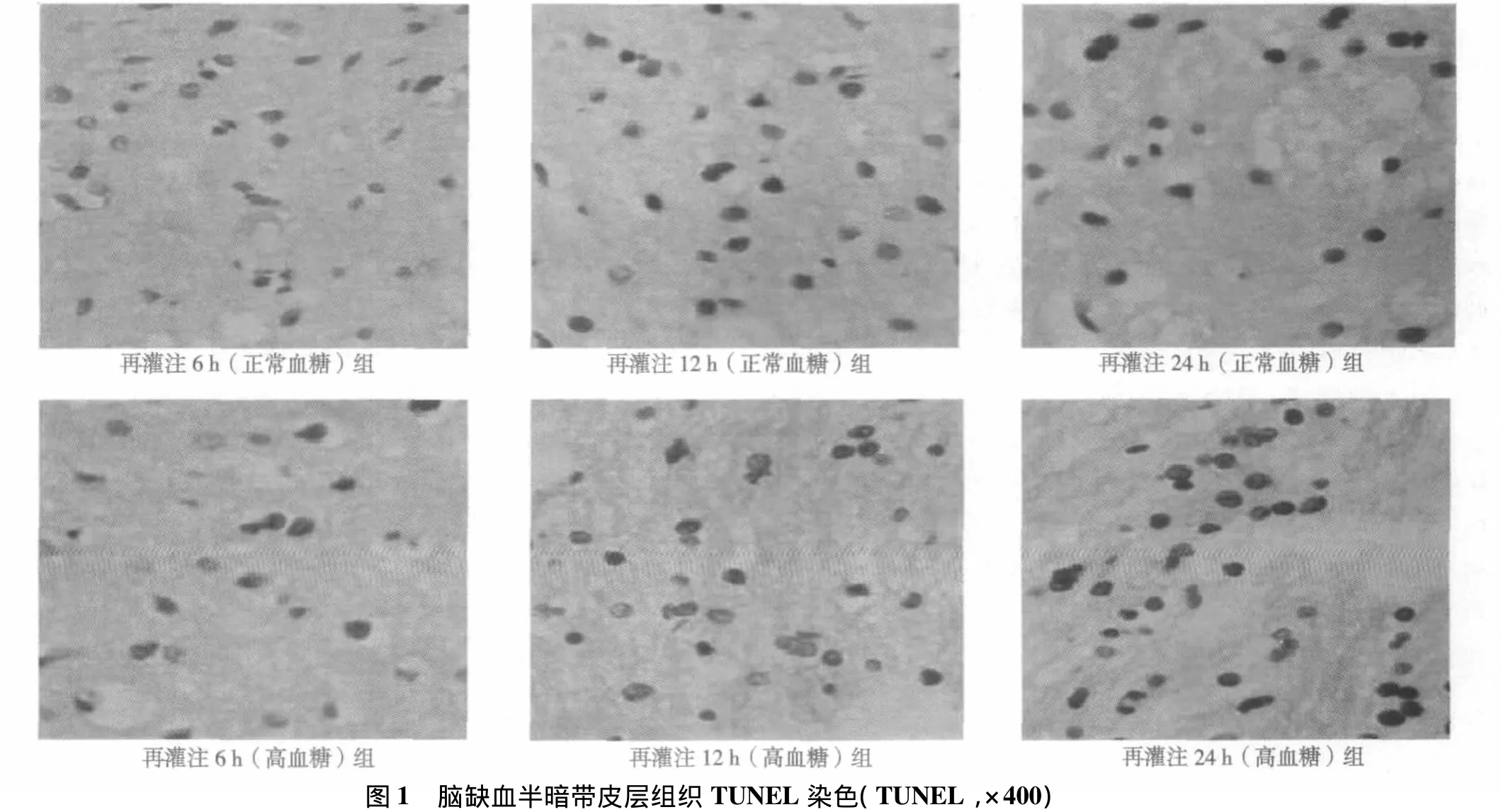
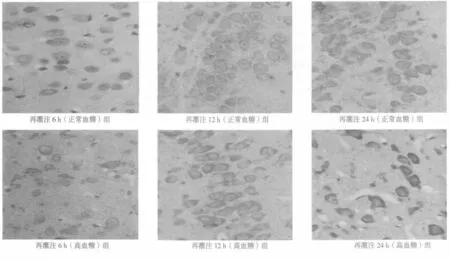
图2 各组脑缺血半暗带皮质区Cyt-C免疫组织化学染色(IHC,×400)
3 讨论
脑缺血的发病机制,涉及能量代谢障碍、局部酸中毒、炎症介质释放、自由基损伤、细胞内Ca2+超载、兴奋性氨基酸的毒性作用等。近年来研究〔5,6〕表明,神经细胞凋亡在脑缺血神经细胞损害中发挥重要作用。急性缺血性脑损伤发生后,梗死的周边部位即半暗带区的神经元损伤主要通过凋亡途径进行,凋亡神经元的多少决定着缺血引起的损害最终范围大小,细胞凋亡是脑缺血再灌注损伤的主要环节,而线粒体则是细胞凋亡过程中重要的细胞器〔7〕。线粒体是通过向胞浆释放Cyt-C等途径参与各种凋亡过程,尤其是Cyt-C从线粒体向细胞浆的重新分布,这与各因素诱导凋亡产生有密切的关系。
高血糖既是缺血性脑血管病的危险因素之一,也是缺血区神经元损伤加重的因素。高血糖加重脑缺血损伤的机制是多途径、多水平的,包括有高血糖缺血脑组织中乳酸聚集,加重细胞内酸中毒,对缺血部位神经元产生直接毒性;高血糖促进兴奋性氨基酸堆积;高血糖增强一氧化氮(NO)毒性作用;高血糖破坏血脑屏障,并促进梗死出血等,血管损伤和乳酸堆积酸中毒是最基本的途径。本实验结果显示,Cyt-C的表达强度与凋亡细胞的数目存在一定关系。Cyt-C是一种可溶蛋白,正常时位于线粒体膜内并松散地附着于线粒体膜的内表面,当Cyt-C从细胞线粒体转移到胞质,则可通过免疫组织化学方法检测到。释放到细胞质中的Cyt-C通过结合凋亡蛋白酶激活因子-1和caspase-9后,再激活caspase-3,这是导致细胞凋亡产生的中心事件〔8〕。以上结果表明通过线粒体通路加重细胞凋亡过程,是高血糖加重脑缺血损伤的机制之一。
1 Kostulas N,Markaki I,Cansu H,et al.Hyperglycaemia in acute ischaemic stroke is associated with an increased 5-year mortality〔J〕.Age Ageing,2009;38(5):590-4.
2 Harada S,Fujita WH,Shichi K,et al.The development of glucose intolerance after focal cerebral ischemia participates in subsequent neuronal damage〔J〕.Brain Res,2009;7(1279):174-81.
3 Bruno A.Management of hyperglycemia during acute stroke〔J〕.Curr Cardiol Rep,2009;11(1):36-41.
4 Kelvin Cain,Bratton SB,Cohen GM.The Apaf-1 apoptosome:a large caspase-activating complex〔J〕.Biochimie,2002;9(2-3):203.
5 韩江全,李 均,李官成,等.葛根素对大鼠缺血侧皮质、纹状体区神经元凋亡及胶质细胞源性神经生长因子的影响〔J〕.第三军医大学学报,2009;31(19):1912-3.
6 Nijboer CH,Heijnen CJ,Groenendaal F,et al.A dual Role of the NF-{kappa}B pathway in neonatal hypoxic ischemic brain damage〔J〕.Stroke,2008;39(9):2578-86.
7 Hong SJ,Dawson TM,Dawson VL.Nuclear and mitochondral conversations in cell death:PARP-l and AIF signaling〔J〕.J Trends Pharmacol Sci,2004;25(5):259-64.
8 Suzuki A,Tsutomi Y,Yamamato N,et al.Mitochondrial regulation of cell death:mitochondria are essential for procase-3 p21 complex formation to resist Fas mediated cell death〔J〕.Mol Cell Biol,1999;19(9):3842.

