异甘草素对创伤性脑损伤大鼠血清细胞因子的影响
杨永明,荔志云,季玮
异甘草素对创伤性脑损伤大鼠血清细胞因子的影响
杨永明1,荔志云2,季玮3
目的:观察异甘草素对创伤性脑损伤大鼠血清干扰素γ(IFNγ)、单核细胞趋化蛋白-1(MCP-1)、白介素-2(IL-2)、IL-4和IL-13的影响。方法:将45只大鼠随机分为假手术组、模型组、治疗组各15只,改良Feeney法建立大鼠脑外伤模型,假手术组仅开骨窗不打击。术后治疗组给予异甘草素治疗,假手术组和模型组给予等量生理盐水,均治疗5 d。检测血清中的细胞因子,测量脑含水量,观察海马细胞形态。结果:与模型组相比,治疗组MCP-1、IL-2、IL-4和IL-13含量升高(<0.05),IFNγ含量降低(<0.05),脑含水量减低(< 0.05),损伤侧海马组织病理学明显改善。结论:异甘草素可促进创伤性脑损伤大鼠的恢复,其机制可能与调节细胞因子有关。
异甘草素;创伤性脑损伤;细胞因子
创伤性脑损伤发病率高,缺少有效的治疗药物。中药提取物异甘草素是一种黄酮类化合物,对神经系统具有多种药理作用[1]。细胞因子在脑损伤中有重要作用,既可保护受伤的脑组织,又可加重脑组织损伤。在中枢神经系统中,干扰素γ(interferon γ,IFNγ)被认为是神经损害性因子[2],白介素-2(interleukin-2,IL-2)、IL-4、IL-13、单核细胞趋化蛋白-1(monocyte chemotactic protein-1,MCP-1)被认为具有神经保护作用[3,4]。本实验采用异甘草素对脑损伤大鼠进行干预,观察其对炎症细胞因子的影响。
1 材料与方法
1.1 材料
1.1.1 实验动物 SPF级Wistar雄性大鼠45只,由兰州军区兰州总医院动物实验科提供,鼠龄2~3个月,体质量150~200 g,在正常温控、光照及自由摄食条件下饲养。
1.1.2 主要试剂与仪器 异甘草素(纯度98%)由上海源叶生物科技公司提供,蛋白芯片由Ray biotechnology公司提供。
1.2 方法
45只大鼠随机分为假手术组、模型组、治疗组各15只。
1.2.1 脑外伤模型制备 采用改良Feeney法[5],自制打击器,由撞杆、下落打击棒和金属套管三部分组成。打击棒质量30 g,下落高度30 cm,打击直径3 mm,打击深度3 mm。大鼠用10%水合氯醛(30 mg/kg)腹腔注射麻醉后,固定头部,消毒后于矢状正中线切开头皮,分离软组织及骨膜,用小型电钻在左顶叶上方开直径约4 mm的骨窗,并保持硬膜完整。将打击装置垂直固定于大鼠的脑表面,打击棒沿金属套管从30 cm高度打击头部致伤(冲击力为900 g·cm),造成左侧大脑半球局部脑挫裂伤损伤。充分止血后,碘伏消毒伤口并缝合头皮,假手术组仅开骨窗不打击。用1%的吐温生理盐水将异甘草素配置成悬液,术后2 h治疗组给予异甘草素30 mg/kg腹腔注射治疗1次/d,假手术组和模型组给予等量的1%吐温生理盐水腹腔注射1次/d,均治疗5 d。
1.2.2 细胞因子和脑含水量检测 各组任取10只大鼠,断头取血,分离血清,用蛋白芯片法检测血清 IFNγ、MCP-1、IL-2、IL-4、IL-13含量。取大鼠损伤侧脑组织,去除凝血,用冰冷生理盐水冲洗脑组织表面血迹,滤纸吸去脑组织表面残余水分,用电子天平测其湿重,然后于75℃通风烘烤箱烘烤72 h至恒重,取出称干重,计算含水量:脑含水量=(湿重-干重)/湿重×100%。
1.2.3 海马切片观察 各组取5只大鼠,断头取脑,用冷生理盐水内外冲洗脑组织,甲醛内固定,滤纸吸去脑组织表面残余水分,浸入4%多聚甲醛固定48 h,以损伤灶中心行脑组织切片,HE染色观察海马病理变化。Olympus显微镜放大400倍,计数各组随机10个视野下海马CA3区神经元个数。
1.3 统计学处理
采用SSPS 17.0统计软件分析数据,计量资料以(均数±标准差)表示,均数比较采用单因素方差分析,多组间比较采用检验,<0.05为差异有统计学意义。
2 结果
2.1 细胞因子检测结果
治疗组的IFNγ、MCP-1、IL-2、IL-4和IL-13与模型组比较差异有统计学意义(<0.05),其中MCP-1和IL-4的含量增高更加明显(<0.01),见表1。
表1 3组血液细胞因子比较(pg/mL,±s)

表1 3组血液细胞因子比较(pg/mL,±s)
注:与假手术组比较,①<0.05;与模型组比较,②<0.05,③<0.01
组别只数I F N -γ M C P -1 I L -2 I L -4 I L -1 3假手术组 5 7 . 5 3 ± 0 . 4 5 2 2 1 . 6 1 ± 1 2 . 8 4 1 3 6 . 3 8 ± 9 . 8 2 1 . 4 2 ± 0 . 1 8 9 . 0 4 ± 0 . 8 8 7 . 5 3 ± 1 . 2 1①治疗组 5 6 . 5 1 ± 0 . 1 2② 3 0 2 . 5 6 ± 1 6 . 3 3③ 1 2 7 . 8 1 ± 9 . 1 4② 2 . 5 9 ± 0 . 2 3③ 7 . 9 4 ± 0 . 7 3②模型组5 7 . 5 0 ± 0 . 4 0 9 5 . 2 5 ± 1 1 . 5 7①9 3 . 3 7 ± 7 . 5 6①1 . 7 8 ± 0 . 1 7①
2.2 脑含水量检测结果
假手术组、模型组、治疗组的脑含水量分别为(71.15±1.92)%、(75.53±2.13)%、(73.20±1.54)%,模型组与假手术组比较脑含水量明显增加(<0.01),治疗组与模型组比较脑含水量减少(<0.05)。
2.3 海马组织病理切片观察
假手术组海马组织结构清晰,层次分明,细胞排列整齐分布均匀,细胞数目较多,大小形态均匀,结构良好;模型组海马组织结构层次欠清,细胞明显减少,大小形态不均,可见较多核溶解细胞;治疗组可见海马组织结构较为清晰,细胞数目比模型组明显增多,大小形态较均一,结构未见明显异常,见图1。假手术组、模型组、治疗组海马CA3区神经元计数分别为(42.61±8.27)、(16.82± 6.32)、(35.24±7.54)个,模型组低于假手术组(<0.01),治疗组高于模型组(<0.01)。
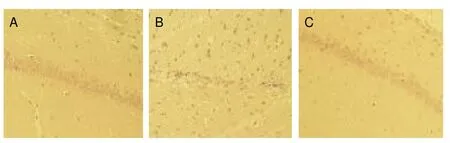
图1 假手术组(A)、模型组(B)、治疗组(C)海马组织病理(HE染色,×400)
3 讨论
创伤性脑损伤后血脑屏障破坏,大量细胞因子释放,外周血和脑组织之间的细胞因子相互渗透。Gong等[6]报道脑损伤后血肿内和血肿周围存在以中性粒细胞、巨噬细胞、活化的小胶质细胞渗出为特征的炎症反应,并释放多种炎性细胞因子。血液中的IL-2、IL-4、IL-13、MCP-1和IFNγ来源于淋巴细胞、单核/巨噬细胞、神经元和胶质细胞等。中枢神经系统中广泛存在的IL-2及其受体能刺激少突胶质细胞的增殖和成熟,保护受损的海马神经元,促进神经元存活和轴突生长[7]。IL-2还可以刺激离体垂体前叶细胞促肾上腺皮质激素的分泌,引起皮质醇明显上升,发挥广泛的抗炎作用。IL-4是重要的神经保护因子,可抑制 TNF-α、IL-1β、IL-6 mRNA的表达[8],抑制炎症连锁反应。IL-13能抑制炎症细胞因子和趋化因子的生成,阻止炎症级联反应,减轻炎症损害[9]。
Yamagami等[10]报道在脑损伤早期MCP-1的表达升高。MCP-1可促使单核/巨噬细胞到达炎症部位,吞噬坏死的细胞和组织碎片。MCP-1与其受体的相互作用可趋化脑室管膜下区神经干细胞向损伤或缺血部位迁移,促进组织修复。Bemadani等[11]发现,在敲除MCP-1基因的颅脑损伤模型中,神经干细胞向损伤处的迁移较对照组显著减少。另一方面MCP-1可引起脑组织损伤,阻断MCP-1的表达,减少单核/巨噬细胞激活,可减少缺血性神经元损伤[12,13]。IFNγ是神经损害性细胞因子[12],可减少IL-4和IL-10的合成和释放。本实验发现,治疗组较模型组的MCP-1、IL-2、IL-4和IL-13的血清浓度显著增高,IFNγ的含量减低。
脑组织含水量是反应脑水肿的重要指标,创伤性脑损伤后原发的血管性脑水肿和继发的细胞性脑水肿是加重脑损伤的重要原因[14]。本实验发现治疗组脑水肿程度明显轻于模型组,海马病理切片可见治疗组较模型组明显改善。Zhan等[15]报道异甘草素对局灶性脑缺血的小鼠有改善脑能量代谢的作用。本实验结果显示异甘草素可以调节炎症因子,促进脑组织修复。
[1]Lee MJ,Yang CH,Jeon JP,et al.Protective effects of isoliquirit igenin against methamp hetamine-induced neurotoxicity inmice[J].Pharmacol Sci,2009,111:216-220.
[2]Shichita T,Ago T,Kamouchi M,et al.Novel therapeutic strategies targeting innate immune responses and early inflammation after stroke[J]. Neurochem,2012,123:29-38.
[3]Kuo HS,Tsai MJ,Huang MC,et al.Acid fibroblast growth factor and peripheral nerve grafts regulate Th2 cytokine expression,macrophage activation,polyamine synthesis,and neurotrophin expression in transected rat spinal cords[J].Neurosci,2011, 31:4137-4147.
[4]Kim E,Febbraio M,Bao Y,et al.CD36 in the periphery and brain synergizes in stroke injury in hyperlipidemia[J].Ann Neurol,2012,71:753-764.
[5]Feeney DM,Boyeson MG,Linn RT,et al.Responses to cortical injury:I.Methodology and local effects of contusions in the rat[J].Brain Res,1981, 211:67-77.
[6]Gong C,Hoff JT,Keep RF.Acute inflammatory reaction following experimental intracerebral hemorrhage in rats[J].Brain Res,2000,871:57-65.
[7]Mukaida N,Mastsumoto T,Yokoi K,et al.Inhabition of neutrophil mediated acute inflammation injury by antibody against interleukin8(IL-8)[J].Inflamm Res,1998,47:151-157.
[8]Schwarze J,Cieslewicz G,Joetham A,et al.Critical roles for inter-leukin-4 and interleukin-5 during respiratory syncytial virus infection in the development of airway hyperresponsiveness after airway sensitization[J].Am J Respir Crit Care Med,2000,162: 380-386.
[9]McKenzie AN,Zurawski G.Interleukin-13: characterization and biologic properties[J].Cancer Treat Res,1995,80:367-378.
[10]Yamagami S,Tamura M,Hayashi M,et al.Differential production of MCP-1 and cytokine-induced neutrophil chemoattractant in the ischemic brain after transient focal ischemia in rats[J].Leukoc Biol,1999, 65:744-749.
[11]Belmadani A,Tran PB,Ren D,et al.Chemokines regulate the migration of neural progenitors to sites of neuroinflammation [J]. Neurosci, 2006, 26: 3182-3191.
[12]Kumai Y,Ooboshi H,Takada J,et al.Anti-monocyte chemoattractant protein-1 gene therapy protect S against focal brain ischemia in hypertensive rats [J].J Cereb Blood Flow Metab,2004,24: 1359-1368.
[13]Barone FC,Arvin B,White RF,et al.Tumor necrosis factor amediator of focal ischemic brain injury[J].Stroke,1997,28:1233-1244.
[14]Donkin JJ,Nimmo AJ,Cernak I,et al.Substance P is associated with the development of brain edema and functional deficits after traumatic brain injury[J].J Cereb Blood Flow Metab,2009,29:1388-1398.
[15]Zhan C,Yang J.Protective effects of isoliquiritigen in intransient middle cerebral artery occlusion-induced focal cerebral ischemia in rats[J].Pharmacol Res,2006,53:303-309.
Effects of Isoliquiritigenin on Serum Cytokine levels in Rats after Traumatic Brain Injury
Objective:To observe the effects of isoliquiritigenin on levels of serum IFNγ,MCP-1,IL-2,IL-4 and IL-13 in rats after traumatic brain injury (TBI).Methods:Forty-five rats were randomly divided into shamoperated,model and treatment groups with 15 rats in each group.The TBI model was established with the modified Feeney's method.In the rats in the sham-operated group the skull was just window-opened but without any blow.After the operation,the animals in treatment group were given isoliquiritigenin,while the rats in the sham-operated and model groups were given the same volume of normal saline.On day 5 after TBI,the serum cytokines were measured and brain water content was determined.The morphology of neurons in hippocampus was observed.Results:When compared with the model group,the level of IFNγ in the treatment group was decreased(<0.05),while the levels of MCP-1,IL-2,IL-4 and IL-13 in the treatment group were increased(<0.05).The water content of brain in the treatment group was decreased compared to that in the model group(<0.05).And compared with the model group,the morphology of hippocampus was improved(<0.05).Conclusion:Isoliquiritigenin can promote brain tissue rehabilitation in rats after TBI,perhaps mediated by modulation of cytokines.
isoliquiritigenin;traumatic brain injury;cytokine
R741;R741.02
A DOI 10.3870/sjsscj.2014.02.006
兰州军区兰州总医院神经外科兰州 730050
2012解放军总后勤科研项目(No.CLZ12J006)
2013-09-02
荔志云lizhiyun456@163. com

